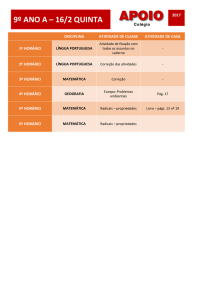
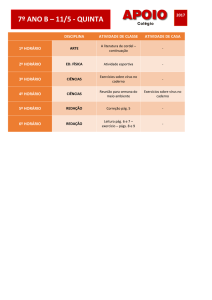
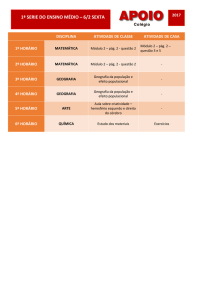
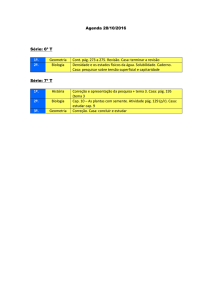
Exercícios Cap. 07
1- Qual é a base conjugada de cada um dos seguintes ácidos: HClO 4; H2S;
PH4+; HCO3- ?. Qual é o ácido conjugado de cada uma das seguintes bases:
CN-; SO42-; H2O; HCO3-?. pág. 568.
2- Calcule a concentração de H+(aq) em a) uma solução na qual [OH-] é 0,010
mol L-1; b) uma solução na qual [OH-] é 1,8x10-9 mol L-1. Suponha que a
temperatura é 25 C. pág. 572.
3- Calcule os valores de pH: a) para uma solução na qual [OH -] é 0,010 mol L-1;
b) uma solução na qual [OH-] é 1,8x10-9 mol L-1. Suponha que a temperatura é
de 25 C. pág. 574.
4- Uma amostra de suco de maça que foi espremido recentemente tem pH de
3,76. Calcule [H+]?. pág. 574.
5- Qual é o pH de a) uma solução de 0,028 mol L -1 de NaOH; b) uma solução
de 0,0011 mol L-1 de Ca(OH)2 ?. pág. 577.
6- Um estudante preparou uma solução de 0,10 mol L -1 de ácido fórmico
(HCHO2) e mediu seu pH usando um medidor de pH. Constatou que o pH a 25
C é 2,38. a) Calcule Ka para o ácido fórmico nessa temperatura. b) Qual a
porcentagem de ácido ionizada nessa solução de 0,10 mol L-1 ?. pág. 579.
7- Calcule a porcentagem de moléculas de HF ionizadas em a) uma solução de
0,10 mol L-1 de HF; b) uma solução de 0,010 mol L-1 de HF. pág. 583.
8- A solubilidade de CO2 em água pura a 25 C e 0,1 atm de pressão é 0,00037
mol L-1. A prática comum é supor que todo o CO2 dissolvido está na forma de
ácido carbônico (H2CO3), produzido pela reação entre CO2 e H2O:
CO2(aq) + H2O(l) H2CO3(aq)
Qual é o pH de uma solução de 0,0037 mol L-1 de H2CO3?. pág. 585.
9- Calcule a concentração de OH- em uma solução de 0,15 mol L-1 de NH3.
pág. 587.
10- Calcule a) a constante de dissociação básica, Kb, para o íon fluoreto (F-); b)
a constante de dissociação ácida, Ka, para o íon amônio (NH4+). pág. 591.
11- Determine se o sal Na2HPO4 formará uma solução ácida ou básica ao se
dissolver na água. pág. 594.
12- Coloque as seguintes soluções em ordem crescente de acidez: 0,1 mol L -1
de Ba(C2H3O2); 0,1 mol L-1 de NH4Cl; 0,1 mol L-1 de NH3CH3Br; 0,1 mol L-1 de
KNO3. pág. 594.
13- Coloque os compostos em cada uma das seguintes séries em ordem
crescente de força ácida: a) AsH3; HI; NaH; H2O; b) H2SeO3; H2SeO4; H2O.
pág. 597
14- Embora HCl e H2SO4 tenham propriedades muito diferentes como
substâncias puras, suas soluções aquosas possuem muitas propriedades em
comuns. Relacione algumas propriedades gerais dessas soluções e explique
seu comportamento comum em termos de espécies presentes. 16.1, pág. 603.
Resposta: As soluções de HCl e H2SO4 conduzem eletricidade, têm sabor
azedo, mudam a cor do papel de tornassol vermelho (são ácidas), neutralizam
as soluções de bases e reagem com metais ativos para formar H 2(g). As
soluções de HCl e de H2SO4 têm essas propriedades em comum porque
ambos os compostos são fortemente ácidos. Isto é, ambos dissociam-se
completamente em H2O para formar H+(aq) e um ânion. (HSO4– não está
completamente dissociado, mas a primeira etapa de dissociação para H 2SO4 é
completa.) A presença de íons possibilita que as soluções conduzam
eletricidade; a presença de H+(aq) acima de 1x10 -7 mol L-1 explica todas as
outras propriedades relacionadas.
15- Qual a diferencia entre as definições de um ácido de Arrhenius e de
Brnsted-Lowry?. b) NH3(g) e o HCl(g) reagem para formar o sólido iônico
NH4Cl(s). Qual substância é o ácido de Brnsted-Lowry nessa reação?. Qual é
a base de Brnsted-Lory. 16.3, pág. 603.
16- Qual é o significado do termo auto-ionização?. Explique por que água pura
é uma má condutora de eletricidade. Diz-se que uma solução aquosa é ácida.
O que significa essa declaração?.
17- Determine se o sal Na2HPO4 formará uma solução ácida ou básica ao se
dissolver na água. 16.7, pág. 604.
Resposta: A auto-ionização é a ionização de uma molécula neutra em um
ânion e um cátion. A expressão de equilíbrio para a auto-ionização da água é
H2O(l) H+(aq) + OH–(aq). A água pura é um condutor de eletricidade ruim
porque ela contém poucos íons. Se uma solução for ácida, ela contém mais
íons H+ do que OH–.
18- Por qual fator [H+] muda para uma variação de pH de; a) 2,00 unidades; b)
0,50 unidades ?. 16.23, pág. 604.
Resposta
a) [H+] varia de um fator de 100.
b) [H+] varia de um fator de 3,2.
19- Calcule [OH-] e o pH para; a) 1,5x10-3 mol L-1 de Sr(OH)2; b) 2,250 g de
LiOH em 250,0 mL de solução; c) 1,00 mL de 0,175 mol L -1 de NaOH diluído
para 2,0 L; d) uma solução formada pela adição de 5,00 mL de 0,105 mol L -1
de KOH a 15 mL de Ca(OH)2 9,5x10-2 mol L-1. 16.35, pág. 605.
Resposta:
a) [OH–] = 3,0 x10–3 mol L-1; pH = 11,48.
b) [OH–] = 0,3758 mol L-1; pH = 13,57.
c) [OH–] = 8,75 x 10–5 mol L-1; pH = 9,94.
d) [OH–] = 0,17 mol L-1; pH = 13,23.
20- O que é um ácido forte?. Uma solução é rotulada como 0,500 mol L-1. Qual
é [H+] para a solução?. Quais das seguintes espécies são ácidos fortes HF;
HCl; HBr; HI?. 16.31, pág. 605.
21- Calcule o pH de uma solução preparada pela adição de 15,0 g de hidreto
de sódio (NaH) em água suficiente para perfazer 2,500 L de solução. 16.39,
pág. 605.
22- Qual é a característica estrutural essencial de todas bases de BrnstedLowry?. 16.61, pág. 606.
23- Escreva a equação química e a expressão de Kb para a ionização de cada
uma das seguintes bases em solução aquosa: a) dimetilamina; b) (CH 3)NH; íon
carbonato, CO32-; c) íon formato, CHO2-. 16.63, pág. 606.
Exercícios Cap. 08
1- Determine se cada uma das seguintes substâncias apresentam maior
probabilidade de se dissolver em tetracloreto de carbono (CCl4) ou em água:
C7H16; NaSO4; HCl; e I2. pág. 454.
2- Calcule a concentração de CO2 em um refrigerante engarrafado com
pressão parcial de CO2 de 4,0 atm sobre o líquido a 25C. A constante da lei de
Henry para CO2 em água a 25 C é 3,1x10-2 mol L-1 atm-1. pág. 456.
3- Uma solução é preparada dissolvendo-se 13,5 g de glicose (C6H12O6) em
0,100 kg de água. Qual é a porcentagem em massa de soluto nessa solução?.
Encontrou-se que uma amostra de 2,5 g de água de um poço artesiano contém
5,4 g de Zn2+. Qual a concentração de Zn2+ em partes por milhão?. pág. 458.
4- Uma solução de ácido clorídrico contém 36 % de HCl em massa. a) Calcule
a fração em quantidade de matéria de HCl na solução. b) Calcule a molalidade
de HCl na solução. pág. 460.
5- A água e o glicerol (CH2(OH)CH(OH)CH2OH) são miscíveis em todas as
proporções. O que significa isso?. Como o grupo OH do álcool contribui para
essa miscíbilidade?. 13.13, pág. 477.
6- Uma solução de ácido sulfúrico contendo 571,6 g de H 2SO4 por litro de
solução tem densidade de 1,329 g cm3. Calcule, (a) a porcentagem em massa;
(b) a fração em quantidade de matéria; (c) a molalidade; (d) concentração em
quantidade de matéria de H2SO4 nessa solução. 13.31, pág. 478.
7- Descreva como você prepararia cada uma das seguintes soluções aquosas,
começando com KBr sólido: a) 0,75 L de KBr 1,5x10 -2 mol L-1 b) 125 g de 0,180
mol kg-1 de KBr, c) 1,85 L de uma solução de KBr de 12 % em massa (a
densidade da solução é 1,10 g mL-1; d) uma solução de 0,150 mol L-1 de KBr
que contenha KBr suficiente para precipitar 16,0 g de AgBr de uma solução
contendo 0,480 mol de AgNO3.13.37, pág. 478.K
Exercícios adicionais. Cap. 08
8- Defina os termos solução, colóides e dispersão. Coloque pelo menos um
exemplo para cada termo.
9- Que fatores afetam a solubilidade de uma substância sólida em um líquido.
Como esses fatores afetam a solubilidade de um gás em um líquido. Explique
esse comportamento em ambas situações a nível molecular. Coloque pelo
menos um exemplo para cada situação.
10- Explique em que consiste a lei de Henry. Que utilidade pratica e teórica ela
fornece?. Explique.