Experiência n° 1 – MEDIDAS
.
MEDIDAS
1. Objetivos
No final desta experiência o estudante deverá ser capaz de:
Usar e ler termômetros, balanças, provetas e pipetas;
Utilizar algarismos significativos;
Distinguir o significado de precisão e exatidão.
2. Introdução
Medidas são essenciais para todas as ciências. As propriedades fundamentais mais
utilizadas são comprimento, massa, tempo e temperatura. Outras propriedades da matéria
como volume, densidade ou velocidade são quociente ou produtos de propriedades
fundamentais. Assim unidades de volume são comprimento elevado ao cubo, unidades de
densidade são massa/(comprimento)3 e unidades de velocidade são comprimento/tempo.
O SI (Sistema Internacional de Unidades) que é o antigo sistema métrico expandido, é
um sistema decimal no qual os prefixos utilizados indicam frações e múltiplos de dez. Os
mais comuns em química são:
Mega
Kilo
Deci
Centi
Mili
Micro
Nano
Pico
M
K
d
c
m
n
p
106
103
10-1
10-2
10-3
10-6
10-9
10-12
Algarismos Significativos:
Um número de pessoas numa sala de aula e uma dúzia de ovos são números exatos.
Não há dúvida quanto ao número de pessoas dentro da sala de aula e uma dúzia de ovos. Por
outro lado, os números obtidos numa medida não são exatos.
Suponha a medida da temperatura indicada no termômetro seja de 25,6º ou 25,7º. Na
tentativa de medir a temperatura com precisão até uma casa depois da vírgula você teve que
fazer uma estimativa deste último algarismo. Existe a certeza de que a temperatura é maior do
que 25º C é menor do que 26º C, mas o último algarismo é duvidoso. O valor da temperatura
medida com esse termômetro possui, portanto 3 algarismos significativos e é incorreto
acrescentar um quarto algarismo, como em 25,63, pois se o algarismo 6 já é duvidoso não faz
sentido o acréscimo do algarismo 3. Com um termômetro mais preciso uma medida com
maior número de algarismos pode ser obtida.
Na leitura do volume de água em um frasco cilíndrico como uma proveta ou uma
bureta você notará que a superfície de água não é plana e forma um fenômeno chamado
menisco. Leia sempre o ponto mais baixo do menisco. Note também, que escrever as
unidades das medidas é tão importante quanto um número.
Experiência n° 1 – MEDIDAS
.
3. Procedimento Experimental
3.1 Medidas de Temperatura
3.1.1
3.1.2
3.1.3
Coloque cerca de 200 mL de água da torneira em um béquer, meça e anote a temperatura
utilizando o termômetro, descarte a água na pia..
No béquer prepare uma mistura de 20 mL de água e gelo (1 a 2 cubos). Agite devagar com o
bastão de vidro e meça a temperatura da mistura.
Adicione 5g de cloreto de sódio (sal de cozinha) na mistura de gelo e água. Agite devagar com
o bastão de vidro e meça a temperatura da mistura.
3.2 Medidas de Massa
3.2.1
Três objetos: uma rolha de borracha, um cadinho de porcelana e um frasco de pesagem (vidro
de relógio), encontram-se em sua bancada.
Antes de pesá-los, pegue cada objeto e tente estimar qual o mais pesado e qual o mais
leve, enumerando de 1 (mais pesado) a 3 (mais leve) na tabela da folha de dados.
3.2.2
Pese um béquer seco. Adicione então 50 gotas de água destilada com um conta-gotas e pese o
conjunto. O propósito deste procedimento é encontrar o número de gotas em um mililitro
(mL) e o volume de uma gota de água.
3.3 Medida de Volume (Exatidão e Precisão)
3.3.1
a)
b)
c)
d)
e)
3.3.2
Medida com a proveta:
Pese um béquer seco e anote o seu peso, anotando até uma casa depois da vírgula.
Meça 50 mL de água destilada utilizando uma proveta.
Coloque os 50 mL de água no béquer e pese-o novamente.
Meça novamente mais 50 mL de água e adicione no mesmo béquer e pese-o novamente.
Faça isso mais uma vez, ou seja, meça mais 50 mL de água e adicione no béquer, completando
150 mL e pese-o novamente.
Medida com a pipeta volumétrica:
a) Utilizando o mesmo béquer anteriormente pesado, seque-o bem e adicione 50 mL de água
destilada utilizando uma pipeta volumétrica, a seguir pese-o.
b) Meça novamente mais 50 mL de água e adicione no mesmo béquer e pese-o novamente.
c) Faça isso mais uma vez, ou seja, meça mais 50 mL de água e adicione no béquer, completando
150 mL e pese-o novamente.
4. Questionário
1234-
Explique as observações no item 3 do procedimento 3.1.
Como você pode medir ¼ mL de água com o equipamento utilizado no item 3.2.2 e conhecida a
densidade água (1,0 g/mL)?
Na avaliação da massa de 50 mL de água (procedimento 3.3) foram utilizadas uma proveta e uma
pipeta volumétrica. Qual dos dois possui melhor precisão? Explique sua resposta.
50 mL de água a 20oC possui uma massa de 49,915 g. Comparando os resultados que você obteve
no procedimento 3.3, foi a proveta ou a pipeta que deu um resultado mais próximo do valor, ou
seja, qual dos dois é mais exato? Explique sua resposta.
Experiência n° 1 – MEDIDAS
.
FOLHA DE DADOS
Equipe:__________________________________________________ Turma:_______
__________________________________________________
Data:___/___/___
3.1
Medidas de Temperatura
3.1.1 Temperatura da água da torneira: ________oC
3.1.2 Água com gelo : - Depois de agitada: ________ oC
- Com o sal adicionado: ________ oC
3.2
Medidas de Massa
3.2.1 Numere de 1 a 3 os objetos (1 = mais pesado)
Objeto
Ordem de massa
estimada
Massa medida (g)
Ordem de massa
real
Rolha de borracha
Frasco de pesagem
Cadinho de Porcelana
3.2.2
Medida da massa de uma gota de água
Massa do béquer: _________g
Massa do béquer + 50 gotas de água: _________g
Massa de 50 gotas de água: _________g
Massa de 1 gota de água:____________g
3.3 Medida de Volume:
PROVETA (3.3.1) PIPETA (3.3.2)
Massa do béquer antes da adição da água
Após a adição do 1o (50 mL) de água
Após a adição do 2o (50 mL) de água = 100ml
Após a adição do 3o (50 mL) de água = 150 ml
Massa do 1o (50 mL) de água
Massa do 2o (50 mL) de água
Massa do 3o (50 mL) de água
Média das três medidas de massa
Desvio de cada medida com relação à média
Média dos desvios
Valor da medida
(
)g
(
)g
Experiência n° 1 – MEDIDAS
.
ANEXO 1
1. Algarismos Significativos
Os algarismos significativos compreendem aqueles conhecidos com certeza mais o
algarismo duvidoso. Por exemplo, ao medir o volume de uma amostra líquida numa proveta
de 25 mL, cuja menor divisão é 0,1 mL, encontrou – se o valor 17,24 mL, este resultado tem
quatro algarismos significativos (os dígitos um, sete e dois são conhecidos com certeza e o
quatro é o algarismo duvidoso – aquele que foi estimado).
O algarismo duvidoso sempre está na casa decimal em que está o limite de erro de
aparelho de medida utilizado. O limite de erro de um equipamento corresponde à metade de
sua menor divisão. No caso do exemplo da proveta o limite é de 0,05 mL; por isso o dígito 4
corresponde ao algarismo duvidoso. Já no caso de um valor de massa igual a 7, 241 g, medido
numa balança cujo fundo de escalas é 0, 001 g (para balanças, o limite de erro é igual à menor
divisão), os dígitos sete, dois e quatro são conhecidos com certeza e o um é o algarismo
duvidoso.
Considere as medidas 0,05 mL e 0,001 g. Ambas têm somente um algarismo
significativo. Expressando as grandezas em notação científica se tem 5.10-2 mL e 1.10-3 g,
torna-se evidente a presença de um único algarismo significativo.
↠ Lembrando a regra: “Se à esquerda de um número só houver zeros, estes zeros não
são algarismos significativos”.
No caso dos zeros estarem à direita, a decisão deve ser tomada levando – se em conta
o limite de erro do aparelho utilizado. Assim, um volume de “500 mL” deve ser expresso
como :
a) 500,0 mL ou 5,000.10² mL, se a menor divisão da proveta utilizada for 1 mL, isto
é, 500,0 (±0,5) mL;
b) 500 mL ou 5,00.10² mL , se a menor divisão da proveta utilizada for 10 mL, isto
é, 500 (±5) mL;
Já uma massa de “200 g” deve ser expressa como:
a) 200,00 g, se o fundo de escala da balança for centigrama, isto é 0,01 g, isto é,
200,00 (±0,01) g;
b) 200,0 g, se o fundo de escala da balança for decigrama, isto é 0,1 g, isto é, 200,0
(±0,1) g;
2. Operações com Algarismos Significativos
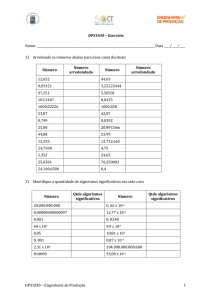
2.1 Arredondamento de Números
As operações realizadas com calculadoras geram vários algarismos, mas a resposta
deve ser coerente com o número de algarismos que representam o limite de erro do
equipamento. Por exemplo, não tem sentido escrever 1,09867 g para o resultado de um
Experiência n° 1 – MEDIDAS
.
cálculo com massas medidas numa balança de fundo de escala de 0,1g. O procedimento para
o arredondamento é:
a) Quando o algarismo seguinte ao último número a ser mantido é menor que 5, todos
os algarismos indesejáveis devem ser descartados e o último número é mantido
intacto. Exemplos: ao se arredondar 2,14 para dois algarismos significativos,
obtém – se 2,1; ao se arredondar 4,372 para três algarismos significativos, obtém–
se 4,37;
b) Quando o algarismo seguinte ao ultimo numero a ser mantido é maior que 5, ou 5
seguido de outros dígitos, o último número é aumentado em 1 e os algarismos
indesejáveis são descartados;
c) Quando o algarismo seguinte ao último número a ser mantido é um 5ou um 5
seguido de zeros, há duas possibilidades:
se o último algarismo a ser mantido for ímpar, ele é aumentado em 1 e o 5
indesejável (e eventuais zeros) é descartado;
se o ultimo algarismo a ser mantido for par ( zero é considerado par), ele é
mantido inalterado e o 5 indesejável ( e eventuais zeros) é descartado.
Exemplos: ao se arredondar 3,250 para dois algarismos significativos, obtém – se 3,2
ao se arredondar 7,635 para três algarismos significativos, obtém – se 8,10.
Note que, neste caso, o último dígito do número arredondado sempre será par.
2.2 Adição e Subtração
O resultado de uma soma ou de uma subtração deve ser relatado com o mesmo
numero de casas decimais que o termo com o menor número de casas decimais. Por exemplo,
os resultados da seguintes soma e subtração.
6,3
90
+ 2,14 e
- 2,14
------------------8,44 = 8,4
87,86 = 88
Devem ser relatados como 8,4 e 88, respectivamente , pois 6,3 tem somente uma casa
decimal e 90 nenhuma.
2.3 Multiplicação e Divisão
O resultado de uma multiplicação ou de uma divisão deve ser arredondado para o
mesmo número de algarismos significativos que o do termo com menor número de algarismos
significativos. Exemplos:
6,3 X 2,14 = 13,482 = 13 e 6,3 /2,14 = 2,9439252 = 2,9
Os arredondamentos realizados nos cálculos envolvendo experimentos ou
exercícios deverão ser feitos somente para o resultado final. O objetivo é a padronização
das respostas, pois se o arredondamento é feito após cada operação, o resultado final
terá valores diferentes.
Experiência n° 1 – MEDIDAS
.
ANEXO 2
1 Tratamentos e Registro de Dados Experimentais
1.1 Erros de medidas
O processo de medidas consiste em atribuir um valor numérico a uma grandeza física,
considerando um determinado sistema de referência. Cada grandeza utiliza equipamentos
específicos para as medidas. Qualquer medida está sujeita a erro devido às limitações do
observador, do método ou do equipamento usado. Assim, procura-se eliminar as possíveis
fontes de erro para garantir a confiabilidade de uma medida.
1.2 Classificação dos erros de medidas
a) Erros grosseiros
São erros resultantes da manipulação da amostra ou do equipamento pelo observador. São
causados por descuido, falta de habilidade manual ou de capacidade técnica do observador.
Os erros grosseiros podem ser evitados através do treinamento do observador.
b) Erros sistemáticos
São erros que se repetem, são constantes, tornando sistematicamente maiores ou menores
que o valor mais provável da grandeza. Estão relacionadas com as imperfeições dos
instrumentos de observação (equipamentos não calibrados), do método e dos reagentes
utilizados (por exemplo, presença de impureza). Os erros sistemáticos podem ser detectados
pela comparação dos dados obtidos por diferentes observadores ou através de diferentes
instrumentos do mesmo tipo.
c) Erros aleatórios
Devem-se a mudanças que ocorrem sem regularidade nas condições de medida, causadas
por exemplo por flutuações na corrente ou na diferença de potencial elétrico, vibrações
mecânicas, correntes de ar e interferências eletromagnéticas. A ocorrência desse tipo de erro
não pode ser prevista e frequentemente não pode ser controlada pelo observador. Entretanto,
admite-se que os erros aleatórios sigam a Lei da Distribuição Normal ou Distribuição de
Gauss, podendo portanto se submetidos a tratamento estatístico para a determinação do valor
mais provável a partir de uma série de medidas.
1.3 Definições de erros
Erro absoluto: é a diferença entre o valor exato (ou verdadeiro) da grandeza física e o seu
valor determinado experimentalmente.
Eabs= X - Xv, onde:
Eabs= erro absoluto
X= valor medido
Xv= valor verdadeiro da grandeza.
Nos casos em que o valor exato é desconhecido, se usa o valor mais provável ou
representativo. Esse valor é obtido pela média aritmética ou através da mediana do
conjunto de medidas realizadas.
Experiência n° 1 – MEDIDAS
.
Erro relativo(Erel): expressa a incerteza da determinação como uma fração da quantidade
medida, sendo calculada através da relação:
Erel= Eabs / Xv
O erro relativo é adimensional e é frequentemente expresso em partes por cem:
Erel percentual= Erel(%)= (Eabs/ Xv) x 100
Ou em partes por mil.
Exemplo: Uma certa amostra possui um teor exato de ferro igual a 65,80g de Fe/100g de
amostra. Numa análise, o teor obtido foi igual a 66,10 % (m/m). Calcular o erro absoluto e
o erro relativo dessa determinação.
Resolução:
Eabs=66,10g -65,80g= 0,30g de Fe/100g de amostra
Erel percentual=
0,30 gdeFe / 100 gdeamostra
x100
65,80 gdeFe / 100 gdeamostra
As unidades iguais se cancelam e,
Erel percentual= + 0,45%= 0,45 partes em cem ou 4,5 partes em mil
Precisão: A precisão de uma determinação está relacionada com a concordância entre as
diversas medidas de uma mesma quantidade (reprodutibilidade). Assim, quanto menor for a
dispersão dos valores obtidos, mais precisa será a determinação.
Exatidão: A exatidão de uma medida tem relação com seu erro absoluto, ou seja, com a
proximidade entre o valor medido e o valor verdadeiro da grandeza. A exatidão pode ser
alcançada através da eliminação dos erros e do aumento da precisão.
Exemplo: considere que um objeto teve sua massa determinada oito vezes numa balança de
centigramas, com os seguintes resultados (o valor “ 0,01g” refere-se à incerteza associada ao
emprego da balança de centigramas):
14,22 0,01g
14,20 0,01g
14,20 0,01g
14,20 0,01g
14,21 0,01g
14,22 0,01g
14,21 0,01g
14,21 0,01g
Esta determinação pode ser considerada precisa, uma vez que há pequena diferença entre
resultados individuais.
Considere agora que a massa verdadeira do objeto é igual a 14,22g. De posse desta
informação, pode-se afirmar que a determinação realizada é exata, além de precisa, pois os
valores encontrados diferem pouco do valor verdadeiro da grandeza.
Experiência n° 1 – MEDIDAS
.
Referência Bibliografia:
SILVA. Roberto Ribeiro da; BOCCHI. Nerilso; FILHO. Romeu Cardoso Rocha. Introdução à
Química Experimental.Ed. McGraw – Hill.São Paulo 1990.
PAWLOWSKY, Alda Maria e colaboradores. Experimentos de Química Geral – 2 ° edição,
Ed. UFPR