CGE - GAB. 1 - VEST./2000
1o DIA
15
QUÍMICA - QUESTÕES DE 31 A 45
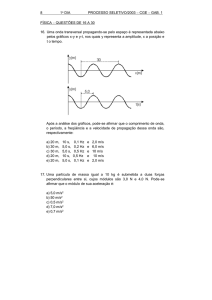
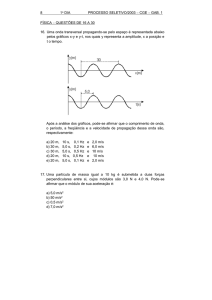
31. Ao se fazer um churrasco de carne vermelha, percebe-se, à distância, um
aroma característico. Isto se deve, em parte, à reação de decomposição do
glicerol, com formação de acroleína, um líquido de forte odor.
OH OH OH
CH2CH2CH2
Glicerol
O
H2C CHC
H
+
H2O
Acroleína
Assinale a opção INCORRETA:
a) O glicerol é um triol.
b) A acroleína é um aldeído.
c) A acroleína é uma substância insaturada.
d) A formação de acroleína necessita de aquecimento.
e) A acroleína tem temperatura de ebulição maior que a do glicerol.
32. Das alternativas abaixo, aquela que NÃO representa um fenômeno químico é:
a) queima de uma folha de papel.
b) dissolução de um comprimido efervescente em água.
c) evaporação da água dos oceanos.
d) destruição da camada de ozônio.
e) digestão dos alimentos no organismo humano.
33. A alternativa que apresenta um nome possível para um composto de fórmula
molecular C5H10O é:
a) pentan-2-ona
b) pentan-2-ol
c) ácido pentanóico
d) etoxipropano
e) etanoato de propila
1o DIA
16
CGE - GAB. 1 - VEST./2000
34. A azadiractina é um composto natural isolado da árvore indiana Azadirachta
indica com potente atividade nematicida e antialimentar para insetos.
O
1
2
O
O
O
OH
O
O
O
4
OH
O
O
O
O
3
Azadiractina
As funções de 1 a 4 marcadas na estrutura da azadiractina são,
respectivamente:
a) alqueno, éster, álcool, ácido carboxílico.
b) alqueno, éter, álcool, éster.
c) dieno, cetona, fenol, éster.
d) alquino, éter, fenol, cetona.
e) alqueno, álcool, éter, ácido carboxílico.
35. O hidrogênio (H2) funciona como agente oxidante na reação representada por:
a) H2 + Cl2 2 HCl
b) 8 H2 + S8 8 H2S
c) 2 H2 + O2 2 H2O
d) H2 + 2 K 2 KH
e) 3 H2 + N2 2 NH3
CGE - GAB. 1 - VEST./2000
1o DIA
17
36. Considere a reação representada por: A + B C.
A tabela abaixo mostra os tempos necessários para que a reação acima se
complete com várias concentrações iniciais dos reagentes.
[A] / (mol L-1)
1
2
4
1
[B] / (mol L-1)
1
1
1
2
T / min.
60
30
15
60
Assinale a afirmativa CORRETA:
a) Aumentando-se a concentração de A, diminui-se a velocidade da reação.
b) Aumentando-se a concentração de B, aumenta-se a velocidade da reação.
c) Duplicando-se a concentração de A, duplica-se a velocidade da reação.
d) A concentração de A não afeta a velocidade da reação.
e) A concentração de B afeta a velocidade da reação.
37. A soma dos coeficientes mínimos inteiros da equação abaixo representada,
após o balanceamento, é:
KMnO4 + FeSO4 + H2SO4 MnSO4 + Fe2(SO4)3 + K2SO4 + H2O
a) 7
b) 15
c) 40
d) 36
e) 21
38. Uma solução aquosa de nitrato de cobre(II) foi preparada dissolvendo-se
93,75 g de Cu(NO3)2 em 1,0 L de solução. A concentração de íons nitrato, em
mol L-1, é, aproximadamente:
a) 0,5
b) 1,4
c) 2,0
d) 0,7
e) 1,0
1o DIA
18
CGE - GAB. 1 - VEST./2000
39. A seguir são apresentadas as equações de quatro reações:
I - H2 + Cl2 2 HCl
II - SO2 + H2O H2SO3
III - 2 SO2 + O2 2 SO3
IV - 2 Al(OH)3 Al2O3 + 3 H2O
São reações de oxi-redução:
a) I e II
b) I e III
c) II e IV
d) I, II e III
e) II, III e IV
40. Considere as afirmativas abaixo:
- A primeira energia de ionização é a energia necessária para remover um
elétron de um átomo neutro no estado gasoso.
II - A primeira energia de ionização do sódio é maior do que a do magnésio.
III - Nos períodos da tabela periódica, o raio atômico sempre cresce com o
número atômico.
IV - A segunda energia de ionização de qualquer átomo é sempre maior do
que a primeira.
I
São afirmativas CORRETAS:
a) I, II, III e IV
b) I e IV
c) I e II
d) II e III
e) II e IV
CGE - GAB. 1 - VEST./2000
1o DIA
19
41. Considere as semi-equações e os potenciais padrão (Eo) de redução:
Ag+ + e- Ago
Ni2+ + 2 e- Nio
Eo = + 0,80 V
Eo = - 0,25 V
A pilha eletroquímica que funcionará segundo a equação:
2 Ag+ + Nio 2 Ago + Ni2+
apresentará, nas condições padrão, o seguinte potencial (Eo):
a) - 1,05 V
b) + 1,05 V
c) + 1,85 V
d) + 1,35 V
e) + 0,55 V
42. Dos conceitos abaixo, o único que está enunciado de maneira CORRETA é:
a) Uma solução heterogênea é constituída por duas ou mais fases.
b) A eletronegatividade aumenta da direita para a esquerda e de cima para
baixo.
c) A água é uma substância composta, pois é formada por moléculas de
hidrogênio e de oxigênio.
d) Uma solução de ácido acético apresentará pH menor do que 7, a 25 oC.
e) Um objeto de alumínio é sempre mais leve do que um de chumbo.
43. Em um recipiente são colocados para reagir 40,0 g de ácido sulfúrico (H 2SO4)
com 40,0 g de hidróxido de sódio (NaOH). Sabe-se que um dos reagentes está
em excesso. Após a reação se completar, permanecerão sem reagir:
a) 18,1 g de H2SO4
b) 16,3 g de NaOH
c) 32,6 g de NaOH
d) 9,0 g de H2SO4
e) 7,4 g de NaOH
1o DIA
20
CGE - GAB. 1 - VEST./2000
44. As estruturas dos compostos responsáveis pelas fragrâncias artificiais de
jasmim (I) e de flor de laranjeira (II) são apresentadas abaixo:
O
C
H
C
C
O
CH2
H
C
OH
C5 H11
( I)
( II )
Assinale a opção CORRETA:
a) Somente I reage com uma solução de bromo, descorando-a.
b) Somente I sofre reação de substituição eletrofílica no anel benzênico.
c) I e II reagem com solução de hidróxido de sódio para formar um sal.
d) II sofre reações características de alquenos.
e) I e II têm o mesmo número de elétrons .
45. A 1 litro de solução de ácido clorídrico (HCl) de pH = 2 são adicionados 9 litros
de água destilada. O pH da solução final é:
a) 1
b) 2
c) 3
d) 4
e) 5