Curso Conceito A
Lista de exercícios de estequiometria
Prof. Vítor Diniz
Questão 1.
Calcule as massas molares dos seguintes compostos abaixo (deixe seu raciocínio explícito
e a resposta em destaque para que você possa usá-la em outros exercícios):
1) CO2
6) C3H8
2) Mg(OH)2
7) H4P2O7
3) Ca3(PO4)2
8) NO2
4) ZnCl2
9) NH4NO3
5) H2SO4
10) NH4OH
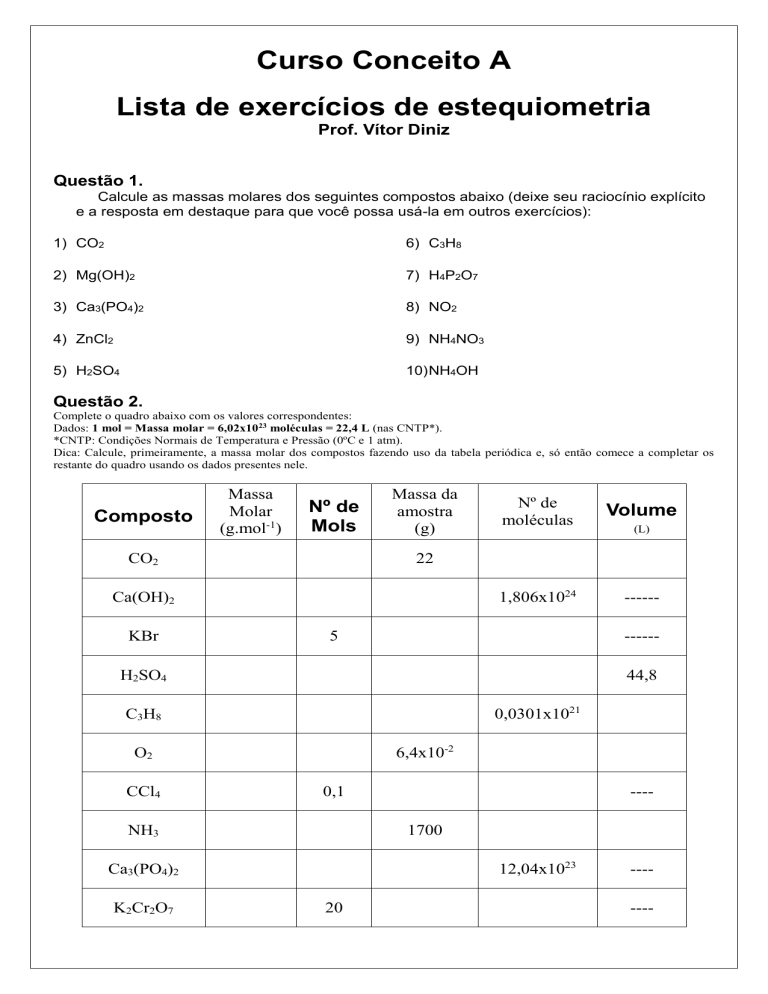
Questão 2.
Complete o quadro abaixo com os valores correspondentes:
Dados: 1 mol = Massa molar = 6,02x1023 moléculas = 22,4 L (nas CNTP*).
*CNTP: Condições Normais de Temperatura e Pressão (0ºC e 1 atm).
Dica: Calcule, primeiramente, a massa molar dos compostos fazendo uso da tabela periódica e, só então comece a completar os
restante do quadro usando os dados presentes nele.
Composto
Massa
Molar
(g.mol-1)
Nº de
Mols
CO2
Massa da
amostra
(g)
Volume
1,806x1024
------
5
------
H2SO4
44,8
0,0301x1021
C3H8
6,4x10-2
O2
CCl4
0,1
NH3
---1700
12,04x1023
Ca3(PO4)2
K2Cr2O7
(L)
22
Ca(OH)2
KBr
Nº de
moléculas
20
-------
Questão 3.
Faça o balanceamento das equações abaixo:
a)
H3PO4 +
b)
Bi(OH)3
c)
Sr(OH)2 +
d)
NaOH +
e)
Na2O +
f)
C6H12O6 +
g)
Fe2O3 +
Ca(OH)2
Ca3(PO4)2 +
Bi3+
água
HI
SrI2
HCN
H2O
O2
CO
H2O
+
OH-
+
H2O
NaCN +
H2O
NaOH
CO2 +
Fe
H2O
+
CO2
Questão 4.
Em uma pessoa adulta com massa de 70,0 Kg há 1,6 Kg de cálcio. Qual seria a massa
dessa pessoa, em Kg, se a natureza houvesse, ao longo do processo evolutivo, escolhido o bário
em lugar do cálcio?
Dados: Massas atômicas: Ca = 40; Ba = 137. Deixe seu raciocínio e resposta explícitos.
Questão 5.
(Unicamp-SP) Certos solos, por razões várias, costumam apresentar uma acidez relativamente
elevada. A diminuição dessa acidez pode ser feita pela adição ao solo de carbonato de cálcio,
Ca(OH)2, ocorrendo uma das reações, a seguir apresentadas:
CaCO3 + 2H+
Ca(OH)2 + 2H+
Ca2+
+
CO2
+
H2O
Ca2+ + 2H2O
Um fazendeiro recebeu uma oferta de fornecimento de carbonato de cálcio ( CaCO3 ) ou de
hidróxido de cálcio ( Ca(OH)2 ), ambos a um mesmo preço por quilograma. Qual dos dois seria
mais vantajoso, em termos de menor custo, para adicionar à mesma extensão de terra? Justifique.
______________________________________________________________________________
Atenção:
O primeiro passo para se realizar qualquer cálculo estequiométrico é conferir se a equação
química está devidamente balanceada, se não estiver, faça o balanceamento.
As CNTP (Condições Normais de Temperatura e Pressão), são: 1 atm (pressão de 1
atmosfera) e 0 ºC. Lembre-se que, nessas condições o volume de qualquer gás é de 22, 4
Litros.
O número de moléculas contidas em 1 mol de qualquer substância é 6,02x10 23 moléculas
(constante de Avogadro).
Cálculos da massa molecular deverão ser feitos a partir da sua tabela periódica. Será
permitido arredondamento dos valores para a resolução dos exercícios.
__________________________________________________________________
Questão 06.
O gás amoníaco pode ser obtido a partir do nitrogênio em reação com o hidrogênio, de
acordo com a equação:
N2 (g)
+
H2 (g)
NH3(g)
Calcule, após o balanceamento da equação:
a) O número de mols de N2 necessários para consumir 9 mols de H2.
b) O número de mols de NH3 obtidos a partir dos mesmos 9 mols de H2.
c) Ao desejar-se obter 4 mols de NH3, quantos mols de H2 deveriam ser empregados na reação?
Questão 07.
Dada a equação:
Zn + HCl
ZnCl2 +
H2
Calcule;
a) O número de mols de zinco que reagem com 20 mols de HCl.
b) O número de mols de H2 que se formam a partir de 5 mols de HCl.
Questão 08.
Considere a equação: C3H8 + O2 CO2 + H2O
Determine:
a) O número de moléculas de O2 que reagem com 6,02x1023 moléculas de C3H8;
b) O número de moléculas de CO2 que se formam a partir de 1,204x1024 moléculas de O2;
c) O número de moléculas de H2O que se formam a partir de 6,02x1025 moléculas de C3H8.
Questão 09.
A decomposição térmica do nitrato de amônio é representada pela equação:
NH4NO3
N2O
+
H2O
Calcule a massa, em gramas, de nitrato de amônio necessária para produzir 1,806x10 24
moléculas de água. Dados: N=14, H=1, O=16.
Questão 10.
Considere a reação:
HCl + Ca(OH)2 CaCl2 + H2O , utilizando 148g de hidróxido de
cálcio, calcule:
a) A massa, em gramas, de ácido clorídrico que reage;
b) A massa, em gramas, de cloreto de cálcio que se forma;
c) O número de moléculas de água que se formam.
Questão 11.
O sulfeto de zinco sofre combustão, de acordo com a equação:
ZnS +
O2
ZnO
+
SO2
Partindo de 28L de oxigênio nas CNTP, calcule:
a)
b)
c)
d)
A massa, em gramas, de sulfeto de zinco que reage:
O número de moléculas de óxido de zinco que se formam:
O número de mols de SO2 que se forma.
O volume de SO2 que se forma.
Questão 12.
O gás amoníaco pode ser obtido a partir do nitrogênio em reação com o hidrogênio, de acordo
com a equação:
N2 + H2 NH3
Utilizando 3,01x1025 moléculas de nitrogênio, calcule:
a) O volume de hidrogênio, nas CNTP, necessário para a reação;
b) A massa, em gramas, de gás amoníaco que se obtém.
Questão 13.
A combustão completa do gás de isqueiro, butano (C4H10), ocorre de acordo com a equação:
C4H10 +
O2
CO2
+
H2O
Na combustão de 0,58g de gás de isqueiro, determine:
a) A massa de gás O2 consumido;
b) O volume de gás CO2 formado nas CNTP.
Questão 14.
A produção de cal virgem é realizada pela decomposição térmica (pirólise) do calcário:
CaCO3
CaO
+
CO2
Qual a massa de cal virgem (CaO), poderá ser obtida a partir de 1,0 tonelada de CaCO3?
Questão 15.
A água oxigenada, solução aquosa de H2O2, é guardada em frascos escuros para evitar a
decomposição:
H2O2
H2O
+
O2
Com base nessas informações, calcule o volume de O2 que seria produzido pela decomposição de
170g de H2O2 nas CNTP.
Questão 16.
Um caminhão derramou acidentalmente na estrada uma solução contendo 730 Kg de ácido
clorídrico. Para neutralizar o ácido, o Corpo de Bombeiros jogou CaCO 3, que reage de acordo com
o seguinte processo já balanceado:
CaCO3 + 2 HCl CaCl2 + CO2 + H2O
a) Calcule a massa de CaCO3 que neutralizará o ácido clorídrico.
b) Determine o volume de gás carbônico produzido a 25ºC e 1 atm. (Dado: volume de 1 mol
de CO2 a 25ºC e 1 atm = 24 L ).
Questão 17.
A produção de alumínio, através de Al2O3 presente na bauxita, pode ser equacionada por:
Al2O3 +
C
Al
+
CO
Com base na equação, responda:
a) Qual a massa de alumínio será obtida a partir de 510 toneladas de Al2O3 ?
b) Que volume de CO, um gás muito tóxico, será produzido a partir de 1,0 mol de Al2O3, nas
CNTP?
Questão 18.
Uma das maneiras de impedir que o SO2, um dos responsáveis pela “chuva ácida”, seja
liberado para a atmosfera é tratá-lo previamente com óxido de magnésio (MgO), em presença de
ar, como equacionado a seguir:
MgO(s) + SO2 (g) + ½ O2 (g)
MgSO4 (s)
Quantos quilos de óxido de magnésio são consumidos no tratamento de 960 quilos de SO 2?
(Massas atômicas em g/mol: MgO = 40g e SO2 = 64g).
Questão 19.
O monóxido de nitrogênio (NO), poluente formado nos motores de combustão interna, pode
ser eliminado pela reação com amônia (NH3), ocorrendo a formação de nitrogênio e vapor de
água.
a) Escreva a equação balanceada da reação mencionada.
b) Sabendo que um veículo emite 5,00x104g de monóxido de nitrogênio por ano, quantos
quilogramas de amônia seriam necessários para eliminar, por reação completa, essa
quantidade de poluente? Deixar resposta e raciocínio explícitos.
Questão 20.
Um vinho comercial contém cerca de 9,7% de álcool etílico por massa. Suponha que
237,11 Kg de vinho sejam produzidos pela reação de fermentação da glicose, descrita abaixo:
C6H12O6(aq)
C2H5OH(l) + CO2(g)
Calcule a massa de glicose necessária para produzir o álcool etílico no vinho.
Questão 21.
A principal fonte do SO2 liberado na atmosfera pelo homem é através da queima do carvão
mineral, combustível amplamente usado na produção de energia elétrica e que possui de 1 a 9%
de enxofre em sua composição (variável de acordo com a origem geográfica do carvão). O SO2 é
um dos causadores da chuva ácida através de sua oxidação no ar e posterior reação com a água
que é capaz de produzir o ácido sulfúrico (H2SO4). As reações de oxidação do enxofre e formação
do ácido estão abaixo representadas.
ETAPA I: Queima do enxofre presente no carvão;
Ss)
+
O2(g) → SO2(g)
ETAPA II: Oxidação do dióxido de enxofre na atmosfera;
SO2(g) + ½ O2(g) → SO3(g)
ETAPA III: Reação do óxido ácido com a água;
SO3(g) +
H2O(g) →
H2SO4(aq)
Com base nas informações fornecidas, a alternativa que apresenta quantos Kg de ácido
serão gerados a partir da queima de 100 Kg de carvão que possua cerca de 3,2% de enxofre em
sua composição é:
Questão 22.
O metanol é combustível de queima limpa e fácil de manusear. Pode ser preparado pela
reação direta entre o CO e o H2 (que se obtém pela reação entre o vapor de água e o carvão, a
quente).
CO(g) + H2(g) → CH3OH(l)
Numa mistura de 12,0 g de hidrogênio e 74,5 g de CO, qual o reagente limitante? Que massa (em
gramas) do reagente em excesso resta depois da reação completar-se? Qual a produção teórica
do metanol?
Questão 23.
A aspirina (ácido acetilsalicílico) é preparada pelo aquecimento do ácido salicílico, C 7H6O3,
com o anidrido acético, C4H6O3. O outro produto da reação é o ácido acético.
C7H6O3 + C4H6O3 → C9H8O4 + C2H4O2
Qual a produção teórica (em gramas) da aspirina quando se aquecem 2,00 g de ácido
salicílico com 4,00 g de anidrido acético? Se a produção real da aspirina for 2,10 g, qual o
rendimento percentual?
Questão 24.
O enxofre está alguns porcento presente no petróleo cru, mas é reduzido para níveis de
apenas algumas centenas de ppm em produtos como a gasolina, por se tratar de um poderoso
agente poluidor quando na forma de óxidos, após a combustão desses derivados. Quantidades
importantes de sulfeto de hidrogênio (H2S) estão presentes como fonte de enxofre no petróleo e
no processo de remoção, denominado reação de Clauss, praticamente todo o sulfeto de
hidrogênio é convertido em enxofre elementar sólido, uma substância benigna do ponto de vista
ambiental, como indicado na reação:
2 H2S(g) + SO2(g) ↔ 3 S(s) + 2 H2O(g)
Quantos litros de sulfeto de hidrogênio, nas CNTP, aproximadamente, são retirados do
petróleo cru para cada kg de enxofre elementar sólido produzido?
Questão 25.
A tecnologia “flex” de alguns automóveis brasileiros permite o seu abastecimento tanto com
gasolina quanto com álcool em quaisquer proporções. A queima completa do etanol pode ser
representada pela seguinte equação:
C2H5OH(l)
+
3 O2(g) →
2 CO2(g)
+
3 H2O(g)
Enquanto a queima da gasolina, que na verdade é uma mistura de hidrocarbonetos, pode
ser representada simplificadamente pela seguinte equação:
C8H18(l )
+
12,5 O2(g)
→ 8 CO2(g)
+
9 H2O(g)
Considere que um veículo seja capaz de fazer 12 Km/L abastecido apenas com gasolina e
8 Km/L abastecido apenas com álcool e que as densidades da gasolina e do álcool sejam 0,75
g/mL e 0,8 g/mL respectivamente. Calcule qual a emissão de CO 2(g) produzida por cada
combustível, em Kg desse poluente, para cada 100 Km percorridos com o automóvel.
Questão 26.
Uma cúpula fechada, com capacidade para 1000L de ar possui um recipiente contendo 230
gramas de etanol. Desprezando o volume que o etanol ocupa, considerando que o ar contenha
21% de gás oxigênio (O2) e que a combustão do etanol é completa, responda:
a) Qual a quantidade, em mols de oxigênio, está presente na cúpula, nas CNTP?
b) O álcool (C2H6O) pode ser completamente queimado levando em conta a quantidade de
oxigênio presente na cúpula? Justifique seus cálculos indicando qual a quantidade de qual
reagente está em excesso.
Questão 27.
Um estudante misturou 3,32 g de iodeto de potássio, KI (s), e quantidades estequiométricas
de solução de ácido sulfúrico, H2SO4 (aq), de concentração 0,1 mol / L, e de dióxido de
manganês, MnO2 (s), no balão A. Sob aquecimento, a mistura reagiu e produziu iodo molecular,
I2. O iodo produzido sublimou e foi condensado, no balão B, por resfriamento.
a) Escreva os coeficientes estequiométricos da reação de formação do I 2.
__ KI(s) + ___ H2SO4(aq) + ___MnO2(s)
___ I2(s) + ___ MnSO4(aq) + ___ K2SO4(aq) + ___H2O(l)
b) Calcule a quantidade máxima, em mols, de I2 que pode ser obtida nas condições descritas
acima:
Questão 28.
Compostos de sal e água combinados em proporções definidas são chamados hidratos e a
água a eles associada é água de hidratação. 2,7 g do hidrato FeCl3 . XH2O fornecem, por
aquecimento, 1,62 g de FeCl3 anidro. Qual é o número de águas de hidratação do hidrato?
Questão 29.
Existem muitos processos para a obtenção de amônia; mas, o principal método é o
processo de Harber, que obtém a amônia fazendo reagir diretamente seus elementos (nitrogênio e
hidrogênio). Quando se faz 30 litros de nitrogênio e 30 litros de hidrogênio, medidos à mesma
temperatura e à mesma pressão, qual é o volume máximo que pode ser obtido de amônia, medido
também, nas mesmas condições de temperatura e pressão?
Dados:
N2 (g) +
H2 (g)
NH3 (g)
Questão 30.
Na produção de vinho, o dióxido de enxofre, SO2 (g), é usado como conservante, a fim de,
reagindo com o oxigênio do ar, impedir que este oxide o vinho, transformando-o em vinagre. A
equação química da reação do SO2 (g) com o oxigênio do ar é:
SO2(g) + O2(g) → SO3(g)
CALCULE a massa do produto formado na oxidação completa de 192 mg de SO 2(g) .(Deixe seus
cálculos registrados, explicitando, assim, seu raciocínio.)
Questão 31.
O gráfico descreve a variação de massa observada quando 84 mg de bicarbonato de sódio,
NaHCO3(s), são submetidos a aquecimento. A diminuição de massa deve-se à perda dos produtos
gasosos.
OBS : NO GRÁFICO massa superior = 84g; massa inferior = 53 g
Considerando o gráfico, assinale a alternativa que apresenta uma reação compatível com a variação
de massa observada.
A) NaHCO3 (s) 1/2 Na2CO3 (s) + 1/2 CO2 (g) + 1/2 H2O (g)
B) NaHCO3 (s) NaH (s) + CO2 (g) + 1/2 O2 (g)
C) NaHCO3 (s) NaOH (s) + CO2 (g)
D) NaHCO3 (s) 1/2 Na2O (s) + 1/2 H2O (g) + CO2 (g)












