Metabolismo
Carlos de Matos
2006/2007
Considerações iniciais
Programa
1ª Parte – Introdução ao Metabolismo
- Fluxo de energia no mundo biológico
- Ciclo da matéria
2ª Parte – Estudo das principais vias metabólicas, quer catabólicas que
anabólicas
- Metabolismo dos hidratos de carbono; glicólise, ciclo de Krebs,
fosforilação oxidativa;
- Metabolismo das gorduras: degradação e síntese de ácidos
gordos
- Metabolismo dos aminoácidos: ciclo da ureia e ciclo da
glutamina
- Metabolismo das proteínas: proteólise intracelular
extralisossómica
3ª Parte – Integração metabólica e unidireccionalidade das vias metabólicas
- Padrões do metabolismo energético nos tecidos animais
Quanto ao metabolismo dos hidratos te carbono, vão estudar-se vias anabólicas e
catabólicas. O metabolismo dos hidratos de carbono inclui muita coisa.
Relativamente aos aminoácidos e às proteínas, vai estudar-se mais o
catabolismo. O anabolismo de proteínas é estudado na Biologia Molecular. A
degradação de muitos compostos, incluindo proteínas, dá-se nos lisossomas, mas uma
outra via de catabolismo das proteínas é extralisossómica e dá-se com intermédio da
ubiquitina.
O metabolismo é constituído por muitas reacções, anabólicas e catabólicas,
relacionadas. O que interessa no metabolismo é estudá-lo em termos bioenergéticos e
conhecer as vias metabólicas centrais. As vias centrais são a glicólise e o ciclo de Krebs.
Tem de se conhecer as vias e outro aspecto importante é a regulação. Tudo tem
de ser regulado, tudo tem de estar em equilíbrio dinâmico, em homeostase ou
homeostasia. É importante estudar também a compartimentação celular.
Princípios básicos da disciplina
- Composição química e estrutura das principais moléculas bioquímicas
(hidratos de carbono, lípidos, proteínas e ácidos nucleicos)
- Cinética enzimática (todas as reacções são catalizadas por enzimas)
- Termodinâmica
- Potenciais electroquímicos
- Potenciais redox
2
Objectivo da disciplina
Evidenciar as vias metabólicas centrais no que respeita a:
1. Transformações que nelas ocorrem
2. Sua interrelação
3. Rendimento energético
4. Regulação
5. Compartimentação celular
Procura-se ter uma visão global.
3
Introdução ao Metabolismo
Metabolismo
Metabolismo, anabolismo e catabolismo
Metabolismo é a ciência que estuda os processos de síntese e degradação de
biomoléculas. Os primeiros constituem o anabolismo, e os segundos o catabolismo,
sendo a primeira a via biossintética e a segunda a degradativa.
O Metabolismo é constituído por reacções: o metabolismo biossintético tem
reacções anabólicas e o metabolismo degratativo tem reacções catabólicas. As
primeiras requerem energia e as outras libertam energia, de que as outras precisam. No
metabolismo há uma transdução de energia, estando em jogo energia química.
Relação entre metabolismo e anabolismo
O anabolismo e o catabolismo são processos opostos que ocorrem nas células
dos seres vivos e, embora divergentes, estão interrelacionados. Estes processos, apesar
de serem opostos, não são independentes. As coisas estão interrelacionadas, podendo os
produtos do catabolismo constituir substratos da outra forma.
O anabolismo e o catabolismo são processos opostos e isto parece um conflito
que não ocorreria em simultâneo nas células mas, na verdade, ocorre. As vias
metabólicas, quer catabólicas que anabólicas, têm regulação independente e, muitas
vezes, as vias de regulação estão em compartimentos celulares diferentes. O local onde
ocorre cada uma das vias é, de um modo geral, diferente.
Transdução de energia no metabolismo
As proteínas, hidratos de carbono e outros compostos são degradados no
catabolismo, dando produtos pobres em energia, como água, Co2 e amónia. Estas
reacções degradativas libertam energia que é armazenada em energia química, numa
molécula, o ATP. Há transdução de energia, na medida em que ela passa de uma forma
para outra. O NADH e o NADPH são moléculas importantes, formadas também no
catabolismo. O anabolismo, o processo biossintético que requer energia, forma
proteínas e hidratos de carbono, entre outros compostos, e a energia que estas reacções
requerem é fornecida pelo ATP formado no catabolismo.
O anabolismo e o catabolismo não são processos independentes, relacionandose.
4
- Parte I Introdução ao Metabolismo
5
Fluxo de energia e matéria no mundo biológico
1. Rede alimentar
Quando se examina um habitat natural, depara-se com as relações entre os
organismos desse habitat. Há cadeias alimentares, que formam uma rede, isto é, a rede
alimentar é formada por várias cadeias, e isto mostra como os organismos estão
relacionados.
A base das cadeias são os organismos produtores, que sintetizam matéria
orgânica a partir de matéria inorgânica. Estes organismos são os fotossintéticos, que
usam a energia luminosa. Alguns organismos, os consumidores, não produzem
substâncias orgânicas a partir de substâncias minerais (inorgânicas) e, por isso,
consomem os produtores. Exemplos de consumidores são larvas de insectos que são
consumidas por aves. Acima destas há outros consumidores, os predadores. Há ainda
decompositores, que decompõem a matéria orgânica formando moléculas simples que
podem ser usadas pelos produtores.
2. Fluxo de energia no mundo biológico
O Metabolismo é o estudo do fluxo de energia.
Os consumidores são heterotróficos e os produtores autotróficos. Estabelece-se
um fluxo de energia na Biosfera e não só num organismo, um fluxo entre os
organismos e o ambiente.
Os organismos fotossintéticos, com clorofila, usam energia luminosa e
transformam-na em energia química. Há, aqui, uma transdução de energia, passando
esta de luminosa a química. Os hidratos de carbono resultam da fotossíntese. Nas
moléculas orgânicas está contida energia química. Os organismos heterotróficos usam
estas moléculas, vão degradá-las, e a energia química é libertada. Essa energia vai ser
utilizada na produção de trabalho, havendo, assim, uma segunda fase do fluxo. Nem
toda a energia, no entanto, é utilizada para produzir trabalho; parte é dissipada,
contribuindo para o aumento da entropia. Nem toda a energia é aproveitada, não
havendo reversão da energia: parte é perdida e dissipada. O fluxo é unidireccinal.
A fotossíntese é o primeiro processo, cuja equação geral vem:
6 CO2 + 6 H2O
C6H12O6 + 6 O2
glucose
ΔG0 = + 686 Kcal
A fotossíntese é um processo anaeróbio que requer energia, que provém da luz.
A segunda etapa do fluxo de energia biológica é a fermentação e a respiração.
Esta última ocorre se houver oxigénio e os seres que a praticam são aeróbios e
heterotróficos. Eles vão utilizar as moléculas orgânicas e degradá-las, por oxidação,
resultando, desse processo, CO2 e água, e havendo, também, libertação de energia. A
equação vem:
C6H12O6 + 6 O2
6 CO2 + 6 H2O
ΔG0 = – 686 Kcal
6
Os seres anaeróbios (ou anaeróbicos) não requerem oxigénio e, na sua
ausência, fazem fermentação, em que a glucose é convertida em ácido lácteo.
Os vários tipos de trabalho biológico consomem a energia produzida, isto é, os
vários tipos de trabalho requerem a energia libertada na respiração e na fermentação. O
trabalho químico é anabólico (catabólico), correspondendo à biossíntese
(Relativamente ao trabalho químico, ele corresponde à biossíntese). Os organismos
elaboram moléculas complexas, macromoléculas, a partir de moléculas precursoras. As
proteínas são macromoléculas formadas por aminoácidos ligados por ligações
peptídicas. Outras moléculas são os ácidos nucléicos, formados por nucleótidos, e os
polissacarídeos, formados por açúcares simples. O trabalho osmótico é relativo ao
transporte activo; as ATPases, por exemplo, obtêm energia por degradação de ATP. O
trabalho mecânico corresponde à contractibilidade e à motilidade e requer energia. O
trabalho mecânico requer energia; o músculo, para contrair, requer energia.
O anabolismo e o catabolismo, a biossíntese e a degradação, coocorrem na
célula, num steady state, um equilíbrio. Os processos têm de ser regulados, para que
haja homeostase. A regulação é muito importante, para não haver desperdícios.
Como foi referido, o fluxo de energia no mundo biológico não tem retoma, é
unidireccional; parte da energia perde-se, havendo perdas em cada nível. A energia
luminosa, a fonte primária básica, tem um alto nível de energia mas, sucessivamente,
nesse fluxo, a energia vai-se perdendo. A energia luminosa é convertida em energia
química e esta é utilizada para produzir trabalho, mas nem toda a energia química sofre
essa transformação, havendo sempre uma dissipação e sendo, o fluxo, unidireccional.
Parte da energia contribui para o aumento da entropia.
3. Ciclos da matéria no mundo biológico
Há também um fluxo de matéria, mas este é cíclico, havendo ciclos de
matéria.
3.1. Ciclos do carbono e oxigénio
Os ciclos mais característicos são os do carbono e do oxigénio, os elementos
mais básicos que os produtores utilizam.
Os produtores (fotossintéticos) sintetizam hidratos de carbono e libertam
oxigénio, que são usados pelos organismos heterotróficos na degradação dos (para
degradar os) hidratos de carbono por oxidação, através do processo de respiração
catabólica. Do mecanismo de respiração, o processo elaborado pelos organismos
heterotróficos, resulta dióxido de carbono e água. O carbono e a água vão ser de novo
usados pelos produtores. Os fotossintéticos vão fixar o CO2, utilizando também água, na
fotossíntese.
O carbono e o oxigénio constituem matéria que estabelece ciclos (um ciclo), que
estão relacionados com o fluxo de energia, estão acoplados ao fluxo de energia, pois os
processos dependem dela. Os ciclos da matéria estão acoplados aos ciclos de energia.
Os fotossintéticos fixam CO2 e utilizam água, mas requerem energia; no processo
respiratório, forma-se CO2 e H2O e liberta-se energia. Nos produtores há captação de
energia e nos consumidores há libertação de energia.
7
3.2. Ciclo do nitrogénio
Há também um ciclo de nitrogénio.
Como há plantas que fixam CO2, há organismos, bactérias, que fixam
nitrogénio e, no processo, o N2 é reduzido a amónia (NH3). Os organismos que fazem
assimilação do nitrato também _______________. Ocorre em bactérias, por exemplo,
e, neste processo, NO3- é reduzido para formar NH4+. Há, assim, duas formas de a
formar. A NH4+ pode ser usada no consumo por animais, para se produzir aminoácidos,
e isto é reversível, originando os aminoácidos, NH4+. As bactérias nitrificantes
formam nitratos a partir da NH4+, oxidando-a. As bactérias desnitrificantes
convertem NO3- em N2, e essa parte do ciclo chama-se desnitrificação. Isto ocorre em
anaerobiose e as bactérias usam os óxidos de nitrogénio, em vez de oxigénio, como
aceitadores de electrões.
Este ciclo é mais complexo.
3.3. Ciclo do ATP
No processo de respiração, a energia é libertada com a oxidação das moléculas
orgânicas, que são consumidas no processo respiratório. A energia libertada é utilizada
em trabalho biológico, mas não directamente. A energia libertada na degradação das
moléculas orgânicas vai ser usada, aproveitada, consumida na forma de ATP. A energia
utilizada no trabalho biológico, a última etapa, vem do ATP. Esta é a “moeda
energética” do Metabolismo.
O ATP tem de ser hidrolisado para que se liberte a energia. As ATPases são as
enzimas que hidrolisam o ATP, e os resultados da hidrólise são o ADP e o fosfato. A
energia libertada na respiração vai ser utilizada na síntese ATP, que parte de ADP e
fosfato.
O sistema ATP-ADP também constitui um ciclo, englobado na fotossíntese e no
catabolismo. Os organismos fotossintéticos, no processo de fotossíntese, formam ATP,
partindo de ADP e fosfato. O processo fotossintético também está, por isso, relacionado
com o ciclo de ATP. Os organismos heterotróficos, na respiração, produzem energia
conservada no ATP. Tanto os organismos fotossintéticos, no anabolismo, como os
heterotróficos, no catabolismo, produzem ATP. O ATP é, depois, usado no trabalho
biológico. Tudo isto, pode ver-se, está relacionado.
8
Classificação dos organismos em termos metabólicos
1. Classificação dos organismos de acordo com os seus requisitos
de carbono e energia
Em termos metabólicos, os organismos podem ser classificados de acordo com
os seus requisitos de carbono e energia.
Os organismos fotoautotróficos, conhecidos ____, usam como fonte de carbono
o CO2 e como fonte de energia a luz. As plantas verdes, as algas, certas cianobactérias
e algumas bactérias fotossintéticas realizam este processo.
Os heterotróficos, ou chemoheterotróficos ou quimioheterotróficos usam
como fonte de carbono as moléculas orgânicas e como fonte de energia reacções de
oxidação-redução. Geralmente a fonte de electrões é a glucose. Os animais e a maioria
dos microrganismos são organismos deste tipo.
Os organismos fotoheterotróficos usam, também, compostos orgânicos como
fonte de carbono, mas usam a luz como fonte de energia. Os organismos que fazem isto
são mais restritos – algumas bactérias não sulfurosas.
Os organismos quimioautotróficos usam como fonte de carbono o CO2, mas a
energia provém de reacções de oxidação-redução.
Estes dois últimos serão conceitos intermediários dos outros.
Esta é a classificação dos organismos de acordo com os requisitos de carbono e
energia.
2. Classificação dos organismos de acordo com o aceitador de
electrões
Pode também haver uma classificação dos organismos de acordo com o
aceitador de electrões, em reacções de oxidação-redução. Os aceitadores não são todos
os mesmos, o que permite a classificação.
Os organismos aeróbios têm como aceitador de electrões o oxigénio. Há
organismos, os organismos aeróbios obrigatórios, que só o usam a ele. São organismos
que usam oxigénio como aceitador de electrões e só degradam a glucose na sua
presença.
Os organismos anaeróbios não requerem oxigénio.
Os organismos aeróbios ou anaeróbios facultativos pode usar o oxigénio como
aceitador de electrões, ou não.
9
Características das vias metabólicas
1. Universalidade
Verificou-se que as principais vias metabólicas existem em todas as células e
em todos os seres vivos, em organismos procariotas (primitivos) e eucariótas. Se as
principais vias metabólicas são comuns a todos os organismos, todos eles descendem do
mesmo ancestral, e o ancestral comum de que todos descendem existiu há 2 biliões de
anos. As vias metabólicas centrais existem desde o início da vida.
A glicolise é a mais antiga via metabólica, e passa-se sem oxigénio. Ela existia
na Terra antes daquele gás, que existe há menos de 2 biliões de anos (há menos de 1
bilião 2 biliões de anos).
A universalidade das vias mostra que descendemos de um ancestral comum e
que as vias metabólicas são muito antigas.
2. Diversidade
As vias metabólicas apresentam também uma grande diversidade. Os
organismos, para além das vias metabólicas centrais, apresentam também uma certa
diversidade das vias, pois podem ter adquirido vias metabólicas alternativas, para além
daquelas outras.
Os organismos apresentam, portanto, uma diversidade metabólica.
3. Catálise enzimática
As vias metabólicas são constituídas por sequências de reacções, todas elas
catalisadas por enzimas, que podem estar de várias maneiras. Pode haver enzimas
solúveis no citoplasma e, se estão solúveis, os substratos ligam-se a elas e os produtos
(intermediários) podem difundir-se. As reacções vão-se passando nesse meio solúvel.
Algumas enzimas encontram-se em complexos, pelo que os intermediários vão
passando de uma enzima para outra, sem se difundirem. Noutros casos, os complexos
multienzimáticos encontram-se ligados à membrana e as reacções vão-se passando ao
nível desta estrutura. As membranas são uma bicamada de lípidos, pelo que pode haver
difusão, mas apenas ao nível desta estrutura.
4. Complexidade
As vias metabólicas são uma sequência longa de reacções, pelo que há uma
grande complexidade nessas vias. A complexidade tem vantagens:
- A multiplicidade de reacções dá uma grande flexibilidade ao metabolismo;
- Há um aproveitamento energético enorme. No metabolismo interessa extrair
energia dos nutrientes. A energia libertada de nutrientes, incluindo a glicose, é
utilizada para formar ATP, e a formação desta molécula requer _______. Na
10
glicólise há muita energia libertada. Se a degradação da glicose se desse numa só
reacção, apenas se produziria uma molécula de ATP. A existência de várias
etapas em que a energia é conservada permite a formação de muitas moléculas
de ATP e, assim, um maior rendimento;
- A necessidade da regulação metabólica, que é muito útil. O metabolismo,
como foi já referido, divide-se em anabolismo e catabolismo, mas um só
funciona quando o outro está inibido, não se podendo degradar e sintetizar ao
mesmo tempo. A necessidade de regulação torna-se mais fácil devido à
complexidade;
- Podem ocorrer reacções termodinamicamente desfavoráveis, desde que
estejam acopladas a reacções termodinamicamente favoráveis. A
complexidade permite o acoplamento de reacções termodinamicamente
favoráveis que permitem reacções termodinamicamente desfavoráveis.
A+B
C+D
[C][D]
ΔG = ΔG0 + RT log
[A][B]
Se ΔG<0, a reacção é espontânea. Uma reacção com variação de energia livre
(ΔG) + 5 Kcal/mol é desfavorável, enquanto uma reacção com ΔG – 8 Kcal/mol
é favorável. Se as duas reacções estiverem acopladas, ΔG pode ser – 3 Kcal/mol,
pelo que é favorável.
5. Convergência das vias catabólicas
Uma (outra) característica das vias catabólicas é a sua convergência. As
proteínas originam aminoácidos, os lípidos formam ácidos gordos e glicerol,
enquanto os polissacarídeos dão monossacarídeos. Este é o estado I do metabolismo,
em que se quebram as ligações entre as unidades formadoras das macromoléculas.
Depois desta fase, o metabolismo dos monosscarídeos (glucose, por exemplo) origina
piruvato, que origina acetil-Coenzima A. O metabolismo dos aminoácidos e dos
ácidos gordos dá origem a acetil-Coenzima A. Todos estes processos dão origem a
intermediários comuns, pelo que as vias são convergentes. A degradação das moléculas
por vias metabólicas distintas origina um número reduzido de moléculas diferentes. São
produtos de convergência a água, o CO2 e a amónia.
6. Divergência das vias anabólicas
Nas vias anabólicas verifica-se o contrário, havendo uma divergência dessas
vias. Há intermediários metabólicos que podem ser precursores para formar unidades
moleculares simples, que podem contribuir para a síntese de grandes moléculas. O
anabolismo é divergente pois há um pequeno número de precursores, que dão origem a
todas as grandes moléculas. Um pequeno número de moléculas precursoras pode ser
11
suficiente para a formação de vários constituintes, isto é, todas as grandes moléculas
podem ser sintetizadas a partir de um pequeno número de moléculas precursoras.
7. Vias anfibólicas
Algumas vias metabólicas são anfibólicas, podendo servir para o catabolismo ou
o anabolismo. As vias que podem servir para o catabolismo e o anabolismo têm carácter
anfibólico. O ciclo de Krebs é um exemplo de uma via anfibólica. Os intermediários
deste ciclo também podem ser precursores do catabolismo.
8. Diferenciação
Outra característica das vias metabólicas é a sua diferenciação. Há alguma
diferenciação nas vias anabólicas e catabólicas. Há sequências nessas vias. Se as vias
catabólicas e anabólicas fossem totalmente as mesmas, as reacções seriam reversíveis e
não se poderia formar ou degradar.
Essas vias podem ser independentes em termos de espaço e, sendo
independentes, podem funcionar de maneira distinta.
Um regulador, ao estimular uma via, vai inibir a outra via, e isso pode acontecer
porque elas são distintas. Há casos em que há reacções reversíveis, mas não podem ser
todas. Ou todas as reacções são distintas ou pelo menos uma é, não podendo haver só
reacções reversíveis. Um regulador que estimule uma enzima vai regular a via. Pelo
menos uma das enzimas tem de ser irreversível. A regulação leva a que, enquanto uma
via está a ser inibida, outra está a ser estimulada.
9. Economia de energia e ajuste rápido
As vias metabólicas são feitas de forma a que haja economia de energia. O
organismo só vai degradar glicose se precisar; se o organismo estiver a correr, por
exemplo, há degradação da glicose. Essa degradação só ocorre se for necessário, isto é,
o catabolismo (anabolismo) só ocorre quando é necessário. A regulação leva a que as
coisas só ocorram quando é preciso.
Há também um ajuste rápido do ganho às necessidades. Os atletas que correm
os 100 metros têm de correr muito rapidamente e, por isso, tem de haver um ajuste
rápido.
Isto é possível porque o Metabolismo é altamente regulado e integrado. É por
isso que há economia de energia e rápido ajuste do organismo.
12
- Parte II Estudo das principais vias
metabólicas
Vai iniciar-se o estudo das vias metabólicas. Analisar-se-á o metabolismo dos
açúcares, das gorduras, dos aminoácidos e das proteínas.
Vai efectuar-se a visão global do processo, depois vão analisar-se as fases do
processo e, por fim, fazer-se-á uma análise pormenorizada. Isto será feito para as várias
vias.
13
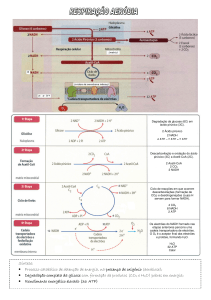
Capítulo 1: Catabolismo da glicose
O metabolismo da glicose pode ocorrer na presença ou na ausência de oxigénio e
o seu catabolismo envolve duas fases: a fermentação (e a degradação pode ficar por
aqui) e a respiração, eventualmente.
A glicólise origina um produto intermediário comum, o piruvato, e é importante
para se produzir energia na ausência de oxigénio.
A fermentação ocorre na ausência de oxigénio. O catabolismo pode ser feito na
ausência daquele composto e, neste caso, o produto da glicólise, o piruvato, pode dar
origem a lactato, havendo uma enzima, a desidrogenase, que participa. A isto chamase fermentação láctea. À glicólise chama-se fermentação láctea, quando aquela
molécula é convertida em ácido lácteo. Certos organismos realizam a fermentação
alcoólica, na qual o piruvato origina etanol. Na ausência de oxigénio, esses organismos
formam etanol e CO2 a partir de piruvato. No primeiro tipo de fermentação, há
formação de duas moléculas com 3 carbonos, tendo a molécula inicial 6. No segundo
tipo, duas moléculas de 3 carbonos cada uma (piruvato) originam etanol e CO2
______________________. Na fermentação alcoólica, em vez de se originarem duas
moléculas de lactato, com 3 carbonos, origina-se uma molécula de etanol com 3
carbonos e duas moléculas de dióxido de carbono.
Na respiração, o processo continua para outra fase. Se houver oxigénio, ocorre
respiração, originando o piruvato acetil-Coenzima A, que vai ser utilizada no ciclo de
Krebs. No caso do oxigénio ser limitante, a glicólise permite retirar energia da glicose,
mas o piruvato formado permite, na presença de oxigénio, o processo de respiração. A
glicólise oferece um precursor, o piruvato, para o ciclo de Krebs.
14
Glicólise
1. Processo global
Em termos do processo global, verifica-se que o processo de glicólise envolve
duas fases. A primeira inclui reacções que formam duas moléculas com 3 carbonos a
partir da glicose: a dihidroxiacetonafosfato e o gliceraldeído-3-fosfato. A segunda
integra reacções muito importantes, que transformam gliceraldeído-3-fosfato em
piruvato. O gliceraldeído entra na segunda fase mais o outro produto,
dihidroxiacetonafosfato, por isomerização, pode originar o gliceraldeído. Assim, a
segunda parte da glicólise pode ser representada uma ou duas vezes.
2. Análise das reacções
2.1. Primeira fase da glicólise
A primeira fase integra cinco reacções importantes. Inicia-se com a glucose, a
molécula que vai ser catabolizada, que é fosforilada numa reacção de fosforilação,
originando glucose-6-fosfato. Esta é isomerizada (isomerização), originando frutose6-fosfato. Depois desta isomerização origina-se frutose-1,6-fosfato por uma nova
fosforilação. Esta molécula ainda tem 6 carbonos, mas vai ser clivada na última
reacção, originando-se as duas moléculas com 3 carbonos referidas, a dihidroxiacetona
e o gliceraldeído. Assim, uma hexose, a glucose, origina duas trioses, as duas
moléculas referidas. O gliceraldeído segue para a segunda fase, e a dihidroxiacetona
também é convertida neste produto por isomerização, podendo também seguir na
segunda fase.
a) Fosforilação da glicose a glicose-6-fosfato
A primeira coisa que acontece, neste metabolismo, após a entrada da glucose nas
células, vinda da corrente sanguínea, é a sua fosforilação a glucose-6-fosfato. As
enzimas que catalizam este processo são cinases e neste caso participa a hexocinase,
uma cinase muito importante nas células. Aqui já há uma grande regulação, pois a
enzima é regulada halostericamente pelo produto, que a inibe quando está muito
concentrado.
Num tipo de células mais particular, as células do fígado, a fosforilação da
glucose é catalizada pela glucocinase, que ocorre apenas nas células daquele orgão.
Tem muita importância na catálise da fosforilação da glucose nessas células. A sua
afinidade por este açúcar é menor que a da outra enzima (o Km é maior), pelo que
requer mais glucose para ser sensível. Isto ocorre no fígado pois, se houver excesso de
açúcar, este órgão detecta-o e vai fosforilar a glicose (em condições de excesso deste
açúcar). É a glucocinase que fosforila a glucose em glucose-6-fosfato, que pode depois
ser usada na síntese de glicogénio e ser armazenada nessa forma.
Uma vantagem da fosforilação reside no facto de, assim que a glucose atravessa
a membrana e é fosforilada, deixa de ser capaz de atravessas aquela estrutura. Esta
reacção dá-se no citoplasma e, quando a glucose passa a glucose-6-fosfato, a
15
concentração de glucose diminui. Assim, pode permitir o transporte de glucose para o
interior da célula, facilitando este processo.
O grupo fosfato adicionado na fosforilação provém de ATP, pelo que esta
reacção implica consumo de ATP e, portanto, energia.
b) Isomerização da glucose-6-fosfato a frutose-6-fosfato
A segunda reacção converte glucose-6-fosfato em frutose-6-fosfato. A primeira
é uma aldose, mas, quando é isomerizada, passa de aldose a cetose, a frutose-6-fosfato.
Estes açúcares podem ser representados em forma linear ou em anel. A glucose-6fosfato pode formar um anel de piranose e a frutose-6-fosfato pode formar um anel de
furanose. Esta reacção de isomerização é catalizada por uma isomerase.
A vantagem desta isomerização é que facilita a reacção seguinte de fosforilação
e a clivagem (as duas reacções seguintes). Depois da isomerização, fica livre um grupo
hidroxilo, facilmente fosforilado. Além disso, na fase de clivagem da hexose em duas
trioses, a isomerização facilita o processo, pois o carbono C2 vai activar o carbono C3,
facilitando a clivagem. A isomerização facilita, assim, as reacções seguintes.
c) Fosforilação da frutose-6-fosfato a frutose-1,6-bifosfato
A frutose-6-fosfato vai ser fosforilada, formando frutose-1,6-bifosfato, com
mais um grupo fosfato, que foi adicionado ao grupo OH referido. Mais uma vez,
aquele grupo provém do ATP, pelo que há, mais uma vez, gasto de energia.
A reacção é catalizada pela fosfofrutocinase e é um importante ponto de
regulação, pois a enzima é regulado por várias substâncias. A enzima que cataliza a
reacção é inibida por ATP, ficando com afinidade baixa para o substrato; sem ATP, a
reacção apresenta uma velocidade maior, sendo a afinidade para o substrato maior. O
ATP, ao ligar-se à enzima, como agente de regulação halostérica, vai diminuir a
afinidade da enzima pelo substrato. O ATP é um regulado halostérico negativo. O
efeito inibitório do ATP é contrabalançado pelo AMP. O ATP, o ADP e o AMP estão
sempre em equilíbrio na célula, pois há enzimas que os interconvertem. Se houver
muito ATP, ele é convertido em ADP e AMP; se o ATP for menos concentrado, formase com gasto daquelas substâncias. Sendo a enzima dependente das concentraçãos de
ATP e AMP, ela é sensível à carga energética. A enzima é ainda regulada por uma
substância semelhante ao produto, a frutose-2,6-bifosfato, que é um regulador
halostérico positivo da enzima. Na ausência desta substância, a afinidade da enzima é
baixa, e é alta na sua presença. A substância estimula a reacção, pois aumenta a
afinidade. Se houvesse simultaneamente os dois reguladores, o halostérico positivo
(frutose-2,6-bifosfato), e o halostérico negativo (ATP), os efeitos anulam-se. Estas
substâncias têm uma acção que se neutraliza, de certo modo. Na interacção entre o ATP
e a frutose-2,6-fosfato, há uma menor ou maior inibição ao estímulo, de acordo com os
níveis. O efeito inibitório do ATP é menor. A enzima em causa é muito importante,
sendo regulada halostericamente por duas substâncias e constituindo, portanto, o
segundo ponto de regulação. Há ainda um terceiro.
É a frutose-2,6-bifosfato que vai, então, estimular a glicólise. Este composto
também é originado pela frutose-6-fosfato, mas ocorrendo antes a fosforilação na
posição 2. A enzima que promove a fosforilação tem dupla função: tem função de
cinase, provocando a fosforilação, e, função de fosfatase, removendo o grupo fosfato.
Quando há muita frutose-6-fosfato, deve ocorrer glicólise rapidamente. Se houver
muita, há estimulação da formação de frutose-2,6-fosfato, que estimula a glicólise. A
16
parte bifuncional, de fosfatase, inibe a glicólise. Para além da regulação por
halosterismo, a enzima que cataliza a formação de frutose-2,6-bifosfato é regulada por
ligação covalente (são estes os dois tipos de regulação): no estado fosforilado, a
enzima funciona como fosfatase, enquanto no estado desfosforilado funciona como
cinase. Uma enzima, uma proteína, quando fosforilada, altera a sua forma, ficando
inibida, ou activada. A enzima em causa funciona como fosfatase quando está
fosforilada, ou como cinase, quanto está defosforilada. Estando desfosforilada,
aumenta-se a velocidade da reacção. A regulação por ligação covalente depende
também da glucose: se a quantidade de glucose é baixa, a enzima está no estado
fosforilado, pois deixa de haver frutose-2,6-bifosfato. O estado fosforilado depende da
glucose; quando há pouca glicose no sangue, fica fosforilada, ficando a actuar como
fosfatase, levando ao desaparecimento da frutose-2,6-bifosfatase, que estimula a
glicólise.
d) Clivagem da frutose-1,6-bifosfato em dihidroxiacetona e gliceraldeído-3fosfato
A reacção seguinte da glicólise é a clivagem da frutose-1,6-bifosfato.
Continuando o processo glicolítico, há a clivagem desta molécula, uma hexose, nas
duas trioses referidas: a dihidrociaxetona-fosfato, uma cetona, e o gliceraldeído-3fosfato, uma aldose. A enzima que cataliza esta reacção é uma aldolase. A reacção, a
clivagem, é o inverso da condensação alcoólica, a condensação entre uma cetona e um
aldol.
O gliceraldeído-fosfato que se forma entra directamente na segunda faz, mas a
dihidroxiacetona não é perdida. Há uma isomerização, em que a __________, converte
a dihidroxiacetona em gliceraldeído-3-fosfato.
2.2. Segunda fase da glicólise
Em termos gerais, a segunda fase da glicólise tem cinco reacções importantes.
Inicialmente há oxidação e fosforilação: o gliceraldeído-3-fosfato é oxidado e forma
ácido-1,3-bifosfoglicérido. Depois há transferência de um fosfato para ADP, para
formar ATP, e de seguida há um deslocamento do grupo fosfato, e o ácido-3fosfoglicérido passa para ácido-2-fosfoglicérido. Há depois uma desidratação que
forma um enol e, depois da transferência do grupo fosfato, forma-se piruvato.
Esta segunda fase da glicose inicia-se no gliceraldeído-3-fosfato, mas a
dihidroxiacetona também pode ser convertida naquela molécula, pelo que cada
molécula de glicose forma 2 moles de piruvato.
Energeticamente, a segunda fase da glicose é muito importante, pois é nesta fase
que se forma ATP (conservação de energia). Há também formação de equivalentes de
redução, NADH, por oxidação do gliceraldeído. Este composto perde electrões que têm
de ser captados e, desta feita, o são para o NAD+, que é reduzido a NADH. O
gliceraldeído é oxidado, os electrões são ____ para NAD+, que é reduzido, formando
NADH. Os electrões vêm sobre a forma de iões hidreto, são captados nessa forma. A
formação destes NADH é muito importante.
Os lípidos têm um estado de redução superior ao dos hidratos de carbono,
estes maior que o carbonil, estes maior que o carboxilo e estes maior do que o CO2.
Quanto maior o potencial de redução, mais são os electrões que se podem fornecer,
podendo formar mais energia. Tendo os lípidos um estado de redução maior (muito
17
grande), maior a capacidade de fornecer energia. Os lípidos, quando metabolizados,
podem fornecer mais energia do que até os hidratos de carbono.
e) Oxidação e fosforilação do gliceraldeído-3-fosfato a 1,3-bifosfoglicerato
O NAD+ é a nicotinamida ____ e o NADP+, muito importante, nomeadamente
em vias anabólicas (catabólicas), tem mais um grupo fosfato. Os dois electrões são
captados em H+, formando-se um ião H-, hidreto. No anabolismo participa ____ o
NAPH, enquanto o NAD+ participa mais no catabolismo. No catabolismo há recepção
de iões por NADP+ que passa para NADPH; no anabolismo, o NADPH é oxidado a
NADP+. Logo na glicolise, o NAD+ é importante.
A reacção em que se forma NADH é duplamente importante, pois, para além
disso, há uma fosforilação, que implica uma grande conservação de energia. O
gliceraldeído-3-fosfato (G3P) é oxidado, mas também é fosforilado, formando-se um
acilfosfato, o 1,3-bifosfoglicerato.
A enzima que cataliza esta reacção é muito importante, pois provoca uma
oxidação e uma fosforilação simultâneas, formando-se o acetilfosfato, onde se conserva
a energia. A enzima é uma proteína e tem um grupo SH, muito importante. O
gliceraldeído-3-fosfato é um aldeído e há também NAD+. O gliceraldeído vai ser
oxidado, e, para haver catálise, vai-se ligar à enzima, ao grupo SH, o grupo reactivo. A
ligação forma um tioéster, e estas ligações conseguem preservar muita energia. O
NAD+ passa a NADH. Nesta primeira fase, a desidrogenase é muito importante. Na
segunda fase entra o fosfato. A energia conservada na ligação tioéster provém da
oxidação. A fosforilação forma o acilfosfato, com um alto potencial energético, onde a
energia fica conservada.
f) Formação do 3-fosfoglicerato a partir do 1,3-bifosfoglicerato e síntese de
ATP
Na segunda fase, o ácido-1,3-bifosfoglicérido, vai permitir sintetizar ATP a
partir de ADP. Este composto vai passar a ATP e o ácido forma ácido-3-fosfoglicérido
(3PG). Há uma conservação de energia, feita por um modo designado de fosforilação
ao nível do substrato. Este fenómeno corresponde à fosforilação de gliceraldeído-3fosfato a ácido-3-fosfoglicérido, sendo NAD+ reduzido a NADH e ATP formado a
partir de ADP e Pi.
Pode haver um desacoplamento. O arsénio é um veneno e o arsenato é um
desacoplador da glicólise. Pode formar-se 1-arsénio-3-fosfoglicerato, em vez de ácido1,3-fosfoglicérido, isto é, em vez de fosfato fica lá o grupo arsénio. O primeiro
composto é semelhante ao segundo, mas é um acilarcenato, instável, pelo que a sua
energia perde-se logo e, por este motivo, o arseneto é um desacoplador da glicólise. Ele
permite a oxidação, mas impede a fosforilação e, portanto, mais tarde, a síntese de ATP.
A energia não é conservada, mas libertada. É um desacoplador, não havendo
conservação de energia.
g) Conversão de ácido-3-fosfoglicérido em ácido-2-fosfoglicérido
Depois, o 3-fosfoglicerato forma 2-fosfoglicerato (2GP). O grupo fosforil
passa de C3 para C2, e esta conversão é realizada pela mutase.
18
h) Desidratação do ácido-2-fosfoglicérido a fosfoenolpiruvato
De seguida, há uma desidratação que aumenta o potencial de transferência do
grupo fosforil. O 2-fosfoglicerato é um éster de fosfato e de um álcool, e isto não
facilitada o processo de síntese de ATP, havendo necessidade de o transformar numa
substância capaz de transferir o grupo. O 2-fosfoglicerato forma fosfoenolpiruvato, que
tem um alto potencial de transferência, por desidratação.
Esta reacção, de formação de enol, é catalizada pela enolase.
i) Transferência do grupo fosforil do fosfoenolpiruvato para ADP, com
síntese de ATP e piruvato
Por fim há transferência do grupo fosforil do fosfoenolpiruvato (PEP) para
ADP, formando-se ATP (com participação de Pi) e piruvato.
Nesta fase há o terceiro ponto de regulação da glicólise. A enzima que cataliza o
processo é a piruvato cinase, também regulada por dois mecanismos. Normalmente,
como foi referido, as enzimas são correguladas de dois modos: halosterismo o regulação
por ligação covalente, por ligação do grupo fosfato. A enzima em causa é regulada
halostericamente, no que respeita à regulação alostérica positiva, por AMP e frutose1,6-fosfato. A regulação halostérica negativa é feita por ATP e analina. O metabolismo
é um processo muito regulado e as coisas só ocorrem quando é necessário. Por isso há
uma grande economia, graças aos mecanismos reguladores. Não há ____ dispendiosos.
Quando não há glicose, a piruvato cinase não actua, pois não há frutose-1,6-bifosfato.
Quando a piruvato cinase esta fosforilada ela sofreu a acção de uma cinase; quando
está desfosforilada há acção de fosfatases. O estado fosforilado depende da quantidade
de glucose no sangue. Se houver baixa concentração de glucose no sangue, activa-se o
estado de cinase, para ela estar inactiva, pois ela fica menos activa no restado
fosforilado.
3. Balanço e rendimento energético
No fim desta sequência de reacções, a glicose, com 2 Pi, 2 ADP e 2 NAD+,
origina 2 moléculas de piruvato, 2 ATP, 2 NADH, 2 H+ e 2 H2O.
Em termos energéticos, os produtos da glicólise (aquilo que é importante em
termos da conservação de energia, em termos energéticos) são ATP, NADH e piruvato.
Os electrões do NADH, ao serem postos na corrente respiratória, vão permitir a
formação de energia por outro processo. O piruvato, se houver oxigénio, pode continuar
a poder contribuir para a formação de energia.
Relativamente ao rendimento energético, é de 2 ATP’s. Na passagem de
glucose a glucose-6-fosfato, perde-se 1 ATP, e na passagem de frutose-6-fosfato a
frutose-1,6-bifosfato perde-se outro. 2 1,3-fosfogliceratos formam 2 ATP’s ao passarem
a 3-fosfoglicerato, e formam-se mais 2 ATP’s na passagem de fosfoenolpiruvato a
piruvato. Tendo sido consumidas 2 moléculas de ATP e tendo-se formado 4, o
rendimento energético é 2 ATP’s. A energia não se fica na síntese de ATP, pois formouse também NADH.
19
Fermentações
O destino do piruvato, se não houver oxigénio, é a fermentação.
1. Fermentação láctea
O piruvato, produto final da glicólise, passa a lactato na fermentação láctea,
uma reacção muito importante, catalisada pela lactato desidrogenase. O piruvato é
reduzido a lactato, recebendo, portanto, electrões, vindos do NADH, que é oxidado,
ficando na forma NAD+.
Na passagem de gliceraldeído-3-fosfato para 1,3-bifosfoglicerato, o
gliceraldeído, sendo oxidado, forma NADH a partir de NAD+. Na formação de lactato,
regressa-se a NAD+. A passagem de piruvato a lactato é a única fonte de NAD+ na
ausência de oxigénio, é uma passagem muito importante, pois só assim se mantém a
glicólise. Para manter a glicólise é necessário regenerar NAD+.
2. Fermentação alcoólica
Na fermentação alcoólica, o piruvato é descarboxilado a acetaldeído e,
depois, uma desidrogenase converte-o em etanol. Esta reacção também regenera o
NAD+.
20
Ciclo de Krebs
Continuando o metabolismo, o catabolismo, da glucose, vai ver-se o destino do
piruvato. Vai analisar-se o ciclo de Krebs.
1. Processo global
Na presença de oxigénio, o piruvato resultante das duas fases da glicólise tem
outro destino. Ele passa para a mitocóndria e, na matriz, ocorre uma sequência de
reacções que continua o metabolismo: o ciclo de Krebs, ciclo dos ácidos triglicéridos
ou ciclo do ácido cítrico. Isto passa-se na matriz da mitocôndria; é lá que ocorre a
sequência de reacções que constitui o ciclo de Krebs.
Neste ciclo forma-se NADH e GTP. O NADH formado no ciclo e nas fases da
glicólise está reduzido e leva electrões. Estes vão ser fornecidos à membrana interna
da mitocôndria, onde há transporte destas partículas, que vão levar à síntese de ATP e,
portanto, à conservação de energia.
A formação de acetil-Coenzima A a partir de piruvato é o elo de ligação entre a
glicólise e o ciclo de Krebs. A acetil-Coenzima A condensa-se com o produto final do
ciclo, oxaloacetato, formando citrato, que é convertido por enzimas em isocitrato.
Depois há uma descarboxilação (libertação de CO2) e oxidação do isocitrato,
formando-se NADH. É uma descarboxilação oxidativa. O α-cetoglutarato formado
também sofre o mesmo processo, convertendo-se (neste processo) em succinilCoenzima A, e formando-se NADH. A succinil-Coenzima A permite a conservação da
energia formada na oxidação. Na reacção seguinte, há formação de GTP, que pode ser
convertido em ATP. No processo de conservação de energia há um mecanismo de
conservação de energia na forma de ATP, pelo que o próprio ciclo de Krebs implica a
síntese de ATP e a fosforilação oxidativa a nível do substrato. Forma-s succinato, que é
oxidado a fumarato, indo os electrões para o FAD+, formando-se FADH2. O fumarato
é convertido em ____ e este é descarboxilado e oxidado a ____, formando-se ____ e
sendo o receptor de electrões ____. Formam-se, assim, vários equivalentes de refução.
2. Análise das reacções
a) Descarboxilação oxidativa do piruvato a acetil-conzima A
A Coenzima A tem várias partes. Existe um grupo SH, sulfidrilo, muito
reactivo, e é através dele que a Coenzima A pode formar a ligação tioéster. Grupos
acil formam acil-Coenzima A; se o grupo acil for CH3, tem-se acetil-Coenzima A, que
tem um alto poder do grupo acetil. É uma reacção ____, isto é, a Coenzima A promove
uma reacção importante. É favorável, pois tem uma variação de energia livre negativa.
A acetil-Coenzima A transporta grupos acetil da mesma forma que o ATP transporta
grupos fosforil e é por isso que a acetil-Coenzima A é importante.
Já na mitocôndria, o piruvato, mais a Coenzima A, mas o NAD+ formam acetilCoenzima A, CO2 e NADH, mais H+. A enzima que cataliza o processo é a piruvato
desidrogenase. Há uma descarboxilação oxidativa.
21
b) Condensação de Perkin, entre a acetil-Coenzima A e o oxaloacetato,
formação de citril-Coenzima A e sua conversão em citrato
No ciclo de Krebs já está a acetil-Coenzima A formada. Ela vai entrar no ciclo
de Krebs e formar citrato.
A acetil-Coenzima A vai condensar-se com o oxaloacetato, o produto do ciclo,
e a reacção, a condensação de Perkin, é catalisada pela citrato sintase. A condensação
forma citril-Coenzima A, que é instável, e a hidrolase do tioéster converte-o em
citrato. Na condensação há um ataque nucleofílico e forma-se o produto instável, que
é convertido em citrato.
Uma primeira forma de regulação do ciclo aparece logo aqui. Quando há muito
NADH, não ocorre esta reacção.
c) Isomerização do citrato a isocitrato
O citrato é um álcool terciário, difícil de oxidar e, por isso, é isomerizado a
isocitrato, mais fácil de sofrer aquele processo. O isocitrato é uma álcool secundário,
fácil de oxidar.
Nesta isomerização, há primeiro uma desidratação catalizada pela aconitase,
em que sai uma moléculas de água, formando-se o aconitato. Para se formar isocitrato,
há uma rehidratação. Parece um contra-senso desidratar-se para hidrtar logo dse
seguida, mas não é.
O fluoroacetato é uma substância perigosa. É uma substância mais ou menos
inerte, mas, se for ingerida, entra no metabolismo, no ciclo de Krebs, é metabolizada, e,
graças a acetil-Coenzima A sintetase converte-se em fluoroacetil-Coenzima A, que a
citrato sintase converte em fluorocitrato, que já é perigoso, pois é um inibidor potente
da aconitase. A inibição desta enzima leva ao fim do ciclo. Há quem compare esta
substância ao cavalo de Tróia.
d) Descarboxilação oxidativa do isocitrato a α-cetoglutarato
O isocitrato é descarboxilado a α-cetoglutarato. É uma descarboxilação com
uma oxidação, uma descarboxilação oxidativa, havendo duas reacções sucessivas.
O isocitrato é oxidado (é fácil de oxidar), numa reacção catalizada pela
isocitrato desidrogenase (todas as oxidações são catalizadas pelas desidrogenases),
formando-se β-cetoácido, instável, que sofre uma descarboxilação, tornando-se em αcetoácido. (Forma-se, aquando da oxidação, isocitrato desidrogenase).
e) Descarboxilação oxidação do α-cetoglutarato a succinil-Coenzima A
O α-cetoglutarato origina succinil-Coenzima A, numa reacção importante para
a conservação de eneriga. A acetil-Coenzima A tem dois carbonos: um sai na
reacção anterior, e o outro sai agora. A energia que se liberta via ser conservada na
succinil-Coenzima A. Há necessidade de Coenzima-A, que entrou e que, através do
grupo reactivo SH, se liga, formando-se o succinil-Coenzima A, um composto rico em
energia. Mais uma vez forma-se NADH, por oxidação. A reacção é catalizada pela αcetoglutarato desidrogenase.
22
f) Formação do succinato a partir da succinil-Coenzima A e formação de
GTP
A energia libertada na oxidação do α-cetoglutarato é preservada na ligação
tioéster da succinil-Coenzima A. Depois, a energia vai ser conservada em GTP e,
portanto, em ATP.
Também ao nível do ciclo de Krebs pode haver síntese desta molécula. O que
interessa é conservar a energia libertada no catabolismo dos hidratos de carbono. A
fosforilação ao nível do substrato, na passagem de succinil-Coenzima A a succinato
permite a conservação da energia. O substrato, succinil-Coenzima A, é que vai fornecer
a energia para a fosforilação, convertendo-se GDP em GTP. É uma fosforilação ao
nível do substrato, pois usa a energia do substrato para provocar a reacção. Nos
Mamíferos, o GTP pode ser convertido em ATP.
No succinil-Coenzima A, a Coenzima-A é deslocada, passando o succinilCoenzima A a succinil-fosfato. A Coenzima A foi libertada. O resíduo de histidina da
enzima que catalisa a reacção, succinil-Coenzima A sintetase, recebe o grupo fosforil
de succinil-fosfato, e vai-se formar, na enzima, uma fosfohistidina. O que resta da
catálise da enzima succinil-Coenzima A sintase é o succiniato. A fosfohistidina vai
transferir o grupo fosforil para GDP, para se formar GTP, e, no caso dos Mamíferos, o
GTP pode originar ATP, graças à enzima nucleósideo difosfato cinase.
O substrato é rico em energia e é essa energia que é usada para se proceder à
fosforilação. O tioéster é convertido em succinil-fosfato, cujo grupo fosfato passa para a
histidina da enzima, formando fosforil-histidina. Este grupo fosforil passa para o GDP,
formando-se GTP, e deste passa para o ADP, formando-se ATP.
g) Oxidação do succinato a fumarato
O succinato vai ser depois oxidado, formando-se fumarato. Nesta oxidação é o
que recebe os electrões, passando a FADH2. Os electrões não são recebidos por
NAD+ porque as reacções de passagem de alcano a alceno não têm energia suficiente
para o reduzir, mas apenas ao FAD+.
A enzima que catalisa a passagem de succinato a fumarato é a succinato
desidrogenase. É através do resíduo de histidina que se dá a ligação com o FAD+; o
resíduo de histidina estabiliza a ligação com FAD+. O FAD+ pode dar logo de seguida
os electrões para a cadeia respiratória e isto é devido à existência de clusters,
aglomerados, com ferro, importantes na captação de electrões. Os electrões são
recebidos pelo FAD+, nos clusters, e ele fornece-os imediatamente à cadeia respiratória.
Isto é possível também porque a enzima já está ligada à membrana.
FAD+
h) Hidratação do fumarato a malato
De seguida, o fumarato passa a malato, e há dois mecanismos possíveis para
fazer esta reacção de hidratação.
Pode haver uma protonação do fumarato, entrando um protão e, depois, o OHé adicionado, estando a hidratação completa. Após a protonação, forma-se um ião
carbónio, positivo, e, depois, forma-se o malato.
Noutro caso, pode antes haver um primeiro ataque por água ou OH-. Forma-se
um carbanião, carregado negativamente, e só depois há uma protonação. Só então se
forma malato.
23
Pode então haver dois modos: primeiro protonação e depois ataque pela água, ou
primeiro ataque pela água e depois a protonação.
i) Oxidação do malato a oxaloaxtato
A passagem de malato a oxaloacetato dá-se por uma oxidação que reduz NAD+
a NADH, cujos electrões são usados na cadeia respiratória. A reacção de oxidação,
como todas, é catalizada por uma desidrogenase, a malato desidrogenase
Fecha-se assim o ciclo, e o oxaloactetato pode condensar-se com a acetilCoenzima A.
3. Balanço e rendimento energético
Na respiração liberta-se o CO2 que é produzido no ciclo de Krebs.
Em termos de importância bioenergética, pode resumir-se:
acetil-Coenzima A + 3 NAD+ + [FAD+] + GDP + Pi + H2O
Coenzima A SH + 3 NADH + [FADH2] + GTP + 2 CO2 + 3 H+
A simples combustão do acetato vem:
acetato + 2 O2 + H2
2 CO2 + 2 H2O
A enzima, neste último passo, liberta a energia. No metabolismo, a energia não
deve ser desperdiçada, deve haver muito aproveitamento energético.
4. Importância no anabolismo
Até agora abordou-se o ciclo de Krebs em termos catabólicos, mas este ciclo
também é importante em termos anabólicos. O ciclo de Krebs tem uma natureza
anfibólica, pois tanto pode servir o catabolismo como o anabolismo.
Os intermediários do ciclo são muitas vezes precursores de aminoácidos. A
ornitina, a citrulina e a arginina formam-se a partir do α-cetoglutarato. A partir da
succinil-Coenzima A pode sintetizar-se a porfirina e o fumarato, caso seja necessário,
através de outro precursor pode formar aspartato e outros aminoácidos. De outra
precursor mais tardio, intermediário no ciclo de Krebs, podem formar-se aminoácidos
aromáticos. De outros intermediários podem formar-se outros aminoácidos. Todas
estas sínteses de aminoácidos vão buscar os precursores ao ciclo de Krebs. Por reacções
de transaminação, o α-cetoglutarato e a alanina formam _____________________.
A __________________ formam _______________________.
24
5. Compartimentação
Em termos de compartimentação, é importante, muitas vezes, a relação entre
compartimentos da célula, no que respeita à reacções.
Entre a mitocôndria e o citosol podem haver relações metabólicas muito
importantes. O citrato, um intermediário do ciclo de Krebs que ocorre na mitocôndria,
forma-se nesse compartimento. A sua membrana é permeável a este composto, que pode
vir para fora, para o citosol, podendo ser usado para formar oxaloacetato, numa reacção
que consome energia. Este forma acetil-Coenzima A e é uma liase que cataliza este
processo. Esta formação de acetil-Coenzima A é permitida pelo citrato que vem da
mitocôndria para o citosol e é importante porque o composto formado pode ser usado na
síntese de ácidos gordos, que é feita no citosol. Tudo é aproveitado, e o oxaloacetato
resultante pode ser convertido em malato, numa redução catalizada pela malato
desidrogenase. Aquele composto, por descarboxilação oxidativa, pode ser convertido
em piruvato.
O malato e o piruvato podem atravessar a membrana, podendo ser utilizados nos
processos que lá ocorrem. O piruvato pode originar acetil-Coenzima A, que origina
citrato. Através do piruvato, numa ____ de CO2, pode formar-se oxaloacetato. O malato
que entra na mitocôndria pode ser reoxidado, formando oxaloacetato.
Estes ciclos levam a que nada se perca e a que se forme acetil-Coenzima A para
a síntese de ácidos gordos no citoplasma. Permitem a entrada de piruvato na
mitocôndria, permitindo a formação de citrato. Se houver necessidade de energia, o
oxaloacetato condensa-se com a acetil-Coenzima A.
6. Reacçõs anapleróticas
As reacções anapleróticas permitem a reposição de intermediários no ciclo de
Krebs, quando eles são gastos. Se estão a ser usados na síntese, têm de ser repostos, por
reacções anapleróticas.
O malato e o oxaloacetato são intermediários e podem ser repostos numa
reacção em que o piruvato repõe o malato quando é gato, uma reacção catalizada pela
enzima málica. O piruvato é reduzido a malato, passando o NADPH a NADP+. O
malato pode dar origem a oxaloacetato.
Noutra reacção anaplerótica, o piruvato, por acção da piruvato carboxilase,
pode originar oxaloacetato, com gasto de energia.
Outra reacção anaplerótica importante, que também leva à formação de
oxaloacetato, é a reacção catalizada pela fosfoenolpiruvato carboxilase, que converte
o fosfoenolpiruvato em oxaloacetato.
A regulação é muito importante e estas enzimas são reguladas. A piruvato
carboxilase é regulada por alosterimo positivo por acetil-Coenzima A. Se houver
muita acetil-Coenzima A, é importante que o ciclo funcione e, para repor oxaloacetato,
a enzima funciona para permitir o andamento do ciclo de Krebs. Na fosfoenolpiruvato
carboxilase há um alosterismo negativo por aspartato, o que permite regular a
concentração daquele aminoácido na célula. O oxaloacetato forma aspartato e, se
houver muito, ele inibe a fosfoenolpiruvato carboxilase, regulando-se a produção
daquele aminoácido. A enzima málica é regulada por NADH, sendo sensível às suas
concentrações.
Estas reacções anapleróticas repõem os intermediários do ciclo de Krebs, mas
não ocorrem em todos os organismos. A da fosfoenolpiruvato carboxilase existe em
25
bactérias, leveduras e plantas; a da piruvato carboxilase ocorre em
___________________________; a da enzima málica ocorre em plantas e animais.
7. Regulação
A regulação é importante e cada uma das enzimas são pontos de regulação, pois
são reguladas alostericamente. Geralmente as enzimas são sensíveis à quantidade de
ATP, de ADP e NAD+.
Os reguladores da succinato desidrogenase são o ATP e o Pi, reguladores
negativos, o succinato, um regulador positivo, e o oxaloacetato, outro regulador
negativo.
A succinil-Coenzima A tem uma acção negativa sobre a primeira enzima. Um
produto tardio pode ter um retrocontrolo negativo. O cálcio estimula uma fosfatase
que, por desfosforilação, torna a piruvato ____ activa, enquanto o acetil-Coenzima A
e o NADH levam à fosforilação, por uma cinase, desta enzima. Alguns reguladores,
indirectamente, regulam as enzimas.
26
Ciclo do glioxilato
1. Processo global
O ciclo do glioxilato é importante em certos organismos. É semelhante ao ciclo
de Krebs, não existindo, no entanto, certas reacções, como as de descarboxilação, deste
outro ciclo. Há uma reacção de condensação de acetil-Coenzima A para formar citrato,
depois forma-se isocitrato, mas as descarboxilações que se seguem não ocorrem. Os
carbonos da acetil-Coenzima A saem como CO2 nessas reacções e nos organismos em
que o ciclo do glioxilato ocorre é desvantajoso perder os dois carbonos. As sementes de
certas plantas, como não podem realizar fotossíntese, dependem dos carbonos do
acetato para fazer a biossíntese de substâncias, incluindo os hidratos de carbono. A
Natureza arranjou forma de fazer um bypass e eliminar essas reacções.
A isocitrato liase leva à formação de glioxilato e succinato. O primeiro vai
reagir com uma outra molécula de acetil-Coenzima A, por catálise da malato____,
originando malato, que pode passar a oxaloacetato. O succinato, produzido por acção
da succinato liase (____ ____), forma fumarato, que origina malato, que, por sua vez,
dá origem a oxaloacetato. O que se elimina são, portanto, as reacções de
descarboxilação. O oxaloacetato pode formar fosfoenolpiruvato, por reacções
anapleróticas, que forma glucose.
As sementes estão dependentes do carbono do acetato para proceder à
fotossíntese. Têm muitos lípidos, pelo que podem produzir muito acetato, resultante de
_:___. ____ ____ formar-se muito acetil-Coenzima A. Como não há descarboxilação,
para não se perder carbono, o oxaloacetato pode formar-se por introdução de uma acetilCoenzima A. O oxaloacetato pode formar fosfoenolpiruvato, que origina glucose. A
gluconogénese leva à formação deste açúcar.
O ciclo do glioxilato é importante para manter os carbonos, impedindo as duas
reacções de descarboxilação.
2. Comparitmentação
O ciclo do glioxilato passa-se em dois organitos celulares: uma parte passa-se
nas mitocôndrias e a outra nos glioxissomas. Estes últimos existem nas sementes
enquanto estão a germinar, não sendo necessários depois do crescimento inicial e do
início da fotossíntese. Quando o ciclo do glioxilato é importante existem glioxissomas.
A acetil-Coenzima A, que provém do catabolismo dos lípidos, forma citrato, que
origina isocitrato, que condensa com o acetil-Coenzima A e segue o processo até
oxaloacetato. O succinato que se forma, na reacção da isocitrato liase, pode passar pela
membrana, permeável a este composto, para a mitocôndria. Neste compartimento, o
succinato passa a fumarato na matriz, este passa a malato, que origina oxaloacetato. A
succinato cinase, a fumarase e a malato desidrogenase só existem na mitocôndria.
Uma vez formado o oxaloacetato, numa reacção de transaminação em que é necessário
glutamato forma-se aspartato e α-cetoglutarato. Este vai para o glioxissoma,
juntamente com o acetato. O glutamato resultante da reacção do acetato com o αcetoglutarato vai para a mitocôndria. Dessa reacção resulta também oxaloacetato. O
malato formado no glioxissoma sai e sofre reacções no citoplasma.
27
Respiração
1. Rendimentos energéticos da glicólise e do ciclo de Krebs
O metabolismo é muito importante em termos bioenergéticos. No caso do ciclo
de Krebs, a partir de acetil-Coenzima A ocorre:
Acetil-CoA + 3 NAD+ + [FAD+] + ADP + Pi + 2 H2O
2 CO2 + 3 NADH + 3 H+ + [FADH2] + ATP + CoASH
Formam-se 3 NADH, 1 FADH2 e 1 ATP. Em termos energéticos, o que é
importante é a formação destas moléculas. Todos os equivalentes de redução são
importantes pois vão lançar electrões na cadeia, para se formar ATP.
Deve também entrar-se em linha de conta com o que se passou na glicólise.
Forma-se, no ciclo de Krebs e na glicólise, um total de 10 NADH, 2 FADH2 e 4 ATP.
O ciclo de Krebs ocorre duas vezes; 2 ATP da glicólise mais 2 dos dois ciclos de Krebs
resultam em 4. Os 10 NADH e os 2 FADH2 são equivalentes de redução importantes
por lançarem electrões na cadeia respiratória. Cada NADH que fornece electrões à
mitocôndria pode formar, na cadeia respiratória, 3 ATP, em termos estequiométricos.
Cada FADH2 forma menos, 2. Havendo 12 Coenzimas resulta ____ ATP do NADH.
____ ____, cada molécula de glucose catabolizada produz 38 moléculas de ATP.
2. Mitocôndria
A cadeia respiratória processa-se ao nível da membrana interna da
mitocôndria, é aí que se dá a grande síntese de ATP. É um mecanismo diferente do da
fosforilação ao nível do substrato, que produz menos ATP.
A mitocôndria tem uma membrana dupla, uma membrana interna e uma
membrana externa. A primeira forma invaginações que constituem cristas, dentro das
quais há a matriz.
A membrana externa é constituída por lípidos e proteínas, como todas as
biomembranas, mas a composição varia. Tem colesterol e é rica em fosfatidilinositol.
Tem uma grande permeabilidade para moléculas de peso molecular superior a 10.000 e
a sua função é manter a forma da mitocôndria, não sendo importante em termos
metabólicos.
A membrana interna não tem colesterol, sendo muito rica em proteínas, ____
____ ____ transportadores, por onde entram os substratos. Tem também todas as
proteínas da cadeia respiratória.
A matriz, dentro da mitocôndria, é o local onde se processa o ciclo de Krebs.
Apresenta as várias enzimas que participam no ciclo de Krebs, excepto a succinato
desidrogenase, que está frouxamente ligada à membrana e que transfere electrões para
o FAD+. Há também DNA, que fornece a informação para a síntese de certas proteínas,
produzidas nos ribossomas pequenos da mitocôndria. No entanto, a grande maioria das
proteínas da mitocôndria é sintetizada no citoplasma, a partir da informação do núcleo
28
e apenas algumas são sintetizadas na própria mitocôndria, pelos mecanismos existentes
na própria mitocôndria.
O espaço intermembranar é importante pois tem enzimas que podem ____ o
ATP, a creatina-cinase e a adenil-cinase. É uma estrutura onde ocorrem processos
importantes, embora as membranas sejam mais importantes.
3. Equivalentes de redução
Os equivalentes de redução são então o NAD+, o NADP+ e o FAD+. Estas são
as moléculas importantes para fornecer electrões à cadeia respiratória da mitocôndria.
NAD resume nicotinamida dinucleótido. Um H do NAD+ é substituído por
PO43- no NADP+, que é mais usado no anabolismo, enquanto o outro é mais usado no
catabolismo.
O FAD+ também é um equivalente de redução e tem várias partes; tem três
moléculas diferentes: a riboflavina, com ____ e ____. Se houver só riboflavina e o
grupo fosfato é ____ (FMN), enquanto que, se houver flavina, adenina e dinucleótido
há o FAD+. O FAD+ é tudo isto. A molécula que lança os electrões nas moléculas é todo
o FAD+, flavina-adenina dinucleótido. A forma oxidada do FAD+ é amarela. Quando
for parcialmente reduzido, com mais um H, forma uma quinona, com cor azul; fica
FADH, ou FMNH. Se receber outro electrão, se for do ião hidreto, fica na forma de
FADH2, no estado completamente reduzido, e nesta situação é incolor. O estado de
semiquinona depende do estado de associação. A um alto pH perde-se um protão e
estabiliza-se um ião semiquinona, vermelho.
4. Cadeia respiratória
O que se produz no ciclo de Krebs e na glicólise, equivalentes de redução, vão
ser lançados na cadeia respiratória. A cadeia respiratória consiste num conjunto de
reacções de oxidação-redução.
4.1. Reacção de oxidação-redução
Há uma equação que permite relacionar a alteração de energia livre ____ com a
alteração do potencial de redução.
ΔGº = -nFΔE0’
A alteração de energia livre vem em Kcal/mol. n é o número de electrões a
serem transportados e F é a constante de Faraday. ΔE0’ é a alteração de energia
entre o dador e o aceitador de electrões, a alteração no potencial de redução. O
potencial E0’ é a força electromotriz quando em condições padrão; este é o potencial
que se mede em condições padrão.
Os potenciais de redução medem-se de uma forma ____, num sistema com duas
semicélulas separadas por uma ponte de ágar e em que há um voltímetro que mede a
alteração de potencial. Tem de se ter, em cada célula (numa das células), o par redox,
(cada um) em concentrações de 1 M. A referência é o par H+/H2, em equilíbrio.
29
X- + H+
X + ½ H2
Na primeira semi-célula ocorre:
X-
X + e-
Na segunda:
H+ + e-
½ H2
X- pode perder electrões, pois está muito negativo; tem muitos electrões que
pode dar. Na semicélula de referência está o H+, que recebe electrões. Se uma
substância tem um potencial de redução muito negativo, tem possibilidade de doar
(esses) electrões, que flúem da primeira semicélula para a segunda. Se ocorrer o
contrário, o potencial é positivo e a primeira semicélula tem tendência a receber
electrões.
Na oxidação do entanol:
etanol
acetaldeído + 2 H+ + 2 e-
E0’ = -0,197 V
Como o potencial é negativo, os electrões flúem da amostra, o etanol, para a
referência, pois os electrões podem ser cedidos.
Na redução do fumarato, ele recebe electrões e origina succinato:
O potencial redox é positivo, o que quer dizer que os electrões flúem da
referência para a amostra, reduzindo o fumarato, ávido de electrões, a succinato.
Na redução do ferro, com o par Fe3+ e Fe2+, o potencial é positivo, o que quer
dizer que há redução de Fe3+ a Fe2+, pelos electrões vindos da referência.
Todos os potenciais são medidos de acordo com a referência, H+ em equilíbrio
com H2. O potencial de referência é 0, por definição. A pH fisiológico (___), é -0,421
V.
O oxigénio tem um potencial alto (baixo), o que mostra a sua avidez por
electrões. O α-cetoglutarato (também) tem um potencial baixo, pelo que tem tendência
a dar electrões, recebidos pelo NAD+.
4.2. Reacções de oxidação-redução no metabolismo
As reacções de oxidação-redução, no metabolismo, estão acopladas. A oxidação
do isocitrato a α-cetoglutarato está acoplada à redução de NAD+ a NADH. Nas
semicélulas ocorre:
NAD+ + 2 H+ + 2 e-
NADH + H+
α-cetoglutarato + 2 H+ + 2 e-
isocitrato
E0H = - 0.32 V
E0H = - 0.38 V
30
O potencial é diferente para cada reacção. A alteração no potencial é, por
convenção, a diferença entre o potencial de redução do aceitador de electrões e o
potencial de redução do dador de electrões. O aceitador de electrões tem um potencial
mais positivo, enquanto o outro tem potencial mais negativo. Neste caso, o dador é o
isocitrato e o aceitador o NAD+.
ΔE0’ = E0’(aceitador) - E0’(dador)
ΔE0’ = - 0.32 V - (- 0.38 V) = 0.06 V
ΔGº = -nFΔE0’
ΔGº = -2 (96,485 KJ/Vmol) (0,06V)
= - 11,58 KJ/mol
Como a alteração de energia livre é positiva, a reacção é espontânea. Sempre
que a alteração de potencial for positiva, a reacção é espontânea, pois a alteração de
energia livre é negativa.
Quando as condição não são padrão, ΔG vem:
[C][D]
ΔG = ΔG0 + RT ln
[A][B]
Da mesmo forma, relativamente aos potenciais:
[ox]
E = E0’ + (RT/nF) ln
[red]
ΔG0 e E0’ são relativos às condições padrão. Quando não se trabalha com
condições padrão, tem de se entrar em linha de conta com as concentrações. Depois
disto, é simples calcular a diferença de potencial entre o dador de electrões, o NADH, e
o aceitador, o oxigénio. A reacção global é:
NADH (redutor) + H2+ + ½ O2 (oxidante)
NAD+ + H2O
As semi-reacções envolvidas são:
NAD+ + 2 H+ + 2 e½ O2 + 2 H+ + 2 e-
NADH + H+
H2O
E0’ = - 0.32 V
E0’ = + 0.816 V
O que se mede é sempre o potencial de redução, pelo que as reacções aparecem
sempre no mesmo sentido. O oxigénio está ávido de electrões e vai ser reduzido __ __ a
água.
ΔE0’ = 0,816 - (- 0.32) = 1,136 V
(aceitador - dador)
31
ΔGº = -nFΔE0’
= - 2 × 23,06 × 1,14 = 52,6 Kcal/mol
= 52,6 × 4,18 = -219 KJ/mol
(1 J = 4,18 Kcal)
Mostra-se assim que a transferência de electrões na cadeia respiratória é
espontânea. Os constituintes da cadeia respiratória estão dispostos ao longo da cadeia de
acordo com os potenciais redox e os componentes estão organizados em complexos. Os
electrões vão fluindo ao longo dos coinstituintes da cadeia e fazem-no de uma maneira
favorável. Os electrões vão fluindo de potenciais de redução muito negativos, do
complexo I, para o complexo II e depois para complexo III. Dentro destes vão fluindo
através das subunidades. O potencial ____ de ser negativo e os electrões, do complexo
III, passam para o IV, e deste para o oxigénio.
4.3. Constituintes da cadeia respiratória
O complexo I é a NADH ubiquinona redutase e tem mais de 30 subunidades.
Os grupos prostéticos mais importantes são o FAD+ e o FMN. O complexo II é mais
pequeno e tem cinco grupos prostéticos. O complexo III é grande (9-10 subunindades)
e tem como grupos prostéticos grupos heme. O citocromo C é uma molécula simples
com MC como grupo prostético e serve apenas para activar os electrões. A citocromo
oxidase apresenta uma massa grande (mais de 10 subunidades) e os grupos prostéticos
são o MA e o MA3.
Em termos moleculares, existem várias moléculas importantes que formam os
complexos da cadeia respiratória. Umas são as flavoproteínas, que contêm FAD ou
FMN como grupos prostéticos e que são importantes no transporte de electrões na
mitocôndria. Há Coenzima Q ou ubiquinona, responsável por transferir um ou dois
electrões. A Coenzima Q, na forma oxidada, é designada de ubiquinona; com um
electrão, é designada de semiquinona; se receber dois, fica na forma completamente
reduzida, designada ubiquinal. Os citocromos b, c, c1, a e a3, são muito importantes
na cadeia e contêm grupos prostéticos heme, responsáveis pela transferência de um
electrão. As proteínas sulfuro-ferrosas transferem um electrão de cada vez e as
proteínas cúpicas também só transferem um electrão de cada vez, envolvendo os
estados Cu+ Cu2+. São estas as moléculas responsáveis pela transferência de electrões
na cadeia e podem transferir um ou dois electrões, no caso da Coenzima, ou só um, nos
restantes casos.
4.4. Fluxo de electrões na cadeia respiratória
Os electrões flúem de potencias mais negativos para potenciais mais negativos.
Os complexos que constituem a cadeia respiratória estão organizados de acordo com o
potencial de redução, e os electrões podem deslocar-se de potenciais mais negativos
para potencias mais positivos, até ao oxigénio. O complexo I passa os electrões para o
complexo II, este para o complexo III, este para o citocromo C e este para o complexo
(citocromo) IV. Este passa-os para o O2.
O complexo I recebe os electrões do NADH e diz-se que ele é, por isso, uma
desidrogenase. Ele é oxidado e os electrões vão para a ubiquinona. O complexo II
designa-se de succinato-Coenzima C-oxidorredutase e, aqui, quem fornece os
electrões à cadeia respiratória é o succinato. O acil CoenzimaA, resultante do
metabolismo dos ácidos gordos fornece os electrões a uma desidrogenase que participa
__ __ catabolismo dos ácidos gordos. Há ainda mais um complexo, que transfere os
32
electrões para a ubiquinona. Eles vão depois para o complexo III, daí para o
citocromo C e daí para o complexo IV.
4.5. Conservação de energia
A cadeia respiratória produz energia usada no trabalho, seja biossíntese, ____
ou ____. A conservação de energia consiste na formação de ATP, que é a “moeda
energética” da célula. Na glicólise e no ciclo de Krebs forma-se ATP, mas a energia dos
equivalentes de redução NADH e FADH2 também é aproveitada.
Na respiração sintetiza-se ATP por fosforilação oxidativa. O mecanismo é mais
importante, faz-se na membrana interna da mitocôndria e permite a síntese de
maiores quantidades de energia. A cadeia respiratória leva à ejecção de protões,
formando-se um gradiente quimiósmótico que leva à produção de ATP.
4.6. Análise dos fluxo de electrões ao longo da cadeia respiratória
a) Complexo I
O NADH fornece os electrões ao complexo I. Este complexo é formado por
várias subunidades: há uma parte maior com flavoproteínas e proteínas
sulfuroferrosas, e uma proteína hidrofóbica embebida na camada de lípidos. O
NADH está reduzido e fornece os electrões à flavoproteína FMN, que passa a FMNH2,
formando-se NAD+. O FMNH2 está reduzido e passa os electrões aos centros
sulfuroferrosos, que ficam reduzidos. Estes centros só recebem os electrões, e não os
iões hidreto. Os electrões vão reduzir os centros, mas libertam-se 2 protões (H+). Os
electrões que estão agora nos centros sulfuroferrosos vão ser transportados para a
ubiquinona na forma de iões hidreto, indo buscar dois protões. A ubiquinona
reduzida, com os electrões, vai transportar os electrões para outros componentes,
centros sulfuroferrosos, que só recebem electrões, libertando-se, para o exterior, dois
protões. Este movimento de electrões ao longo dos componentes deu origem a uma
ejecção de protões. Entretanto, os electrões dos centros vão reduzir ubiquinona, tendo
de se buscar mais protões.
O fluxo de electrões neste complexo leva à ejecção de protões para o exterior e a
captação de dois protões (electrões) do interior, contribui, também, para o gradiente.
Dois dos protões não saem, mas a captação equivale à saída. Assim, pode dizer-se que,
para cada 2 electrões transportados no complexo I, transportam-se 4 H+ para fora. A
ubiquinona funciona como intermediário e como aceitador dos electrões do complexo I.
O complexo I é importante pois contribui para a formação do gradiente.
b) Complexo II
Quem fornece os electrões ao complexo II é o succinato. Na oxidação deste
composto a fumarato, os electrões vão para o FAD+, formando-se FADH2, que
pertence a uma enzima do ciclo de Krebs ligada frouxamente à membrana (a única do
ciclo nesta situação). Os electrões do FADH2 vão reduzir a ubiquinona, indo também
protões. Tudo se passa ao nível da membrana e os protões __ __ de espaços matriciais.
Os protões não saíram pois a alteração de energia livre é muito baixa, não havendo
força para os transportar (transportar os electrões) contra o gradiente.
O complexo II não contribui para a formação do gradiente de protões, ao nível
da membrana.
33
c) Complexo III
O complexo III é ainda mais importante para a formação do gradiente. A
Coenzima Q - citocromo reductase traz os electrões da ubiquinona para o citocromo
C. Nos componentes há um ciclo Q.
No primeiro semiciclo Q há um pool de ubiquinona reduzida, que vai
fornecer os seus electrões, sendo oxidada. Ela transfere electrões para o citocromo C,
que recebe apenas estas partículas, libertando-se os protões, mas só um dos electrões vai
para aquela molécula, pois o outro foi reduzir o pool de ubiquinona na forma UUQ
(forma de semiquinona). Nesta primeira fase, a ubiquinona completamente reduzida
fornece dois electrões, mas os dois protões saíram. Dois protões são ejectados quando
há transferência de electrões; ____ ____ de dois electrões saem dois protões. Um dos
electrões vai para o citocromo C e o outro para a ubiquinona UUC.
No segundo semiciclo Q, um electrão da ubiquinona reduzida vai também para
o citocromo C, enquanto o outro vai reduzir a ubiquinona do pool no estado UQ-. Ela
fica com dois electrões, mas, para ficar reduzida, tem de captar dois protões.
Na primeira fase do ciclo foram ejectados 2 protões, e na segunda foram
ejectados mais 2. Há, assim, 4 protões ejectados e foram captados mais 2. O complexo
III contribui grandemente para o gradiente, pois há libertação de 4 protões e captação de
mais 2.
d) Citocromo C
Os electrões vão do complexo III para o citocromo C, outro intermediário da
cadeia respiratória, que só recebe electrões e não protões, iões hidreto. Ele recebe
electrões pois as suas moléculas têm grupos heme, no centro, com ferro. Há uma
protoporfirina IX ferrosa, que existe também na hemoglobina. No citocromo C, o
grupo heme, semelhante, heme C, tem resíduos de cisteína. No grupo heme A, que
existe no citocromo A, existe uma cadeia isoprenoide e um grupo formil. Os
citocromos diferem no grupo heme, importante na captação de electrões.
e) Complexo IV – Citocromo oxidase
O citocromo C vai fornecer os electrões ao complexo IV, também designado de
citocromo oxidase. Os citocromos transferem só electrões. Estas partículas são
transportadas para o oxigénio, sendo essa a função deste complexo. O O2 tem potencial
muito positivo e os electrões vão fluindo sempre para potencias mais positivos.
Alguns (Os) componentes do complexo IV são proteínas cúpricas, com cobre,
e fazem-se transferências de um electrão de cada vez, por limitação dos centros. Depois
passa-se para centros com ferros e, de seguida, os electrões passam para o citocromo
A3, com ferro. Depois vão para outro componente com cobre e, por fim, vão reduzir
oxigénio, que vai originar água.
½ O2, mais 2 protões, origina água. Em termos da produção de gradiente, a
matriz fica mais básica, pelo que isto equivale a um transporte de protões par o
exterior. A este nível há contribuição de 2 protões para o gradiente. São captados 2
protões da matriz por cada electrão transportado pelo complexo. Quando o electrão
passa do último centro cúprico para o oxigénio, para formar água, há captação de 2
protões.
34
4.7. Gradiente electróquímico
Todos os complexos estão, assim, a contribuir para a formação de ____ um
gradiente de protões. Deste modo, mostra-se que o transporte de electrões ao longo da
cadeia respiratória forma um gradiente osmótico. Os protões têm carga e, ao nível da
membrana interna, forma-se um gradiente eléctrico, para além do químico, devido à
diferença de concentração. No interior o potencial é negativo e a concentração mais
baixa, enquanto no exterior o potencial é positivo e a concentração maior. Formou-se
um gradiente electroquímico.
Foi Mitchell quem propôs a teoria quimiosmótica, a teoria que defende que é a
energia do gradiente que provoca a produção de ATP.
ΔG = RTln([C2]/[C1]) + ZFΔΨ
A alteração da energia livre tem dois componentes, um químico e um eléctrico.
ΔG = RTln([H+]out/[H+]in) + FΔΨ
ΔG = -2,3RT(pHout – pHin) + FΔΨ
pH = – log [H+]
O ΔΨ, o gradiente eléctrico que se forma, é aproximadamente igual a 0,18 V. O
gradiente osmótico é ____, mais ou menos, uma unidade. Para o fluxo de 1 mole de H+:
ΔG = 2,3RT + FΔΨ
F = 96,485 KJ/V
T = 37 ºC
ΔG = 5,9 KJ + 17,4 Kj = 23,2 KJ
Os protões estão, portanto, a ser ejectados de um modo desfavorável, contra o
gradiente, pelo que tem de haver energia. Quando os protões vão para dentro, a reacção
é favorável, e é a sua energia que é usada para sintetizar ATP.
4.8. ATP sintetase
Quem vai usar a energia da passagem dos protões para o interior da mitocôndria
é a ATP sintetese, designada de complexo V. O mecanismo de síntese de ATP é levado
a cabo por uma ATPase, e é uma transmutase que transporta o ATP para ____. O
transporte de electrões na cadeia respiratória permite a ejecção de protões, o que
contribui para a formação do gradiente electroquímico destas partículas. Esse gradiente
tem energia que é usada pela ATP sintetase que existe na mitocôndria e que sintetiza
ATP.
a) Partes e subunidades
A ATP sintetase apresenta protuberâncias para dentro da mitocôndria e tem
várias subunidades, pelo que é designada de complexo V. Na parte F0 existem
subunidades A, B e C. As C são importantes pois delimitam um poro, através do qual
os protões que estabelecem o gradiente, em maior concentração fora, tendem a ir para a
matriz. É esse influxo de protões que permite dissipar o gradiente. Na formação do
35
gradiente conserva-se a energia, enquanto a energia da dissipação do mesmo é usada
para sintetizar o ATP.
Na parte F1 há subunidades ε e Δ, imporetantes por controlarem a interacção
entre F0 e F1. A subunidade γ controla a abertura do poro e há também duas
subunidades β e uma α.
b) Teoria quimiosmótica
É a ATP sintetase que permite a síntese de ATP por dissipação do gradiente
electroquímico (químico e osmótico, com as componentes química, de concentração, e
eléctrica). Mitchell teorizou isto na sua teoria quimiosmótica e estava certo, tendo ganho
o prémio Nobel.
Na comprovação, fizeram-se vesículas artificiais, com bicamada lipídica e as
enzimas necessárias. Formaram-se vesículas em tubos de ensaio e isolou-se a ATPase,
que foi colocada nas vesículas. Isolou-se também uma proteína de bactérias que, na
presença de luz, ____ protões, e colocou-se nas vesículas. Na luz, havia transporte de
protões para o interior, que ficava mais ácido. Adicionando ADP, verificava-se que se
formava ATP. Demonstrou-se assim que a única fonte de energia é o gradiente de
protões.
c) Conformações da ATP sintetase e etapas do processo de síntese de ATP
A ATP sintetase sintetiza ATP quando, por ela, passam protões. Ela tem três
conformações: O, inactiva, com baixa afinidade para com os ligandos; L, com fraca
afinidade, mas já implicada ___ligações; e conformação T, activa, com alta afinidade
para os ligandos.
A síntese de ATP pela enzima processa-se por um mecanismo em que são
essenciais estas três etapas. Os ligandos, ADP e Pi, ligam-se, inicialmente, ao estado
conformacional L, onde ocorre a formação de ATP. No entanto, esta molécula só é
sintetizada quando a subunidade L passa a T, e, para isso, o ATP da subunidade T é
libertado. Há uma rotação de subunidades Ao libertar-se o ATP, a conformação T passa
a O e a L a T. A posição que inicialmente era T passa a O e a que era L passa a T.
Depois destas três etapas, a nova conformação T liberta ATP e fica na conformação O.
Resumindo, os ligandos ligam-se a L, que sintetiza ATP na forma T e, que, após libertar
a molécula formada, fica na conformação O.
4.9. Fosforilação oxidativa
Este processo de síntese de ATP chama-se fosforilação oxidativa, pois há
fosforilação de ADP e transporte de electrões. O transporte de electrões ao longo da
cadeia provoca oxidações.
4.10. Inibidores da cadeia respiratória
Há venenos enormes específicos para estes processos. Alguns, como a rotenona
(entre outros), bloqueiam os electrões no complexo I. Há venenos, como a
fluoroacetona, o tenuilfluoroacetato, entre outros, que bloqueiam o complexo II. A
antimicina bloqueia especificamente o transporte de electrões ao nível do complexo
III. ____, cianeto e monóxido de carbono actuam ao nível da citocromo oxidase.
36
Se a cadeia estiver ____ a partir do complexo II, a contribuição do succinato
para o gradiente osmótico pode permitir a síntese de ATP. No bloqueio a partir do
complexo III, já não há substrato natural que permita a síntese de ATP, embora haja
substratos artificiais que ainda permitem o processo, pelo gradiente formado a partir da
parte livre.
A oligomicina e a ____ bloqueiam a ATP sintetase, e, mesmo fornecendo
electrões, não há fosforilação.
Os desacopladores, como o dinitrofenol e outros, tornam a membrana
permeável a protões (ela tem de ser impermeável). Nessa caso, já não há gradientes,
não havendo fosforilação de ADP para ATP. O desacoplamento entre a parte oxidativa e
fosforilativa impede a síntese de ATP, mas continua o transporte de electrões, pois não
há nada que o bloqueia. Até continua mais depressa, pois o gradiente está a ser
dissipado pela substância, e a mitocôndria trabalha para o repôr.
“Tudo é venenoso, dependendo da dose” – Paracelsus
As amêndoas têm cianeto, mas em baixas quantidades. O monóxido de carbono
é perigoso e ocorre na fase gasosa.
4.11. ADP-ATP exchange
O gradiente é necessário para haver síntese de ATP, mas, propriamente, a
formação de ATP que fica ligado à ATP sintetase ocorre mesmo na ausência de protões
(mesmo na ausência de protões isso ocorre). Na ausência do gradiente de protões
aparece o AP ligado à enzima, mas não há net síntese de ATP, pois não há libertação
desta molécula, não havendo energia para isso. Não pode (Pode) haver a reacção de
exchange de ADP e ATP sem o gradiente, cuja energia é necessária para se libertar o
ATP, para se poder formar (podendo formar-se) mais.
O gradiente permite a simples ADP-ATP exchange. Para haver net síntese é
necessária energia, para se libertar ATP (é essa a etapa que requer energia).
4.12. Transporte de ATP e ADP.
O ATP é sintetizado na mitocôndria mas tem de sair, pois é utilizado fora dela,
enquanto o ADP tem de entrar. O transporte de ATP para fora e a entrada de ADP na
mitocôndria dá-se graças à ATP-ADP transmutase, que usa o gradiente electroquímico
que ocorre ao nível da membrana interna. O ATP tem 4 cargas negativas e o ADP tem
3. Saindo 4 e entrando 3, em termos net só uma carga negativa sai, o que equivale à
entrada de um protão. O gradiente eléctrico tende a dissipar-se. A síntese de ATP
implica que um protão entre através do poro da ATP sintetase, saindo uma carga
negativa. O gradiente está a ser dissipado. O próprio transporte tem um custo
energético, usando energia do transporte de electrões.
Em experiências, ao longo do tempo, a velocidade de transporte de electrões
(medida pelo gradiente de O2 observado) aumenta quando se adiciona ADP. Nessa
situação, há transporte de ADP e dissipa-se o gradiente, pelo que tem de se transportar
mais rapidamente os electrões para ele ser reposto. A velocidade depende, portanto, da
presença de ADP. Enquanto ele existir, a velocidade de transporte é maior.
37
5. Transporte de equivalentes de redução
Como foi referido, o que fornece os electrões a cadeia respiratória são os
equivalentes de redução. Os equivalentes de redução da glicólise também são utilizados,
mas, como a membrana da mitocôndria é impermeável, __ ____ de a transportar. Os
sistemas shuttle levam ao transporte de electrões para a mitocôndria e existem dois
shuttles que transportam os electrões de NADH.
A dihidroxiacetona-fosfato pode passar a glicerolfosfato, ao ser reduzida pelo
estado de NADH. O glicerolfosfato já pode atravessar a membrana. Pode haver uma
reacção inversa, em que o glicerolfosfato é oxidado, fornecendo os electrões a FAD+,
que passa a FADH2. Forma-se dihidroxiacetona-fosfato, que vai para o citosol. O
FADH2 fornece os electrões para o complexo II, e não ao complexo I, e permite menor
síntese de ATP que o NADH (pois forma menos ATP). Se se usar este shuttle,
aproveita-se menos energia.
Há outro shuttle. Por transaminação, o α-cetoglutarato é reduzido (/) e origina
oxaloacetato, que forma malato. Este pode atravessar a membrana, há oxidação e,
dentro da membrana, forma-se NADH, podendo haver maior formação de energia.
Forma-se também oxaloacetato, que, por transaminação, forma α-cetoglutarato, que
atravessa a membrana. Formam-se mais ATP’s se se utilizar este último shuttle em vez
do outro.
6. Efeito Pasteur
Pasteur verificou que leveduras consumiam muita mais glucose se estivessem n
a ausência de oxigénio; na presença de oxigénio, a glucose consumida é menor. Este é
o efeito Pasteur: em anaerobiose, o consumo de glicose é maior, enquanto que, na
presença de oxigénio, é menor. Isto verifica-se em leveduras, mas também em células
musculares.
Na glicólise há enzimas-chave na sua regulação, e uma delas é a piruvato
cinase, que é inibida por ATP. No segundo ponto de regulação, a enzima-chave é a
fosfofrutocinase, que é também inibida por ATP. Na presença de oxigénio, uma célula
tem mais ATP, que é mais produzido. O ATP que se está a formar vai ter uma acção
inibitória neste ponto de regulação da glicólise, inibindo-a. Assim se explica o efeito
Pasteur.
38
Capítulo 2: Anabolismo da glicose
Vai estudar-se o anabolismo da glicose, isto é, a síntese de glicose, a
gluconeogénese.
Gluconeogénese
1. Processo global
A gluconeogénese, tal como o nome indica, é a síntese de glucose, é um
processo oposto da glicólise. A via anabólica não pode ter uma reversibilidade
completa; são dois processos opostos, mas só há reversibilidade parcial.
Pode partir-se (começar-se) do piruvato ou do lactato, que também (____)
origina piruvato. Na glicólise, o fosfoenolpiruvato passa a piruvato, mas a reacção não
é reversível, pelo que tem de haver algo que faça a transformação de produtos.
______________________________________________________________________
______________________________________________________________________
_____________________________________. O ácido 3-fosfo____ passa a ácido-1,3bifosfo____ (há reversibilidade). Depois, este é convertido a gliceraldeído-3-fosfato
noutra reacção reversível, que passa, mais tarde, a frutose-1,6-bifosfato, em mais uma
reacção reversível. De seguida há uma reacção irreversível, em que a frutose-1,6bifosfato vai formar ____ e frutose-6-fosfato. A frutose-1,6-bifosfato passa a este
composto por uma reacção de desfosforilação típica, catalizada por uma fosfatase.
Depois, a frutose-6-fosfato passa a glucose-6-fosfato, por isomerização, noutra reacção
reversível da glicólise, e aquela última tem de ser desfosforilada, numa reacção típica
da gluconeogénese (não é uma reacção reversível da glicólise) em que há uma fosfatase
que provoca a desfosforilação.
Há, assim, três reacções irreversíveis, e são estas as reacções típicas da
gluconeogénese. As duas últimas reacções exclusivas, catalizadas por fosfatases, estão
separadas por isomerização. Têm uma variação de energia livre muito negativa, que
constitui uma grande contribuição para que a gluconeogénese tenha uma variação de
energia livre muito negativa, que torna o processo espontâneo e favorável.
Se glicólise tivesse uma reversibilidade completa, não se processaria
espontaneamente na Natureza. As ____ que impedem a reversibilidade completa da
glicólise. A glicólise é exergónica e, se a gluconeogénese fosse o reverso (a
reversibilidade), seria endergónica, não se processando na Natureza. As duas reacções
de fosfatases separadas por uma isomerização contribuem para o ΔGº negativo. Os dois
processos também não ocorrem em simultâneo; quando um ocorre, o outro está inibido,
tendo de haver uma regulação recíproca. Isto permite que ambos os processos sejam
espontâneos. Tudo isto é ultrapassado pois existem aquelas três reacções específicas.
39
2. Análise das reacções irreversíveis
a) Conversão do piruvato em fosfoenolpiruvato
O piruvato não pode passar directamente a fosfoenolpiruvato, tendo se ser
convertido em oxaloacetato, numa reacção que não é reversível. A piruvato
carboxilase é a enzima que cataliza esta reacção (a enzima já foi referida numa reacção
anaplerótica, que repõe intermediários do ciclo de Krebs.
O piruvato vai ser carboxilado, pelo que são necessários bicarbonato e ATP
(energia) como substratos. Para esta reacção ocorrer é também necessária biotina, uma
Coenzima. A piruvato carboxilase tem uma aminoácido, uma (a) lisina, com um
épsilon-aminogrupo, a que se liga a biotina, actuando como Coenzima. O oxigénio do
bicarbonato vai fazer um ataque ao γ-fosfato do ATP, indo formar-se um carbonilfosfato e saindo ADP. Nesta situação, os substratos já contribuíram. A biotina actua
como Coenzima e vai interagir com o carbonil-fosfato, formando carboxibiotina. Entra
então o piruvato, que se liga à enzima, a piruvato carboxilase, e há um protão que é
subtraído do piruvato, formando-se um carbanião, que vai atacar um carbono da
carboxibiotina. Ao fazer o ataque, liberta a biotina, formando-se o oxaloacetato. O
piruvato é carboxilado, formando-se oxaloacetato.
Isto passa-se, em termos de compartimentação, na matriz da mitocôndria. O
piruvato entra neste organito e passa a oxaloacetato, que não atravessa a sua membrana
e, por isso, tem de ser convertido em malato. Este atravessa a membrana da
mitocôndria, onde é reoxidado, formando o oxaloacetato. A enzima que cataliza a
reacção seguinte só existe no citosol. Para se transformar o oxaloacetato em
fosfoenolpiruvato, o primeiro tem de vir, através deste subterfúgio, para o exterior.
A piruvato carboxilase também é importante em termos de regulação
metabólica, sendo regulada por certos factores. É regulada pelo nível de acetilCoenzima A, um regulador halostérico que a activa. A enzima, para funcionar, requer
acetil-Coenzima A ao seu ____. Se a célula tiver alto nível de acetil-Coenzima A e
ATP, não se requer muita energia e, portanto, estes compostos (/) tendem a ir para a
biossíntese (e não o catabolismo). Se os níveis de ATP forem baixos, o piruvato é
disponibilizado para o ciclo de Krebs, ocorrendo o catabolismo. A piruvato carboxilase
é importante pois é um regulador, sendo sensível aos reguladores halostéricos. É um
ponto de regulação. A reacção que catalisa também tem função anaplerótica, repondo
intermediários do ciclo de Krebs.
De seguida, o oxaloacetato é convertido em fosfoenolpiruvato, que é rico em
energia. O oxaloacetato, que inicialmente foi produto da carboxilação do piruvato, vai
ser descarboxilado, originando fosfoenolpiruvato. O CO2 que inicialmente foi
adicionado vai ser retirado, sendo esta reacção uma reacção de descarboxilação,
catalizada pela fosfoenolpiruvato-descarboxilase (PEP-descarboxilase). É necessário
GTP para que tudo seja possível. Ele pode ser convertido em ATP pela nucleosídeo
difosfato cinase, pelo que gastar GTP equivale a gastar ATP.
Estas duas reacções são importantes para tornar a gluconeogénse possível,
através dos processos vistos.
b) Desfosforilação da frutose-1,6-bifosfato a frutose-6-fosfato
As reacções que ocorrem até se formar frutose-1,6-bifosfato são reversíveis,
partindo de fosfoenolpiruvato.
40
A desfosforilação de frutose-1,6-bifosfato a frutose-6-fosfato é o segundo
ponto de irreversibilidade da glicólise. A reacção que ocorre na glicólise é catalizada
por outra enzima, a fosfofrutocinase, enquanto, neste caso, a reacção é catalizada pela
frutose-1,6-bifosfatase, que é regulada por citrato, um activador halostérico, e inibida
por frutose-2,6-biofosfato. Os factores que inibem a via anabólica também regulam a
glicólise, mas estimulando-a.
c) Desfosforilação da glucose-6-fosfato a glucose
A terceira reacção específica da gluconeogénese é outra reacção irreversível, a
passagem de glucose-6-fosfato a glucose. É também catalizada por uma fosfatase, a
glucose-6-fosfatase, e passa-se ao nível do retículo endoplasmático. A enzima existe
ao nível da membrana desta estrutura. A glucose-6-fosfato entra no retículo
endoplasmático, passando pela membrana e, nesse processo, sofre desfosforilação,
originando glucose. Este açúcar entra na corrente sanguínea por exocitose. A glucose-6fosfatase tem um resíduo de histidina muito importante que, no processo de
desfosforilação, vai levar a que se forme um intermediário de fosfohistidina.
3. Requisitos energéticos
De facto, a gluconeogénese ocorre espontaneamente pois, no processo, foi
necessária energia. Foi necessário ATP na passagem de piruvato a oxaloacetato
(fosfoenolpiruvato), e, na passagem de oxaloacetato a fosfoenolpiruvato, foi necessário
GTP. Para que a gluconeogénese ocorra são necessários 4 ATP’s e 2 GTP’s, e também
2 NADH. Para que este processo ocorra, tem de ____ mais energia que no processo de
glicólise. São necessários 6 nucléosideos-trifosfato.
Se o processo de glicólise fosse reversível, a síntese de glucose não seria
espontânea. A adição de ATP e GTP e as duas reacções finais da gluconeogénese levam
a que o processo seja favorável e ocorra espontanemaente.
4. Ciclo de Cori
O metabolismo de um órgão pode estar ligado ao de outro órgão. O metabolismo
está todo interligado, quer numa célula, quer num órgão ou organismo. No ciclo de
Cori evidencia-se a relação entre o fígado e os músculos.
Os músculos requerem muita energia. Quando o músculo é sujeito a exercício
violento, fica em anaerobiose, ocorrendo fermentação láctea, em que se produz
lactato. Este, ao entrar no fígado, vai sofrer o processo oposto, ocorrendo a
gluconeogénese, em que o piruvato passa a glucose. A glucose sintetizada entra na
corrente sanguínea e vai fornecer o músculo. Chama-se a isto o ciclo de Cori, a relação
metabólica entre órgãos.
41
5. Relação da regulação da gluconeogénese com a regulação da
glicólise
Quando há síntese de glucose, a glicólise deixa de estar activa (inibida), e, do
mesmo modo, os reguladores que estimulam a glicólise, inibem a gluconeogénese. Tem
de haver uma regulação recíproca.
A glicólise é estimulada pela frutose-2,6-bifosfato, pelo que este composto
inibe a gluconeogénese. Concentrações mais elevadas inibem mais a enzima em causa, a
frutose-1,6-bifosfatase. O AMP também tem um efeito inibitório e, somando os dois
efeitos inibitórios, verifica-se que o efeito é sinergístico. A frutose-2,6-bifosfato, em
certas condições, estimula a glicólise, estimulando a fosfofrutocinase e inibindo a
gluconeogénese através da inibição da frutose-1,6 bifosfatase.
O aparecimento deste regulador é muito importante. Ele aparece graças a uma
reacção catalizada pela fosfofrutocinase, em que se forma a partir de frutose-6-fosfato.
Quando não é necessária a regulação, há actividade de fosfatase e forma-se frutose-6fosfato. O aparecimento de reguladores metabólicos também é regulado. A enzima que
cataliza a reacção é bifuncional, podendo funcionar como fosfatase ou cinase, e é
regulada. Funcionando como cinase faz aparecer o regulador; funcionando como
fosfatase faz com que desapareça. A regulação pode ser feita por duas maneiras: por
halosterismo ou modificação covalente. A fosforilação de proteínas pode levar a
mudanças na conformação. O estado fosforilado permite que a fosfofrutocinase
funcione como fosfatase. Há uma enzima regulada por ATP que a torna fosforilada e
que é sensível, halostericamente, à acumulação de frutosde-6-fosfato.
42
Via das pentoses-fosfato ou via do fosfogluconato
1. Funções
A via das pentoses-fosfato ou via do fosfogluconato é muito importante no
metabolismo dos hidratos de carbono. As principais funções desta via na célula são:
- É importante para a formação de NADPH; é ela que permite a formação deste
composto, que é necessário para a síntese de ácidos gordos;
- Converte hexoses em pentoses (daí o nome da via, via das pentoses-fosfato).
Forma-se D-ribose-5-fosfato, necessária à síntese de nucleótidos;
- Degrada as pentoses, convertendo-as em hexoses, que podem entrar na
glicólise para sofrerem oxidação;
- Pode ser importante para formar glicose nas reacções de escuro da
fotossíntese.
2. Compartimentação
A via das pentoses-fosfato ou via do fosfogluconato passa-se no citoplasma,
juntamente com a glicólise e com a síntese ácidos gordos. Isto tem a sua razão de ser,
pois a síntese de ácidos gordos requer NADPH, formado pela via do fosfogluconato. O
ciclo de Krebs, como foi visto, passa-se na matriz da mitocôndria, assim, como a βoxidação dos ácidos gordos. A ____ passa-se na membranana __ ____ ____.
3. Processo global
Como foi já referido, a glucose, na glicólise, passa a glucose-6-fosfato, por acção
da hexocinase. A glucose-6-fosfato pode então seguir a via da glicólise, ou a via das
pentoses, conforme seja necessário. As coisas só se passam quando é necessário.
Na via das pentoses, há reacções de oxidação. A glucose-6-fosfato é oxidada,
sendo os seus electrões fornecidos a NADP+, que passa a NADPH. A enzima que
cataliza este primeiro processo é a glucose-6-fosfato desidrogenase. Forma-se 6fosfogluconolactona que, por acção de ____, origina 6-fosfogluconato. Ocorre uma
segunda oxidação, descarboxilativa, por acção da 6-fosfogluconato desidrogenase,
formando-se uma pentose, a ribulose-5-fosfato que, por isomerização, numa reacção
catalizada por uma isomerase, forma uma ribose-5-fosfato, com o enodiol como
intermediário. Origina-se um NADPH para a síntese ácidos gordos e D-ribose-5fosfato para a síntese de nucleótidos.
A ribulose-fosfato-epimerase converte ribulose-5-fosfato em xilulose-5fosfato, por epimerização. A xilulose e a ribulose podem reagir, numa reacção
catalizada por uma tiamina pirofosfato, formando gliceraldeído-3-fosfato e
sedoheptulose-7-fosfato. Estes dois podem interagir e formar, numa reacção catalizada
por uma transaldolase (transcetolase), eritrose-4-fosfato, com quatro carbonos, e
43
frutose-6-fosfato. A xilulase e a eritrose, por acção de uma transcetolase, podem
originar gliceraldeído-3-fosfato e frutose-6-fosfato, que são usados na glicólise.
Assim, como foi visto, a ribulose-5-fosfato pode ser isomerizada, formando
ribose-5-fosfato, ou epimerizada, originando xilulose-5-fosfato
Nesta via formam-se, assim, compostos com 4, 5 e 6 carbonos. É uma via muito
activa no tecido adiposo, onde se formam os ácidos gordos; nos músculos, não há
muita biossíntese. As vias do fosfogluconato e da glicólise estão interligadas pelas
reacções catalizadas pelas transcetolases e transaldolases.
4. Análise das reacções
a )Oxidação da glucose-6-fosfato a 6-fosfogluconolactona
Na primeira reacção da via das pentoses-fosfato, a glucose-6-fosfato origina 6fosfogluconolactona. A enzima que cataliza o processo é a glucose-6-fosfato
desidrogenase, que é um importante ponto de regulação e controlo. É regulada por
NADPH e ésteres de ácidos gordos e, se houver grande quantidade destes factores, a
enzima é inibida, pois não é necessário que ocorre a via. No fígado, o órgão onde este
processo é importante, há muito NADPH.
b)
.
.
.
c) Oxidação descarboxilativa do 6-fosfogluconato a ribulose-5-fosfato
Mais tarde, o gluconato passa, por uma oxidação e descarbolixlação, a
ribulose-5-fosfato. A enzima responsável é a __________________, e forma-se um
intermediário, o 3-_________________, e NADPH.
d) Isomerização da ribulose-5-fosfato a ribose-5-fosfato
A ribulose pode sofrer uma isomerização ou uma epimerização. Isomerização
significa troca de grupos entre carbonos; epimerização implica troca de grupos no
mesmo carbono. Se for isomerizada, por acção de uma isomerase, forma-se um
composto intermediário e, depois, origina-se uma ribose. A ribulose passa a ribose, que
é importante no anabolismo, para a biossíntese de Coenzimas (NADH, NADPH e
FADH2, __ ____), de nucleótidos e ácidos nucleicos.
Nestas primeiras quatro reacções, a reacção net é:
Glucose-6-P
44
e) Epimerização da ribulose-5-fosfato a xilulose-5-fosfato
A ribulose-5-fosfato, uma cetose, também pode ser epimerizada, passando a
xilulose-5-fosfato. A reacção é catalizada por uma epimerase e forma-se um
enediolato como composto intermediário.
Há troca de um grupo no mesmo carbono, passando para o lado oposto. Primeiro
há a remoção de um protão, estabelece-se uma dupla ligação, forma-se enediolato, e é
então necessário readicionar o protão. Este é-o no lado oposto, e forma-se uma xilulose.
f) Formação do glicerladeído-3-fosfato e da sedoheptolase-7-fosfato a partir
da xilulose-5-fosfato e da ribose-5-fosfato
A xilulose-5-fosfato e a ribose-5-fosfato (?), por acção de uma transcetolase,
originam gliceraldeído-3-fosfato e sedoheptolose-7-fosfato. A xilulose é a molécula
dadora de unidades de dois carbonos.
g) Formação da eritrose-4-fosfato e da frutose-6-fosfato a partir da
sedoheptolose-7-fosfato e do glicerladeído-3-fosfato
Depois pode ocorrer uma reacção catalizada por uma transaldolase, em que a
sedoheptolose-7-fosfato e o glicerladeído-3-fosfato formam eritrose-4-fosfato, com
quatro carbonos, e frutose-6-fosfato, com 6 carbonos. Um composto em C7 e outro em
C5 formam um em C4 e outro em C6.
Nesta reacção de transaldolase, a enzima, como no outro caso, tem resíduos de
lisina importantes com grupos amínicos, que formam um intermediário de base de
Schiff entre a sedoheptolase-7-fosfato e o resíduo de lisina. Depois de se formar a base
de Schiff sai a eritrose-4-fosfato e forma-se um carbanião, com carga negativa, que vai
atacar o carbono do gliceraldeído-3-fosfato, que origina a frutose-6-fosfato.
h) Formação do gliceraldeído-3-fosfato e da frutose-6-fosfato a partir da
eritrose-4-fosfato e do xilulose-5-fosfato
Na outra reacção, catalizada por uma transcetolase, há transferência de duas
unidades de carbono. A eritrose-4-fosfato pode interagir com uma xilulose-5-fosfato,
formando-se gliceraldeído-3-fosfato e frutose-6-fosfato. Um composto em C5 (C6) e
outro em C4 originam um em C3 e outro em C6. A via das pentoses pode ocorrer como
alternativa à glicólise, mas pode colaborar com ela, caso seja necessário.
O mecanismo de catálise desta transcetolase não envolve, ao contrário da
reacção anterior, bases de Schiff, mas TPP (tiamina pirofosfato). Se se remover um
fosfato, forma-se um carbanião que vai atacar um carbono da xilulose. No ataque, é
possível remover uma parte da molécula, permitindo a expulsão do gliceraldeído-3fosfato. Depois, na segunda fase, há uma transferência de unidades de dois carbonos
(um aldol) que vêm da eritrose para o que resta. Há uma recepção aldol da eritrose,
formando-se a eritrose. No primeiro passo foi expulsa uma aldose e, no segundo passo,
foi-se buscar um aldol, até se formar a frutose-6-fosfato.
Resumindo, a xilulose-5-fosfato e a eritrose-4-fosfato formam gliceraldeído-3fosfato e frutose-6-fosfato, numa reacção catalizada pela transcetolase e em que é
necessária TPP.
45
5. Interacção entre a via das pentoses e a glicólise
Se a célula precisar de energia, a glucose-6-fosfato é usada na produção de
energia, na glicólise, havendo produção de ATP. Se for necessária biossíntese, ela é
usada na via das pentoses, formando-se NADPH. A célula, conforme as necessidades
metabólicas, através da regulação dos processos-chave, segue uma via ou outra. A
escolha da via pela qual a glicose-6-fosfato segue é determinada pelas enzimas
reguladoras. Se as células têm muitos ácidos gordos e NADPH não precisam de
anabolismo, pelo que a enzima glucose-6-fosfato-desidrogenase é inibida.
A via das pentoses é ainda importante pois é possível combinar reacções suas
com as da glicólise. As vias são colaborantes.
Os destinos da glucose-6-fosfato dependem então das necessidades da célula,
podendo ser usada na glicólise ou na via do fosfogluconato.
Pode haver situações em que há necessidade de ribose-5-fosfato e NADPH. A
primeira é útil para a síntese de nucleótidos, enquanto o NADPH é usado na formação
de ácidos gordos. Na via do fosfogluconato, formam-se estas duas moléculas. A
ribulose, por isomerização, origina ribose.
Numa situação em que há maior necessidade de ribose do que de NADPH, há
uma colaboração entre a glicólise e a via das pentoses. Se a célula não precisar de
NADPH, as reacções oxidativas não devem ser precisas. As primeiras reacções, neste
caso, não interessam. No entanto, a célula precisa de ribose. A forma de resolver este
problema é usar a glicólise para extrair frutose e gliceraldeído. Da via glicolítica
extraem-se esses compostos; na via das pentoses, o gliceraldeído3-fosfato mais a
frutose-6-fosfato, por acção de uma transcetolase, originam xilulose e eritrose. A
primeira, por epimerização, pode originar ribulose, que pode, por isomerização, formar
ribose. A eritrose, mais frutose, por acção de uma transaldolase, origina sedoheptolose
e gliceraldeído-3-fosfato. Este último origina mais xilulose, que depois passa a
ribulose-6-fosfato por epimerização. Há, portanto, uma maior formação de ribulose,
que, por isomerização, forma ribose. Formam-se várias moléculas de ribose. A célula
não precisa de NADPH.
Numa situação em que se necessita mais de NADPH do que ribose-5-fosfato, a
estratégia é reciclar ribose. São necessárias reacções oxidativas, para produzir NADPH.
Nas reacções forma-se ribose, mas esta não é necessária, pelo que é possível reciclá-la
Na via das pentoses, a xilulose origina ribulose por epimerização e esta, por
isomerização, origina ribose. A xilulose mais a eritrose originam sedoheptolose, por
____, e esta, juntamente com o gliceraldeído, originam eritrose e frutose (xilulose). A
frutose-6-fosfato origina glucose-6-fosfato. A célula está a precisar muito de NADPH,
pelo que interessa formar muita glicose-6-fosfato, para entrar nas reacções de produção
desse equivalente de redução. A eritrose pode interagir com uma xilulose e, pela acção
de uma transcetolase, originar frutose e gliceraldeído-3-fosfato. A frutose-6-fosfato
origina glucose na gluconeogénese. 6 ribuloses são recicladas para formar 5 glucoses,
que podem ser usadas para formar NADPH.
A quarta necessidade é a de NADPH e ATP, sendo ribose-5-fosfato
desnecessária. A xilulose (ribulose), por epimerização, forma ribulose (xilulose), que,
por ismerização, origina ribose. Na via das pentoses, gliceraldeído-3-fosfato mais
sedoheptolose-7-fosfato, são originados por uma transcetolase; uma transaldolase
origina frutose e eritrose, a partir de gliceraldeído-3-fosfato e sedoheptolose-7-fosfato.
A frutose entra na via glicolítica, pois é necessária energia, ocorrendo a glicólise até se
formar piruvato. A eritrose mais a xilulose, por acção de uma transcetolase, originam
frutose-6-fosfato e gliceralfdeído3-fosfato. A frutose vai ser usada na glicólise e o
46
gliceraldeído que também é produzido também é um intermediádio desse processo. Era
necessário NADPH e, na glicólise, forma-se NADPH, NADH e ATP.
47
Capítulo 3: Metabolismo do glicogénio
Quimicamente, o glicogénio é um polímero de unidades de glucose que formam
cadeias lineares, que constituem este composto. Estas unidades de glucose unem-se
através de ligações glicosídicas α-1,4, são estas as responsáveis por unir as moléculas
de glicose, formando cadeias lineares. Uma molécula de glicogénio é, no entanto,
ramificada. A posição 6 pode permitir a ligação a um carbono 1, uma ligação α-1,6. As
ligações lineares são α-1,4. Assim se forma o polímero ramificado de glicogénio,
constituído por unidades de carbono unidas por ligações glicosídicas.
O glicogénio é importante por permitir armazenar glucose. Pode armazenar-se
glucose sob esta forma e é, de facto, a principal forma de o fazer. Nos músculos existe
muito glicogénio, pois estes órgãos necessitam de energia. Existe também muito no
fígado. O glicogénio é extremamente importante em termos fisiológicos, pois permite
regular a quantidade de glicose (glicogénio) no sangue. Se não se estiver a ____
glicólise, é necessário que se tenha glicose no sangue. Este açúcar é necessário para o
metabolismo celular, incluindo cérebro. Há células com reservas, mas as do cérebro não
têm, vindo sua glucose apenas do sangue. Quando há pouca glucose, podem haver
desmaios. Em situações em que não há alimentação, a glucose do sangue vem do
glicogénio.
As partículas de glicogénio aparecem no citoplasma. Os grânulos deste
composto são constituídos pela molécula em questão, mas, além dela, que está a ser
sintetizada e degrada, há também as proteínas reguladoras do metabolismo do
glicogénio e as enzimas necessárias à formação e degradação. As proteínas referidas
são importantes, pois regulam a quantidade de glicose no sangue.
Na degradação e na síntese do glicogénio há reacções comuns, mas nem todas
o são, sendo as duas vias absolutamente independentes. A síntese e a degradação do
glicogénio são independentes, as vias são independentes. O metabolismo do glicogénio,
como o metabolismo em geral, é altamente regulado.
48
Catabolismo do glicogénio
1. Clivagens fosforolítica e hidrolítica
O glicogénio tem n resíduos, o que significa que o polímero pode ter uma
grande cadeia. Se for degradado, vai ser degradado sucessivamente para poder dar mais
unidades de glucose. Há uma reacção em que o glicogénio é reduzido em uma
unidade de glucose. Essa libertação sucessiva de uma unidade de glucose da cadeia
linear de glicogénio é feita por uma reacção de fosforilação. O ortofosfato, Pi,
promove a lise e libertação de cada unidade de glucose. A fosforilação implica a
libertação de unidades de glucose, na cadeia linear. Há introdução de Pi, que é
responsável pela ___ da ligação α-1,4. A reacção de fosforilação é catalizada por uma
enzima, a fosforilase do glicogénio. O que se liberta é uma glucose fosforilada, e a
célula tem uma vantagem por ela aparecer nesta forma. No estado fosforilado, a glucose
não sai facilmente da célula, mantendo-se lá. A glucose já está fosforilada __ ____,
portanto, entra nas vias sem se consumir mais ATP. Esta é uma reacção de fosforólise, a
clivagem fosforolítica do glicogénio.
A clivagem fosforolítica relaciona-se com um piridoxalfosfto, envolvido no
mecanismo fosforolítico do glicogénio. O fosfato dá um protão ao glicogénio e o
piridoxalfosfato dá outro. Forma-se um ião carbónio que é atacado por fosfato e,
finalmente, forma-se o resíduo de glucose-1-fosfato. O pirifoxalfosfato adquire, depois,
o protão.
As cadeias laterais são ligadas por ligações α-1,6. Primeiro o glicogénio é
digerido fosforoliticamente na cadeia principal, mas a clivagem de uma ligação α-1,6 é
hidrolítica, em vez de fosforolítica. A reacção é catalizada por uma glucosidase e
origina-se glicose e glicogénio com menos um resíduo. Esta enzima é desramificadora.
Parar degradar o glicogénio há várias fases. Inicialmente, começa a clivagem
fosforolítica, em que as ligações α-1,4 vão sendo sucessivamente clivadas pelo Pi, na
reacção catalizada pela fosforilase. Esta enzima só reconhece a ligação até um certo
ponto e, quando as cadeias são curtas, já não reconhece. Os resíduos que não podem ser
reconhecidos vão para outro braço, por acção de uma transferase. A cadeia linear fica
maior e resta apenas uma ramificação. Há uma clivagem hidrolítica, catalizada pela
glucosidase, a enzima desramificadora, que hidrolisa os resíduos com ligação α-1,6.
Fica uma única cadeia simples e a degradação seguinte é catalisada pela fosforilase.
São, assim, necessárias duas enzimas.
2. Destino da glicose-1-fosfato
Desta libertação de unidades de glucose resulta a glucose-1-fosfato, fosforilada
na posição 1, mas, para que entre nas vias metabólicas, é necessário que esteja
fosforilada na posição 6. Interessa que o que resulta do catabolismo do glicogénio seja
transformado em glucose-6-fosfato, pelo que é necessário mudar a posição do fosfato.
A mutase, uma enzima com um resíduo fosforilado, vai catalizar uma reacção
em que a glucose-1-fosfato fica com mais um grupo fosfato, na posição 6, uma forma
instável. A enzima vai depois captar o fosfato da posição 1, uma vez que interessa ter
glucose-6-fosfato. Esta forma-se, então, graças à mutase. A glucose-6-fosfato pode ser
desfosforilada por uma fosfatase, formando glucose. A fosfatase ocorre no fígado,
49
mantendo o nível de glicose no sangue, mas não no músculo ou no cérebro, onde este
açúcar entra logo no metabolismo.
50
Anabolismo do glicogénio
1. Processo global
O glicogénio é um polímero que vai crescendo, aquando da síntese desta
molécula. A síntese consiste na junção sucessiva de unidades de glucose.
Para se juntar à cadeia de glicogénio, a glucose tem de estar activa, na forma de
uridina-difosfato-glucose. A glucose é ligada a uridina-difosfato, sendo esta a forma de
activar da molécula. Isto é semelhante ao que acontece com o ATP, uma forma activa
da ____. O acetil-Coenzima A é a forma activa do acetato e a UDP-glucose é a forma
activa da glucose. Este açúcar entra depois na cadeia e o UDP é libertado.
A glicose-1-fosfato origina glicose-1-fosfato (A glicose), que interage com
UTP, uridina trifosfato, originando UDP-glucose e saindo dois fosfatos. A reacção é
catalizada pela UDP-glucose-pirofosforilase e é reversível. Como o pirofosfato é
facilmente hidrolisado em duas moléculas de Pi, a reacção tem tendência a progredir no
sentido visto. Depois de activada a glucose já é possível juntar as unidades de glucose
formadas, na cadeia de glicogénio. A UDP-glucose é adicionada à cadeia de glicogénio
em crescimento, com n resíduos, ficando o glicogénio com n+1 resíduos e libertando-se
o UDP. Isto só pode ocorrer para cadeias em crescimento com mais de 4 resíduos.
Para constituir um primer de 4 resíduos, é necessária uma proteína, a
glicogenina, que permite a autogliclosilação. Ela permite a formação do conjunto de
quatro unidades de glucose. Só depois do primer estar formado é que se forma a cadeia,
constituída pela acção da fosforilase.
O glicogénio é um polímero ramificado, pelo que têm de se formar os ramos.
Aqui, vão aparecer ligações glicosídicas α-1,6, ramificações, e é uma enzima
ramificadora que permite o seu estabelecimento (das ligações). As ramificações, como
foi visto, têm de ser degradadas de um maneira especial.
2. Balanço energético do anabolismo do glicogénio
A síntese de glicogénio constitui um processo muito eficiente em termos
energéticos, sendo uma óptima fonte de glucose. Ele pode ser digerido ou sintetizado,
de acordo com as necessidades daquele açúcar. A glucose-6-fosfato origina glicose-1fosfato. Esta combina-se com UTP, para formar UDP-glucose e PPi, que é hidrolisado
em 2 Pi. A UDP-glicose mais o glicogénio originam glicogénio com mais um resíduo de
glicose (UDP). O UTP pode ser regenerado pela reacção entre UDP e ATP, que também
origina ADP. Assim:
glucose-6-fosfato + ATP + glicogénion + H2O → glicogénion+1 + ADP + 2 Pi
Na síntese de glicogénio, na união de mais uma glucose, gasta-se 1 ATP. A
oxidação da glucose-6-fosfato origina 31 ATP e o seu armazenamento só requer 1,
sendo portanto, muito eficiente (97%).
51
Regulação do metabolismo do glicogénio
1. Regulação da fosforilase do glicogénio
A fosforólise, que processa a clivagem das ligações α-1,4, é catalizada pela
fosforilase do glicogénio. A fosforilase é a enzima que cliva as unidades de glicose
unidas na cadeia por ligações α-1,4, enquanto na síntese unem-se estas subunidades.
Esta enzima é regulada por ligação covalente, é regulada por modificação
covalente. Na forma desfosforilada, está inactiva, enquanto que, se for fosforilada,
no resíduo de serina, fica activa. A fosforilação é levada a cabo numa reacção
catalisada por uma cinase, e quem fornece o fosfato é uma molécula de ATP. Há uma
hormona, a epinefrina, que regula este processo, levando à activação da fosforilase do
glicogénio.
Esta enzima também é regulada por outro mecanismo, o halosterismo, que
processa mudanças de estrutura (em todos os mecanismos estudados, o halosterismo e a
ligação covalente são os dois modos de regulação). Há reguladores positivos e
negativos, os primeiros dos quais levam a uma passagem de uma forma T, tensa, para
uma forma R, inactiva. O AMP é um reguldos positivo, no músculo, enquanto o ATP e
a glucose-6-fosfato são reguladores negativos. A glucose desactiva a fosforilase, que
passa de T a R (R a T), no fígado.
No caso em que há os dois mecanismos reguladores, a enzima fica plenamente
activa.
A enzima tem um local de ligação do piridoxalfosfato, um local de ligação de
AMP, um local de fosforilação (outro local de regulação, pois a enzima fica activa se
se ligar fosfato) e um local de ligação de partículas de glicogénio, onde se processa a
extensão desta molécula.
2. Regulação comum do catabolismo e anabolismo do glicogénio
Há uma regulação comum da síntese e da degradação, no metabolismo do
glicogénio. Há uma cascata de fosforilação. A hormona, a epinefrina, envia sinais para
a célula e estimula a adenil ciclase, uma enzima que origina AMP cíclico, formado a
partir de ATP. O AMPc é um segundo mensageiro, que provoca reacções; ele activa as
cinases A, sensíveis a AMP cíclico. Estas enzimas ficam activas, indo catalisar
fosforilações. Elas catalizam a fosforilação de uma proteína que é, também, cinase, a
fosforilase cinase, que catalisa a fosforilação da fosforilase do glicogénio, que fica
activa. Então, há degradação
A fosforilase cinase é sensível a cálcio (Ca2+), um segundo mensageiro, pelo
que, quando ele aparece na célula, vindo de qualquer origem, a fosforilase cinase é
estimulada. O Ca2+ liga-se a uma das 4 subunidades da fosforilase cinase (α, β, γ e δ), a
δ, que é a calmodulina. Quando aparece cálcio, a fosforilase cinase passa de inactiva
para parcialmente inactiva. Se a cinase A ficar activa por acção de AMPc, há
fosforilação da fosforilase cinase, que fica activa.
A glicogénio sintase, quando fica no estado fosforilado, fica inactiva; esta
enzima também é fosforilada, ficando inactiva.
A fosforilase cinase não pode estar sempre activa. Há uma fosfatase que a
inactiva retirando o grupo fosfato; no estado desfosforilado, a fosforilase cinase fica
inactiva. Há várias fosfatases: há fosfatases 1 e 2, e, dentro da 2, há vários tipos. É a
52
fosfatase 1 que vai desfosforilar a fosfatase do glicogénio e a fosfatase cinase,
inactivando-as a ambas. A fosfatase 1, que catalisa a desfosforilação das fosforilases,
também é regulada. Quando aparece epinefrina, estimulando as cinases A, estas vão
catalizar a fosforilação de proteínas e, nessas reacções, uma subunidade da fosfatase 1 é
fosforilada. Quando a fosfatase é fosforilada, esta subunidade vai ficar inactiva.
Verifica-se ainda que há a fosforilação de um inibidor, que ainda inibe mais a fosfatase
1. Estando esta inibida, a fosfatase do glicogénio está activa.
A libertação da hormona implica que a fosforilase do glicogénio trabalhe à
vontade.
O glicogénio é importante pois regula o nível de glucose no sangue. Não
havendo glucose no sangue, ele tem de ir buscá-la ao glicogénio (ela é necessária para o
cérebro, por exemplo); se houver muita glucose, ela é armazenada no polímero em
causa. Isto pode ser visto numa experiência simples. Se se adicionar glucose, não é
necessário degradar glicogénio, pelo que a fosforilase do glicogénio perde actividade.
Com o decréscimo do nível de glucose, a actividade de síntese diminui, ficando a
fosforilase do glicogénio activa.
53
Capítulo 4: Metabolismo das gorduras
Os ácidos gordos são longas cadeias hidrocarbonadas que terminam num
grupo carboxilo. São lípidos mais ou menos complexos que fazem parte da estrutura
dos fosfolípidos e glicolípidos. Os fosfolípidos constituem (não exclusivamente) a
membrana, mas há outros lípidos. Os ácidos gordos modificam ainda proteínas após
ligação covalente.
Os ácidos gordos são moléculas combustíveis e podem funcionar como
hromonas e segundos mensageiros (os primeiros mensageiros fazem a comunicação
entre células, enquanto os segundos fazem a comunicação dentro das células), sendo
importantes na transdução de sinais, quer entre as células, quer dentro das células. São,
portanto, importantes a nível celular, tendo todas estas funções. Vão analisar-se a
função de combustão.
Estas moléculas podem ser armazenadas sob a forma de triglicerídeos ou
gorduras neutras (os triglicerídeos são gorduras neutras). Os primeiros têm um grupo
glicerol, com três carbonos esterificados por ácidos gordos. O glicerol é um álcool, e
um composto deste tipo e um ácido formam um éster. Os triglicerídeos não são
carregados.
Os ácidos gordos são importantes em termos energéticos. Contêm muita energia,
pois são muito reduzidos, podendo libertar mais energia, pois podem ser mais
oxidados. São moléculas anidras. Se se metabolizarem os ácidos gordos, na completa
oxidação libertam-se 9 kcal/g. Os hidratos de carbono e as proteínas libertam 4 kcal/g.
O catabolismo (metabolismo) dos ácidos gordos dá-se na mitocôndria, pelo que
eles são activando antes de lá entrarem. Estes compostos são oxidados dentro da matriz
desse organito. As formas de armazenamento processam-se no tecido adiposo, sendo aí
que se dá a síntese e o armazenamente de ácidos gordos.
Os ácidos gordos, como foi referido, têm longas cadeias hidrocarbonadas, em
que o número de carbonos é variável. O ácido α-laurico tem 12 carbonos, mas outros
compostos têm outra quantidade de carbonos. O ácido palmitoleico tem 16 carbonos,
designando-se de hexadecenóico. Se tiverem 18 carbonos, por exemplo, são
octadecanóicos. Se, para além disso, tiverem uma dupla ligação são octadecenóicos;
se tiverem duas são octadecadienóicos; se tiverem três designam-se
octadecatrienóicos. O carbono distal é o ω e é este o carbono metílico. O carbono 1
é o do grupo ácido. Há duas formas de localizar as duplas ligações. Contanto a partir
do carbono carboxílico, se a ligação for entre os carbonos 9 e 10, o ácido gordo designase de Δ9. Também se podem designar as ligações contando a partir do carbono ω. Por
exemplo, neste caso, designar-se-ía de ω-3. O ácido palmitoleico, com 16 carbonos, é
Δ9, tendo uma dupla ligação entre os carbonos 9 e 10. Nas moléculas biológicas, os
ácidos gordos têm número par de carbonos e, geralmente, a configuração é cis. As
propriedades físicas dos ácidos gordos dependem do grau de saturação e do tamanho
da cadeia. Cadeias curtas e insaturadas são mais fluidas.
54
Catabolismo das gorduras
1. Degradação dos triglicerídeos
No metabolismo dos ácidos gordos, os triglicerídeos são ser hidrolisados numa
reacção catalisada por lipases.
Há hormonas que enviam sinais para as células. A hormona chega à célula,
activa o receptor e envia o sinal para a adenil ciclase, que sintetiza AMP cíclico. Esta
via activa as cinases A, que vão fosforilar a lipase, estimulando-a. Os sinais enviados
vão promover a síntese de AMP cíclico, que vai estimular certas cinases, cinases A, que
vão estimular as lipases, pois vão promover a sua fosforilação. A hidrólise dos
triglicerídeos origina glicerol e os ácidos gordos, e ambos vão ser utilizados em termos
metabólicos. Ambos vão ser catabolizados, aproveitados. Primeiro remove-se um ácido
gordo, depois o outro e, por fim, o terceiro, ficando o glicerol.
2. Degradação do glicerol
O glicerol vai ser fosforilado, por acção de uma glicerol cinase, formando-se o
glicerol-3-fosfato. Depois há uma oxidação, catalizada por uma desidrogenase, a
glicerol-fosfato-desidrogenase, que origina dihidroxiacetona-fosfato. Esta pode ser
isomerizada e formar gliceraldeído-3-fosfato. Se for necessária energia, este segue a
glicólise; se não for, segue para a gluconeogénese.
3. β-oxidação de ácidos gordos
3.1. Estudo inicial da degradação de ácidos gordos
Sabe-se que a degradação, ou oxidação, de ácidos gordos envolve a perda de
unidades de dois carbonos, isto é, o catabolismo dos ácidos gordos envolve a perda
sequencial de unidades de dois carbonos.
Isto é conhecido desde 1904 e foi descoberto por Knoop. Ele usou um marcador
químico, antes de se usarem os marcadores radioactivos, utilizados posteriormente. O
marcador tinha um grupo fenil; ele adicionou o grupo fenil a ácidos gordos e deu a cães
fenil-proprionato. Verificou que, na urina, aparecia benzoato, uma molécula com o
grupo fenil. Para além disso, apenas se libertavam dois carbonos. O investigador
concluiu que o fenilpropionato foi quebrado e foram removidas unidades de dois
carbonos. Na urina ficou também o benzoato. Quando alimentou os cães com
fenilbutirato, apareceu fenilacetato _______ e dois carbonos.
3.2. Transporte para o interior da mitocôndria
A β-oxidação, o catabolismo, dos ácidos gordos ocorre na mitocôndria. Para
eles irem para lá, tem de haver activação destas moléculas, que se dá na membrana
externa. A activação faz-se segundo a reacção global.:
55
+ ATP + HS–CoA
+AMP + Pi
A activação necessita de ATP e acetil-Coenzima A. Os ácidos gordos ficam na
forma activa, de acil-Coenzima A, sendo a reacção catalisada pela acil-Coenzima Asintetase. O ácido gordo, mais o ATP, originam o acil-adenilato. O grupo carboxílico
____ ao grupo adenil do ATP. O acil-adenilato, na segunda fase, reage com HSCoenzima A, formando-se acil-Coenzima A e AMP. No início tinha-se ATP e resta
AMP, libertando-se, na segunda fase, pirofosfato. O ATP tem três grupos fosfato e,
por perda de duas ligações, forma-se AMP e pirofosfato. Consumiram-se duas ligações
de alta energia e só se formou uma, a tioéster, no grupo sulfifril.
A acil-Coenzima A tem de ir para dentro da mitocôndria, para lá da (para a)
membrana interna, mas não pode entrar directamente, sendo necessária uma molécula
chamada carnitina. O acil-Coenzima A e a carnitina formam acil-carnitina, que pode
ser transportado através da membrana interna da mitocôndria. Na transferência do grupo
acil para a carnitina participa a enzima acil-carnitina-transferase I. O grupo acil vai
ser transportado para o grupo OH da carnitina e a ligação O–grupo acil tem alto
potencial de transferência, pelo que, quando a acil-carnitina entra na miotocôndria,
pode formar-se de novo acil-Coenzima A. A acil-carnitina pode atravessar a membrana
pois existe um transportador, uma translocase. A enzima acil-carnitina-transferase II
transporta o grupo acil para a Coenzima A, restando a carnitina e formando-se acilCoenzima A.
3.3. Processo global
Na mitocôndria ocorrem quatro reacções e, para cada ciclo de quatro reacções,
são libertadas unidades de dois carbonos na forma de acetil-Coenzima A.
Nas reacções de β-oxidação há, ao início, uma reacção de oxidação, na qual o
acil-Coenzima A é oxidado a trans Δ2 enuil-Coenzima A, pela acil-Coenzima A
desidrogenase. É o FAD+ que recebe os electrões, passado a FADH2. O ΔG é
suficiente para haver redução do FAD+, mas não do NAD+. Depois há uma reacção de
hidratação, uma adição de moléculas de água, em que o trans Δ2 enuil-Coenzima A
passa a L-3, hidroxiacilCoenzima A, por acção de uma hidratase. É uma reacção
esteroespecífica, formando-se apenas um isómero. A mais uma reacção de oxidação,
catalisada por uma desidrogenase, aparecendo cetoacil-Coenzima A. A ultima reacção
é uma tiólise, catalisada por uma cetoliase. Há libertação de acetil-Coenzima A,
ficando o resto da cadeia encurtada por dois carbonos. No fim de cada ciclo de βoxidação, a cadeia é encurtada em unidades de dois carbonos. O ácido gordo é
degradado.
O acetil-Coenzima A dá enuil-Coenzima A, que origina hidroxiacil-Coenzima
A, que, por sua vez, dá cetoacil-Coenzima A. O conjunto de reacções consiste numa
oxidação, uma hidratação e outra oxidação. Também no ciclo de Krebs, o succinato é
oxidado a fumarato, que é hidratado a malato, que é oxidado a oxaloacetato. Reacções
de oxidação intercaladas com hidratações são típicas do catabolismo.
Em cada ciclo, isto é, com a repetição do ciclo, a cadeia vai sendo encurtada. Se
o ácido gordo tiver uma cadeia longa, participa (há) uma desidrogenase da longa cadeia,
a long-chain acil-Coenzima A dsidrogenase. Há desidrogenase de cadeia média e
desidrogenase de cadeia curta, também.
56
3.4. Análise das reacções
a) Oxidação acil-Coenzima A a trans Δ2 enuil Coenzima A
A primeira reacção é, então, uma reacção de oxidação, catalizada pela acilCoenzima A desidrogenase. O FAD+ recebe os electrões tornando-se FADH2 e o acilCoenzima A é convertido em trans Δ2 enuil Coenzima A.
O acil-Coenzima A vai transferir os electrões para o FAD+, que se torna FADH2,
e este transfere-os para outra proteína, também com FAD+, ______, uma proteína
transportadora d electrões. Mais uma vez, o FAD passa a FADH2. Os electrões são
então transportados para outra enzima, uma reputase, com ferro, que fica na forma
reduzida, e são depois lançados à ubiquinona, passando esta a ubiquinal, reduzido.
Este composto também existe na cadeia respiratória. Assim, logo na primeira reacção,
há fornecimento de electrões à cadeia respiratória. Logo nesta reacção, já há
conservação de energia.
b) Hidratação do trans Δ2 enuil Coenzima A a L-3 hidroxiacil-Coenzima A
O trans Δ2 enuil Coenzima A é hidratado, formando-se L-3 hidroxiacilCoenzima A. Forma-se L pois só se formaria D se a hidratação fosse numa ligação cis.
A hidratação dá-se numa dupla ligação trans, que só pode formar o estereoisómero L.
c) Oxidação do L-3 hidroxiacil-Coenzima A a cetoacil-Coenzima A
A terceira reacção é de oxidação. O L-3 hidroxiacil-Coenzima A vai ser
oxidado, passando o NAD+ a NADH e formando-se o cetoacil-Coenzima A.
d) Tiólise e libertação de acetil-Coenzima A
Na clivagem há uma tiólise em que se libertam os dois carbonos na forma de
acetil-Coenzima A. O cetoacil-Coenzima A requer mais uma Coenzima A. Fica um
acil-Coenzima A com menos dois carbonos e este composto que resta vai sofrer um
novo ciclo. Um ácido gordo de grande cadeia vai perdendo unidades de dois carbonos,
com o decorrer dos ciclos sucessivos.
3.5. β-oxidação de ácidos gordos com duplas ligações
A β-oxidação vista é relativa a casos em que os ácidos gordos não têm duplas
ligações.
Quando um ácido gordo tem uma ligação dupla ou um número ímpar de
ligações, a situação é diferente. Quando o ácido palmitoleico é Δ9, tem uma ligação
dupla de 9 para 10. Primeiro há ciclos sucessivos até à ligação e, quando se atinge essa
zona, forma-se Δ3 enuil-Coenzima A. Ao aparecer este produto, ele não é reconhecido
pelas enzimas da β-oxidação. A desidrogenase não reconhece este produto e há que
transformá-lo em Δ2 enuil-Coenzima A. Isto consegue-se por uma isomerase. Quando
existe uma dupla ligação ou um número ímpar destas ligações, o problema é resolvido
por uma isomerase. O Δ2 enuil-Coenzima A já é um substrato usado na β-oxidação dos
ácidos gordos.
Quando há duas ligações duplas, ou um número par destas ligações, a situação
é diferente. No ácido _____________, com duas ligações duplas ____, o processo é
57
igual até aparecer o Δ9, isto é, (, mas) ocorre o mesmo que no caso anterior. Quando se
atinge o Δ12, Δ4, na cadeia agora diminuída, o processo é diferente. Dá-se origem a 2,4dienuil-Coenzima A, que também não é reconhecido pelas enzimas do ciclo normal da
β-oxidação, tendo, portanto, de sofrer uma transformação. O 2,4-dienuil-Coenzima A
vai ser reduzido, captando electrões cedidos por NADPH, e passa a cis Δ3-enuilCoenzima A. Este composto também não é reconhecido, ____ ____ isomerase, passa a
trans Δ2-enuil-Coenzima A, que já pode entrar no sistema de β-oxidação.
Quando há duas duplas ligações, formam-se dois produtos que não são
reconhecidos. Quando o número de ligações é ímpar, o problema resolve-se com a
isomerização. Quando o número é par, é necessária uma isomerização e uma
__________.
3.6. Terminação e destino dos produtos
Quando um ácido gordo de cadeia longa é sucessivamente encurtado, vão saindo
unidades de dois carbonos. Se o número de carbonos for par, no final aparecem duas
moléculas de acetil-Coenzima A. Se o número de carbonos for ímpar, aparece uma
molécula de acetil-Coenzima A e fica parte da molécula encurtada, uma molécula de
propionil-Coenzima A.
Se a célula não precisar de energia, a acetil-Coenzima A é usada para formar
ácidos gordos; se for necessária energia, o composto vai para o ciclo de Krebs. O
propionil-Coenzima A vai ser carboxilado originando D-metilmalonil-Coenzima A, e
uma epimerase origina L-metilmalonil-Coenzima A a partir daquele composto. Por
uma mutase, que muda a posição dos grupos, ele origina succinil-Coenzima A, que
também é um intermediário do ciclo de Krebs.
3.7. Formação de corpos cetónicos
A formação de corpos cetónicos que ocorre no fígado também é importante.
Quando predomina o catabolismo das gorduras, formam-se grandes quantidades de
acetil-Coenzima A, pelo que se podem formar corpos cetónicos.
Duas acetil-Coenzima A, por acção de uma tiolase, formam
________________. Uma sintetase forma hidroximetilglutaril-Coenzima A e libertase uma molécula de Coenzima A. A glutaril-Coenzima A vai ser clivada numa reacção
catalisada por uma enzima de clivagem, formando-se acetoacetato, que constitui os
corpos cetónicos. O acetoacetato pode ser reduzido na matriz da mitocôndria, estando
envolvido o NADH, que passa a NAD+, e pode também ser carboxilado. O acetato, a
acetona e outros são corpos cetónicos.
Os corpos cetónicos são muito importante em termos metabólicos. O
acetoacetato formado é muito importante no metabolismo, podendo ser usado como
combustível. É importante pois é transportado na corrente sanguínea. O acetoacetato
difunde-se da mitocôndria para o citoplasma e é lançado na corrente sanguínea, e por
isso são importantes os corpos cetónicos. O acetoacetato, numa reacção catalisada por
uma
transferase,
passa
a
____________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
58
______________________________________________________________________
______________________________________________________________________.
O acetoacetil que foi formado pode ser metabolizado pela célula, originando
acetil-Coenzima A, que pode entrar no ciclo de Krebs. Quando o metabolismo das
gorduras é predominante, formam-se corpos cetónicos, forma-se acetoacetato, que pode
ser usado na forma de acetil-Coenzima A.
O músculo cardíaco e o córtex renal preferem metabolizar o acetoacetato. O
cérebro e os eritrócitos preferem glucose aos corpos cetónicos, em condições de dieta
normal. Se não houver glucose, o cérebro pode também ir buscar os corpos cetónicos,
que são, portanto, usados em condições de fome. 75% do combustível utilizado no
cérebro é acetoacetato.
3.8. Interacção entre o metabolismo das gorduras e o metabolismo dos
açúcares
Quando predomina o catabolismo dos ácidos gordos, formam-se corpos
cetónicos, enquanto que, quando o metabolismo dos ácidos gordos e dos açúcares é
equilibrado, o acetil-Coenzima A entra no ciclo de Krebs, condensando-se com
oxaloacetato e originando citrato. É necessário que haja oxaloacetato para se
condensar com o acetil-Coenzima A. Os intermediários do ciclo de Krebs são repostos
por reacções anepleróticas, e o piruvato origina oxaloacetato, nestas reacções. É
necessário, portanto, que haja piruvato, resultante do metabolismo dos hidratos de
carbono. “As gorduras são queimadas na chama dos hidratos de carbono”.
3.9. Balanço energético
_______:
Cn–acil-CoA + FAD+ + NAD+ + H2O + CoA → Cn-2–acilCoA + FADH2 +
NADH + acetilCoA + H+
No exemplo do palmitoil-Coenzima A (C16–acil-CoA) há 7 ciclos.
Palmitoil-CoA + 7 FAD+ + 7 NAD+ + 7 CoA + 7 H2O → 8 acetilCoA + 7
FADH2 + 7 NADH + 7 H+
Cada NADH dá 2,5 ATP’s; multiplicando por 7, originam-se, então, 17,5
ATP’s. Cada FADH2 dá 1,5 ATP’s, multiplicando dá 10,5 ATP. Cada acetilCoenzima A, no ciclo de Krebs, dá 10 ATP’s; multiplicando por 8 dá 80 ATP’s. No
total, formam-se 108 ATP’s. Como foram gastas duas ligações (reacções) ricas em
energia, para activar, o rendimento net será 106 ATP’s. Catabolizando as gorduras, há
um total net de 106 ATP’s. Os hidratos de carbono têm um rendimento energético
próximo de 30, pelo que o rendimento energético das gorduras é maior.
59
Anabolismo dos ácidos gordos
1. Processo global
Na síntese de ácidos gordos, todos os intermediários são transportados por uma
proteína, ACP, transportadora de grupos acil, enquanto que, na degradação, o
transportador era a Coenzima A. Em ambos os processo estão envolvidas unidades de
dois carbonos, embora na degradação esteja envolvido o acetil, e na síntese o malonil.
Na síntese participa o NADPH, enquanto na degradação participa o NAD+ e o FAD+.
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________.
2. Análise das reacções
2.1. Primeiro ciclo
a) Carboxilação de acetil-Coenzima A a malonil-Coenzima A
Para sintetizar ácidos gordos parte-se de acetil-Coenzima A. Na degradação
produz-se acetil-Coenzima A. Primeiro, é necessário carboxilar esse composto, numa
reacção catalisada pela acetil-Coenzima A carboxilase, um processo que requer ATP.
Produz-se malonil, que é o dador de carbonos ao ácido gordo; é ele que leva ao
alongamento. A reacção de carboxilação do acetil-Coenzima A (malonil) foi estudada
em pormenor e verifica-se que inclui duas etapas e requer bicarbonato (HCO3-). Este
composto é necessário à síntese dos ácidos gordos.
A primeira fase da reacção de carboxilação do acetil-Coenzima A envolve
biotina, associada à enzima. Nesta, a fase que consome energia, há carboxilação da
biotina, formando-se carboxibiotina.
Depois há uma reacção de “ping-pong”, que está ligada à biotina. O ATP e o
HCO3- são os substratos que se ligam à enzima, forma-se a carboxibiotina e libertam-se
os produtos, ADP e Pi. Só depois se liga o acetil-Coenzima A. A carboxibiotina passa
um CO2, formando-se malonil-Coenzima A. É uma reacção do tipo “ping-pong” pois
libertam-se produtos antes de todos os substratos serem utilizados. A molécula de
biotina tem uma flexibilidade que permite transportar os grupos para os locais
indicados.
b) Condensação de acetil-Coenzima A-ACP com malonil-ACP
O malonil-Coenzima A é o dador dos carbonos. A proteína ACP é semelhante à
Coenzima A (acetil-Coenzima A), mas tem um grupo _________ ligado. O grupo tem
SH terminal, o grupo reactivo, onde se ligam os intermediários da síntese de ácidos
gordos. Há também um grupo de fosfopantetaína. A função da Coenzima A e do ACD
é a mesma: transportar os intermediários.
Não se podem unir duas moléculas de acetil-Coenzima A-ACP. Uma tem de ser
condensada com uma de malonil-ACP. Há uma reacção entre acetil e malonil,
formando-se acetoacetato. Liberta-se CO2, aquele que entrou na formação do malonil,
60
que exigia bicarbonato e resulta da carboxilação do acetil. Todos os carbonos que ficam
nos ácidos gordos são derivados de acetil-Coenzima A. Depois, o acetoacetil-ACP é
convertido em hidroxibutiril-ACP, numa reacção de redução na qual os electrões vêm
de NADPH. O hidroxibutiril-ACP sofre uma reacção de desidratação, passando a
protonil-ACP (protonil) e saindo água. Aquele é reduzido a butiril-ACP, vindo os
electrões, mais uma vez, de NADPH.
Por repetição deste conjunto de reacções repetem-se ciclos que originam os
ácidos gordos.
As
moléculas
de
acetil-Coenzima
A
não
se
podem
usar
porque_________________________________________________________________
______________________________________________________________________
______________________________________________________________________.
Tudo está ligado a ACP. Em cada ciclo repetem-se as reacções e vão-se
adicionando unidades de dois carbonos, alongando-se a cadeia.
2.2. Repetição do ciclo
Numa segunda volta, o segundo ciclo, o butiril-ACP e o malonil-ACP originam
C6-β-cetoacil-ACP. Este, após redução, uma desidratação e uma redução origina C6acil-ACP. Uma terceira volta leva à continuação.
Na síntese de palmitato, 7 malonil-Coenzima A e acetil-Coenzima A mais
___________________________________
originam
palmitato
e
______________________________________________________________________.
Como a síntese de malonil vem:
A reacção global é:
2.3. Funcionamento da sintase de ácidos gordos
A sintase de ácidos gordos é um dímero com três domínios. No domínio 1 há
uma transacilase, a malonil transacilase, que liga malonil-Coenzima A a ACP, e a
enzima de condensação. No domínio 2 _________________________________ está a
desidratase, a enuil reductase, que catalisa a segunda redução. No domínio 3 está a
tioesterase. No domínio 2 estão ainda as restantes enzimas de cada volta (, portanto). É
também uma cadeia deste domínio que confere flexibilidade, passando a cadeia de
ácidos gordos de uma subunidade para a outra. Graças a esta flexibilidade a cadeia
passa de um lado para o outro.
O acetil, depois de ter sido ligado ao ACP, deixa-o e liga-se à enzima de
condensação. Depois, o dador é o malonil ligado a ACP. No início do alongamento, o
acetil condensa-se com o malonil, ficando estes ligados (ficando ligado) a ACP e a
enzima de condensação livre. A ____ ____ da enzima de condensação liga-se à porção
de dois carbonos do malonil em ACP, formando-se acetoacetatil, com libertação de
CO2. O acetoacetil é reduzido a butil, ainda ligado a ACP, e há, depois, uma
translocação desse composto para a proteína. De seguida, o ACP liga-se, de novo, a
malonil.
61
Isto passa-se sucessivamente. Mais cinco voltas produzem o ácido palmítico,
com 16 carbonos. O palmitoil fica na enzima de condensação, depois passa a ácido
palmítico, e _________ leva à libertação desse composto.
Ambas as unidades do dímero contribuem para a síntese do ácido gordo, que
anda de um lado para o outro.
2.4. Introdução de ligações duplas e formação de ácidos gordos mais longos
A introdução de ligações duplas e a formação de (/) ácidos gordos mais longos
do que o ácido palmítico são realizadas por uma enzima do retículo endoplasmático,
que também tem uma cadeia de transporte de electrões.
A introdução de ligações duplas forma lípidos insaturados.________________
______________________________________________________________________
______________________________________________________________________.
O ______-Coenzima A, mais o NADH, mais H+, mais O2, formam oleilCoenzima A, NAD+ e 2 H2O. O ácido esteárico tem 18 carbonos. O oleato pode ser
alongado para 20 carbonos, com uma ligação dupla Δ11, ou ter 18 carbonos, com duas
ligações
duplas,
Δ6
e
Δ9.
O
palmitato
e
o
palmitolato_________________________________
______________________________________________________________________
______________________________________________________________________.
O linoleato (C18:2) e o linolenato (C18:3) são essenciais, mas não são
sintetizados no organismo, tendo de ser introduzidos na dieta.
Os ácidos gordos insaturados podem ter como precursores o palmitoleato
(16:2), o oleato (18:1), o linol______________________________________________
______________________________________________________________________.
Contanto os carbonos, conhece-se os percurso.
3. Transporte de acetil-Coenzima A
O acetil-Coenzima A pode resultar da degradação dos ácidos gordos, mas pode
também resultar do catabolismo dos hidratos de carbono, pois o piruvato pode originar
acetil-Coenzima A. Ambos os processos ocorrem na mitocôndria, pelo que é lá que o
acetil-Coenzima A surge. No entanto, a síntese de ácidos gordos dá-se no citosol, pelo
que o acetil-Coenzima A tem de ir para lá, mas não pode passar directamente. Pode
condensar-se com oxaloacetato, formando citrato, na primeira reacção do ciclo de
Krebs.
O citrato, caso seja necessária energia, continua no ciclo de Krebs; se não for,
este composto vai para o citosol. Aí divide-se em acetil-Coenzima A e oxaloacetato, que
pode ser reduzido a malato, que pode ser descarboxilado a piruvato, numa reacção
que forma NADPH. Este é importante no anabolismo dos ácidos gordos e é também
formado na via das pentoses. A passagem de oxaloacetato a piruvato é uma reacção
aneplerótica.
O piruvato pode voltar à mitocôndria e formar oxaloacetato numa carboxilação,
catalisada por uma carboxilase. Nada se perde: o acetil-Coenzima A passa para o
citossol e o oxaloacetato volta a formar-se.
62
4. Regulação do anabolismo dos ácidos gordos
A enzima-chave na regulação do metabolismo dos ácidos gordos é a acetilCoenzima A carboxilase, que transforma, como foi referido, acetil-Coenszima A em
malonil-Coenzima A, o dador de unidades de dois carbonos aos ácidos gordos. Há
reguladores desta enzima que são directos e outros com acção indirecta.
Há mecanismos de fosforilação e mecanismos halostéricos. Quando a enzima
está no estado fosforilado, está inactiva; quando está desfosforilada, está activa. Se
estiver no estado fosforilado mas tiver um regulador halostérico, fica parcialmente
activa.
Se houver AMP na célula, ele activa uma cinase, pondo a enzima no estado
fosforilado, ficando inactiva. Se surgirem na célula epinefrina ou glucágono, há
estimulação da adenil ciclase, formando-se AMPc, que estimula a cinase A. Esta vai
fosforilar uma fosfatase, que fica inibida, e a carboxilase mantém-se no estado
fosforilado, inactiva. A acção estimuladora do citrato interage com o estado fosforilado.
Este composto estimula, mas mais se a enzima estiver desfosforilada. O citrato tem uma
acção directa, sendo um regulador halostérico positivo. A insulina activa a fosfatse que,
por sua vez, desfosforila a carboxilase.
5. Funções dos ácidos gordos
Os ácidos gordos têm várias funções. São combustíveis, podem regular a
actividade de proteínas, ligando-se a elas, e podem funcionar como mensageiros. O
ácido araquidónico é um exemplo de um ácido gordo que pode funcionar como
mensageiro, como regulador celular, e os seus derivados também têm esta acção.
Os ácidos gordos não têm junção apenas como combustíveis, mas também
outras funções importantíssimas.
63
Capítulo 5: Catabolismo dos aminoácidos
Remoção do ião amónio
1. Processo global
O primeiro passo na degradação dos aminoácidos é a remoção do αaminogrupo. Este é removido dos aminoácidos, forma-se um ião amónio, que é
excretado, entrando no ciclo da ureia e sendo excretado na urina. A primeira coisa que
acontece é a remoção do grupo amínico, que é transformado em ião amónio, que depois
é excretado. Para formar o ião amínico há uma desaminação oxidativa.
Os α-aminogrupos são removidos por reacções de transaminação. Nessas
reacções há transferência de α-aminogrupos para outros aminoácidos, geralmente o αcetoglurato, formando-se α-cetoácido, sem grupo amínico, e o glutamato. Esta é uma
reacção de transmainação. O aspartato e o α-cetoglurato formam oxaloacetato e
glutamato. Nas reacções de transaminação entram sempre α-cetoglurato e glutamato.
Para a alanina, o grupo amínico é transferido para α-cetoglurato (α-cetoglumato),
formando-se piruvato e glutamato.
Assim, resumindo, a aminotransferase transfere o grupo amínico dos
aminoácidos para o glutamato. Este perde o grupo NH4+, por uma desaminaçãqo
oxidativa, catalisada pela glutamato desidrogenase, formando-se, de novo, αcetoglurato. Aquela enzima é uma enzima importante na regulação deste metabolismo,
tendo ATP e GTP como inibidores halostéricos, e ADP e GDP como activadores
halostéricos. Deste modo, o abaixamento da carga energética acelera o catabolismo dos
aminoácidos.
Em termos globais, o α-aminoácido forma α-cetoglurato e liberta o ião NH4+.
2. Análise das reacções
a) Reacção de transaminação
Na reacção de transaminação participa o piridoxalfosfato (PLP), que também
participa no metabolismo do glicogénio e que, no decurso da reacção, se transforma em
piridoxaminafosfato (PMD). O piridoxalfosfato é um grupo prostético da enzima e, na
sua ligasão a esta mesma enzima, através do ε-aminogrupo, forma uma aldimina
interna. Quando aparece o aminoácido, o piridoxalfosfato vai-se ligar ao α-aminogrupo
deste composto, ficando a enzima com o ε-aminogrupo livre. A aldimina externa vai ser
desprotonada, formando-se um intermediário quinonoil, e há uma reprotonação,
formando-se uma ____, que, por hidrólise, perde um α-cetoácido e o
piridoxaminafosfato. Esta é a primeira fase da reacção de transaminação.
Somando, um aminoácido 1 e o α-cetoácido 2, α-cetoglutarato, formam um
aminoácido 2, glutamato, e um α-cetoácido 1.
64
b) Reacção de desaminação
O primeiro passo é, então, a remoção do grupo amínico. Este fica no
glutamato, e é, depois, removido, formando-se α-cetoácido.
Há desaminação directa. A serina, por desidratação, forma aminooilato,
instável, que perde um grupo amínico, formando piruvato. E treonina é outro
aminoácido que pode ser desaminado directamente, formando α-cetobutirato e NH4+.
O ião amónio é tóxico e é sempre excretado. Tem de ser transformado para sair
do organismo, e fá-lo sob a forma de ureia.
65
Ciclo da ureia
1. Processo global
Como foi já referido, no catabolismo dos aminoácidos, a primeira coisa que
ocorre é a remoção do grupo amínico, que se converte no ião amiónio, que tem de ser
removido. Ele tem de entrar no ciclo da ureia, muito importante no metabolismo. Este
foi o primeiro ciclo a ser descoberto.
A arginina, por hidrólise catalisada pela ____, origina ornitina. Sai o ião
amónio, que vai para a ureia, excretada na urina. A ornitina transcarbamoilase
converte a ornitina em citrulina, entrando, nessa reacção, carbamoilfosfato. A
citrulina, numa reacção de condensação, com aspartato, forma argininosuccinato, e,
depois, pela arginina succinase, sai fumarato, originando-se arginina.
2. Produtos de excreção no Reino Animal
Os organismos ureotélicos são aqueles que excretam o amónio sob a forma de
ureia (é este composto que é excretado). São eles os Vertebrados terrestres. Nos
animais uricotélicos, o amónio é convertido em ácido úrico, que é excretado. Isto
ocorre em Aves e Répteis terrestres. Os animais amonotélicos, aquáticos, excretam
amónio.
A enguia, que na água excreta o próprio amónio, em situações de seca, quando
está no meio terrestre, adapta o metabolismo e excreta ureia, o que lhe permite não
perder tanta água.
3. Análise das reacções
a) Hidrólise da arginina a ornitina e ureia
A arginina, por hidrólise, origina a ornitina e ureia. A ureia sintetizada tem
dois azotos: um vem do aspartato e o outro do ião amónio, que está a ser excretado. O
átomo de carbono vem do CO2, que entra na formação do carbamoilfosfato.
b) Transferência do grupo carbamoil para a ornitina e formação de
citrulina
A ornitina transcarbamoilase transfere o grupo carbamoil para a ornitina,
formando-se citrulina. O carbamoilfosfato forma-se na seguinte reacção:
CO2 + NH4+ + 2 ATP + H2O →
+ 2 ADP + Pi + 3 H+
carbamoilfosfato
A reacção é catalisada pela carbamoilfosfato sintase, regulada pelo glutamato.
66
c) Condensação da
argininosuccinato
citrulina
com
o
aspartato
e
formação
de
A citrulina condensa-se com aspartato, originando argininosuccinato, numa
reacção catalisada pela argininosuccinato sintase, em que há necessidade de consumo
de energia. O ATP é convertido em AMP e PPi que, por hidrólise, origina dois Pi.
d) Conversão da argininosuccinato em arginina e fumarato
A arginina succinase converte o argininosuccinato em arginina e fumarato,
que participa também no ciclo de Krebs. Ele origina malato, que, por sua vez, forma
oxaloacetato. Este, numa transaminação, forma aspartato. O oxaloacetato tem vários
destinos metabólicos: no ciclo de Krebs condensa-se com acetil-Coenzima A,
enquanto que, na gluconeogénese, pode ser convertido em glucose. Outro destino é
este. O oxaloacetato participa, assim, a vários níveis. O ciclo de Krebs e o ciclo da
ureia estão ligados.
4. Compartimentação
O ciclo da ureia ocupa dois compartimentos: o citosol e a mitocôndria. A
citrulina forma-se na matriz da mitocôndria e sai para o citosol. A ornitina forma-se
no citosol e entra na mitocôndria. Têm de haver transportadores na membrana da
mitocôndria para transportar estes compostos.
5. Patologias relacionadas com o ciclo da ureia
O ião amónio é tóxico, pelo que os organismos têm de o remover. Se ele não for
excretado, acumula-se e há tendência para a formação de glutamato, a partir de αcetoglutarato, numa reacção reversível. Leva-se também à passagem de glutamato a
glutamina, numa reacção catalizada pela glutamina sintase. A acumulação de
glutamina causa distúrbios cerebrais. A hiperamonémia é o excesso da acumulação de
amónio. Isto pode ocorrer por mau funcionamento das enzimas do ciclo da ureia.
Se a arginina succinase tiver defeitos genéticos, não formação de
argininosuccinato nem de arginina e, portanto, ureia. Fica-se em hiperamonémia. O
tratamento consiste numa dieta pobre em proteínas, com poucos aminoácidos, portanto,
para não haver o seu catabolismo e formar-se ião amónio. O amónio que aparece deve
ser removido. Pode também fornecer-se arginina artificialmente. A argenina fornecida
permite a formação de ureia, mas o ião amónio resultante do catabolismo dos
aminoácidos não é removido nessa altura, servindo apenas para activar o ciclo da ureia.
Há pessoas com deficiência na carbamoil fosfato sintase ou na ornitina
transferase. Essas deficiências levam à formação de produtos tóxicos, glutamato e
glutamina. O tratamento pode consistir em dar ao doente benzoato ou fenilacetato. O
primeiro funde-se com Coenzima A e, depois, liberta-a e funde-se com glicina,
formando-se hipurato, que é excretado. O fenilacetato, da mesma forma, liga-se a
glutamina (glutamato) formando fenilacetilglutamina (fenilacetilglutamato). Estes
doentes não excretam ureia, mas estas substâncias. A dieta também não deve ser rica em
proteínas.
67
Degradação dos esqueletos de carbono
1. Processo global
Depois da primeira fase do catabolismo dos aminoácidos, a remoção do grupo
amínico, resta o esqueleto de carbonos. A estratégia geral do catabolismo do esqueleto
de carbonos que resulta é formar um intermediário principal. Pode ____ piruvato,
acetil-Coenzima A (Coenzima A) ou oxaloacetato, entre outros compostos. Diferentes
grupos de aminoácidos formam diferentes compostos. O catablolismo dos aminoácidos
em geral tem uma estratégia: conforme os aminoácidos, o esqueleto de carbonos, por
uma sequência de reacções, forma intermediários metabólicos principais, que entram
nas vias metabólicas principais. O oxaloacetato, na gluconeogénese, pode sintetizar
glucose, se não for necessária energia. Se a célula precisar de energia, o ciclo de Krebs
funciona no sentido de a produzir; se não precisar, funciona no sentido de formar
glicose. Esta última é uma reacção anabólica.
Os aminoácidos são agrupados em: glucogénicos, que podem contribuir para a
síntese de glucose, ou cetogénicos, que contribuem para o metabolismo dos lípidos
(corpos cetónicos).
2. Aminoácidos C3: formação do piruvato
A alanina, por transaminação, forma piruvato. A serina, por uma
desidratase, forma o mesmo composto. O piruvto também se forma a partir de cisteína,
por diferentes vias em que emerge o enxofre. O triptofano pode originar alanina, a
glicina pode originar serina e a treonina pode formar glicina. Estes são os
aminoácidos C3. Se o organismo necessitar de energia, ela é formada no ciclo de
Krebs. Se não for o caso, forma-se glucose.
3. Aminoácidos C4: formação de oxaloacetato ou fumarato
Os aminoácidos C4, com quatro carbonos, incluem o aspartato e a
asparagina. O aspartato, numa reacção de transaminação, origina oxaloacetato e
glutamato, reagindo com α-cetoglutarato. É um aminoácido glucogénico, pois pode
haver síntese de glucose, ou formação de energia. O aspartato, por transaminação, pode
formar oxaloacetato, ou, no ciclo da ureia, pode formar fumarato. A estratégia é
sempre entrar numa via metabólica princpial. A aspatragina forma aspartato e NH4+.
4. Aminoácidos C5: formação de α-cetoglutarato
Os aminoácidos C5 têm cinco carbonos e incluem a glutamina, a prolina, a
arginina e a histidina. Através de sequências de reacções, formam glutamato, no
catabolismo do seu esqueleto de carbono. O glutamato, por desaminação oxidativa,
forma α-cetoglutarato, e é este o ponto de entrada na via metabólica.
68
5. Aminoácidos não polares: formação de succinil-Coenzima A
Os aminoácidos não polares são a meteonina, a valina e a isoleucina. O seu
catabolismo forma propionil-Coenzima A, isto é, dão origem a propionil-Coenzima A,
num conjunto de reacções. Esse composto também resulta do catabolismo dos ácidos
gordos, sendo o seu destino metabólico o mesmo. Forma-se succinil-Coenzima A, que
é um intermediário principal de uma via principal. O propionil-Coenzima A sofre um
conjunto de reacções que conduzem à formação de succinil-Coenzima A, podendo então
haver entrada nas vias principais do metabolismo.
O propionil-Ceonzima A forma metilmalonil-Coenzima A, que altera entre
formas D-metilmalonil-Coenzima A e L-metilmalonil-Coenzima A. O propionilCoenzima A sofre uma carboxilação, por acção da propionil-Coenzima A carboxilase
e forma D-metilmalonil-Coenzima A, que se equilibra com L-metilmalonil-Coenzima
A. O L-metilmalonil-Coenzima A vai ser convertido em succinil-Coenzima A, numa
reacção catalisada por uma mutase (é convertido por uma mutase em succinilCoenzima A), que catalisa um rearranjo intramolecular. Um grupo de C2 passa para C3,
em troca com o hidrogénio. Esta mutase tem como Coenzima um derivado da vitamina
B12, a Coenzima B12. Para funcionar normalmente, a enzima requer Coenzima-B12,
que se sintetiza a partir de ATP, numa reacção catalisada pela pela transferase. A
vitamina B12, a cobalamina, com cobalto, numa reacção catalisada pela transferase,
origina a Coenzima B12. O carbono 5’ passa a coordenar o cobalto.
Há muitas patologias em que deficiências na injestão de vitamina B12 ou na
formação da Coenzima podem consistir em distúrbios. Quando há distúrbios a este
nível, origina-se uma doença chamada acidúria-metilmalónica. O pH sanguíneo é mais
acídico que o normal e na urina aparece uma grande concentração de metilmalonato. A
doença tem estes sintomas e pode ser causada por deficiências na vitamina B12. De um
modo geral, os animais “superiores” não sintetizam normalmente a vitamina B12, pelo
que tem de ser ingerida. Ela só é sintetizada normalmente por microorganismos. Deve
haver uma alimentação rica em fígado (a principal fonte) ou injecção intramuscular do
composto. A causa desta doença pode estar em ____ da transferase, mas pode haver
também uma deficiência na própria mutase. Estas causas não são resolvidas com
aqueles tratamentos.
6: Leucina: formação de corpos cetónicos
A leucina, por uma transaminação, origina α-cetoisocaproato, e, a partir daí,
este composto forma isovaleril-Coenzima A, por descarboxilação oxidativa. Este
forma β-metilcrotonil-Coenzima A por desidrogenação (oxidação) e, depois, por
carboxilação, forma-se β-metilglutaconil-Coenzima A. Este, por hidratação, forma
3-hidroxil-3-metilglutaril-Coenzima A, que forma acetoacetato por clivagem. O
acetoacetato está implicado na formação de corpos cetónicos.
A leucina é uma aminoácido cetogénico (em oposição aos glucogénicos),
entrando no metabolismo dos lípidos.
69
7: Fenilalanina e tirosina: formação de fumarato e acetoacetato
A fenilalanina forma tirosina, precisando de O2 e de um composto redutante,
tetrahidrobiopterina. Formando tirosina, forma água e dihidrobiopterina que, para
ficar reduzida, no estado redutante, recebe electrões de NADPH.
Após a hidroxilação da fenilalanina, que passa a tirosina, há uma
transaminação, formando-se p-hidroxifenilpiruvato. Este sofre uma hidroxilação por
uma dioxigenase, originando-se homogentisato, que, por clivagem do grupo
aromático por O2, por acção de uma oxidase, forma 4-maleilacetoacetato. Este, por
isomerização, forma 4-fumarilacetoacetato, que sofre uma hidrólise. Formam-se dois
produtos, o fumarato, que entra no ciclo de Krebs, e o acetoacetato, que entra no
metabolismo dos corpos cetónicos.
A fenilalanina e a tirosina são, simultaneamente, glucogénicos e cetogénicos.
No catabolismo da fenilalanina também pode haver doenças. Por deficiência no
catabolismo, a fenilalanina pode acumular-se no organismo. Em condições de excesso
deste aminoácido, forma-se fenilpiruvato, por transaminação da fenilalanina. Isto
pode resultar de um bloqueio na hidroxilação. A acumulação de fenilpiruvato pode
resultar em atraso mental, e o tratamento será uma dieta pobre em fenilalanina.
* Anabolismo dos aminoácidos
Todos os aminoácidos são sintetizados a partir de precursores do ciclo de
Krebs. O anabolismo dos aminoácidos está todo nesse ciclo.
70
Capítulo 6: Fotossíntese
Introdução
1. Processo global
A fotossíntese faz parte do metabolismo dos hidratos de carbono e é um
metabolismo dos organismos autotróficos. O processo global da fotossítnese define-se
por:
luz
6 CO2 + 6 H2O → C6H12O6 + 6 O2
A fotossíntese consiste na produção de matéria orgânica a partir de matéria
inorgânica. A fotossíntese consiste na fixação de CO2 e formação de açúcares,
glicose, com participação de água. È a luz que promove a reacção. Cerca de 1% da
energia luminose que atinge a Terra é absorvida pelos organismos e usada na
fotossíntese. A energia luminosa pode ser convertida em energia química. A energia,
no fim da biossíntese, fica disponível para outros organismos, através da cadeia
alimentar. Em certos casos, há fixação de outras formas inorgâncias, como nitrogénio e
enxofre.
O processo fotossintético é o oposto da respiração. No processo de respiração, a
glicose e o oxigénio originam CO2 e água. Este é um processo que liberta energia, para
produzir trabalho. É um processo exergónico. A fotossíntese é necessariamente
endergónica e a fonte de energia é a fonte luminosa (o Sol ou luz artificial). A reacção
requer energia pois dá-se contra o potencial termodinâmico.
A reacção da fotossítnese não se dá de forma directa. Foi estudada durante
muitos anos e, ainda hoje, o é, revelando-se novos processos.
Há reacções de luz e reacções de escuro.
2. Cloroplastos
Os organismos fotossintéticos têm organitos especializados, os cloroplastos.
Estes apresentam duas membranas, dentro das quais há tilacóides ligados por lamelas.
O líquido que está dentro dos cloroplastos é o estroma.
As reacções de luz ocorrem na membrana dos tilacóides e delas resulta
NADPH e ATP. Esses produtos vão ser usados nas reacções de escuro, que consistem
na síntese de hidratos de carbono, a partir da fixação de CO2. Estas últimas reacções
dão-se no estroma.
71
3. Pigmentos fotossintéticos
3.1. Diversidade dos pigmentos
A energia para o processo endergónico vem do Sol. Para os organismos
utilizarem essa energia têm algo: pigmentos.
Nas moléculas de clorofila há quatro grupos pinólicos, que ligam magnésio, e
uma cadeia hidrofóbica fitil, que ancora a clorofila a proteínas. Este pigmento é
semelhante à hemoglobina, mas tem magnésio em vez de ferro. A absorção da
radiação luminosa deve-se à alternância de ligações duplas e simples que há nos átomos
ligados a magnésio.
As plantas têm outros pigmentos, ficobilinas e β-caroteno, também importantes
na absorção de luz, pois absorvem comprimentos de onda diferentes daqueles que são
absorvidos pela clorofila.
Pode visualizar-se a absorção em espectros de absorção de luz, fáceis de
elaborar a partir de um espectofotómetro. As clorofilas a e b absorvem maximamente
comprimentos de onda diferentes, o que é vantajoso. Há uma zona intermédia em que os
dois não absorvem, mas há picos junto dos 400 e dos 650 nm. A existência de vários
pigmentos, que absorvem maximamente a diferentes comprimentos de onda, é
vantajosa, pois permite aproveitar maximamente vários comprimentos de onda. O βcaroteno e as ficobilinas também contribuem para isto.
3.2. Efeito da luz sobre os pigmentos
A luz, ao insidir sobre uma molécula de pigmento, faz com que fique no estado
excitado, passando um electrão para uma orbita de maior energia. Esse quantum de
energia luminosa que foi absorvido pode ter vários destinos.
O quantum de energia pode ser libertado sob a forma de calor, com o regresso
ao estado inicial, na órbita interior. A energia pode também ser simplesmente perdida. O
electrão que está excitado perde a energia e, sem ela, volta ao estado inicial. Essa
energia pode ser perdida por emissão de luz, fluorescência.
Outro destino é a transferência de energia para uma molécula de pigmento
vizinha. Esta fica excitada, embora não directamente pela luz, mas pela energia
transferida pela molécula vizinha. Essa energia chama-se de excitão e chama-se a isto
uma transferência de energia de ressonância Förster. Este caso já é importante na
fotossíntese. A energia é transferida de umas moléculas de pigmento para outras.
Um outro destino é o desaparecimento do electrão excitado. Há perda de um
electrão fotoexcitado, por parte do pigmento, que fica oxidado. Esse quantum de
energia pode então levar à oxidação do pigmento, e é a oxidação do pigmento que
constitui a fotossíntese. Esse electrão vai implicar as reacções de escuro.
Numa unidade fotossintética, a energia é captada por uma molécula, (que) é
conduzida para moléculas vizinhas, pelo efeito de ____, e, depois, para uma outra
molécula, onde há perda de electrões. É esta oxidação que consittui o início da
fotossíntese.
4. Experiência da queda no vermelho
A experiência da queda no vermelho foi muito importante pois foi ela que
permitiu determinar a necessidade de dois fotossintemas.
72
Os investigadores foram analisar a eficiência fotossintética em função do
comprimento de onda. Quando a luz estava no comprimento de onda onde se iniciava
a zona do vermelho, a fotossítnese caía bruscamente. O fenómeno foi designado de
queda no vermelho. Pensou-se que os pigmentos não absorvessem no vermelho, mas, no
entanto, verificou-se que, na zona do vermelho, os pigmentos absorvem
significativamente. Os investigadores resolveram adicionar uma luz ____ com
comprimento de onda mais curto (680), na parte em que não havia fotossíntese
nenhuma. A adição de duas luzes de diferentes comprimentos de onda já levava a
eficiência fotossintética. Eram necessários dois tipos de luz para não haver queda no
vermelho. Assim se concluiu que havia dois fotossistemas.
5. Fórmula geral da fotossíntese
Nas plantas verdes, o CO2 é reduzido pela água, formando-se O2. Verificou-se
que há bactérias, sulfurosas, que são capazes de reduzir CO2 e constituir compostos
orgânicos, mas o redutor é H2S. Em vez de se libretar O2 (CO2), forma-se enxofre (S).
Baseado nisto, Van Niel propôs uma fórmula geral para a fotossíntese:
luz
CO2 + 2 H2A → (CH2O) + 2 A + H2O
aceitador de
hidrogénio
(aceitador oxidado)
dador de hidrogénio
aceitador reduzido
Dador
desidrogenado
A fotossíntese será estudada relativamente às plantas verdes e, portanto, à água
como redutor de CO2.
6. Clivagem da água pela luz
O CO2 é reduzido por hidrogénio que vem da água, e o oxigénio libertado
também vem desta. A água é dividida pela luz, o O2 liberta-se e o H vai reduzir o CO2.
Para provar que o O2 vinha da água, usou-se água com oxigénio marcado
radioactivamente. Inicialmente poderia pôr-se a hipótesde de que ele vinha do CO2. O
oxigénio libertado estava radioactivo, logo vinha da água, e não do CO2. Foi a primeira
demonstração de que o oxigénio libertado provinha da água.
Noutra experiência, Hill isolou cloroplastos (é possível isolá-los em laboratório)
e iluminou-os. Ele verificou que se produzia oxigénio e que era possível usar outra
substância como aceitador de electrões, tendo usado ferracianida. Não havia CO2, mas
H2O e ferrocianida. Verificou que se formava O2, que vinha, necessariamente, da água.
Esta é mais uma demonstração. Ele conseguiu dissecar a fotossíntese e libertar oxigénio,
a primeira fase da fotossítnese, sem ter reacções de escuro, em que se fixa a matéria
orgânica. Ele provou que era possível dissecar a fotossíntese.
A energia permite levar os electrões contra o potencial termodinâmico.
73
Reacções de luz
1. Processo global
Há dois fotossistemas, o I, P700, e o II, P680, sendo eles excitados pelos
comprimentos de onda correspondentes à numeração. A luz faz clivar a água, que cede
electrões que acabam por ir reduzir NADP+, que origina NADPH.
O fotossistema P680, excitado na zona do vermelho, na forma excitada perde
um electrão. Este desloca-se para potenciais mais negativos, o que é
termodinamicamente desfavorável. O electrão passa à feofitina¸daí à plastoquinona e,
depois, continua num complexo do citocromo bf. Os electrões são recebidos pela
plastocianina, ficando-se ao nível do P700. Este deslocamento dos electrões já é
termodinamicamente favorável, passando de potenciais mais negativos para mais
positivos.
O P680, após perder os electrões, pode receber mais electrões da água, num
mecanismo que usa manganésio. O fotossistema fica, depois, no estado não excitado.
O P700, ao ser excitado pela luz, perde um electrão contra o potencial
termodinâmico. Este vai ser recebido por clorofila a0, depois por a1, e, de seguida, por
proteínas com aglomerados sulfuroferrosos. Depois o electrão passa à ferredoxina, à
flavoproteína e, por fim, ao NADP+, formando-se NADPH.
Os electrões da plastocianina vão para o P700, que fica no estado não excitado.
Forma-se então NADPH e os electrões vêm, em último caso, da água. A água é
clivada por acção da luz. O NADPH, com grande potencial redutor, é utilizado nas
reacções de escuro, a fase seguinte.
Os fotossistemas colaboram um com o outro. O P680 e o P700 estão a colaborar
porque, quando o primeiro é excitado, vai extrair electrões da água, há clivagem da água
e liberta-se O2. Quando é excitado, o P680 torna-se um forte oxidante, extraindo
electrões da água e levando-os para potencias negativos. A plastocianina é um fraco
redutor. O P700 é um fraco oxidante e, após excitação, torna-se um fraco redutor,
que leva à formação de NADPH, um forte redutor. Os electrões, naturalmente, vão de
potenciais mais negativos para mais positivos.
Forma-se outro composto importante, o ATP. Este transporte de electrões está
associado a movimento de protões para dentro do lúmen dos tilacóides, cujo pH desce.
Esse gradiente de protões permite a formação de ATP. Também no cloroplasto, à
semelhança do que acontece na mitocôndria, é possível sintetizar o ATP pelo
mecanismo da teoria quimiosmótica. A formação de ATP, neste caso, designa-se de
fotofosforilação.
2. Análise das reacções
a) Reacções do fotossistema II
Os fotossistemas são complexos com várias proteínas. No caso do fostossistema
II, é nas subunidades D1 e D2 onde se localiza o centro reactivo, que cede electrões.
Elas são ladeadas por proteínas com clorofila e são essas clorofilas que recebem a luz,
que é conduzida para o centro reactivo. O manganésio é extremamente importante para
coordenar a água e permitir a sua oxidação.
74
O P680 é excitado pela luz, perdendo electrões. As quinonas de cada lado do
complexo são reduzidas pela água. Na fotossítense, há clorofilas a, b e carotenóides.
O fotossistema II, P680, catalisa a transferência de electrões (/) da água para a
plastoquinona, por acção da luz.
luz
2 Q + 2 H2O → O2 + 2 QH2
A plastoquinona transfere-os para a plastocianina.
O P680, quando recebe luz, fica excitado. 10 ps após a excitação, um electrão é
logo perdido. Ele vai para a feofitina, sendo perdido e ficando o P680 oxidado. Após
100 ps, o electrão passa para a plastoquinona, o aceitador de electrões, uma quinona,
que está no lado A. A plastoquinona recebe 2 protões e 2 electrões, formando
plastohidroquinona. No lado B está outra quinona, que recebe o electrão do lado A.
(Há ainda outra, e,) Quando esta quinona é reduzida, forma-se QH2, e é nesta forma
que se converte a energia dos electrões. A oxidação da água envolve o transporte de 4
electrões e a utilização de 2 Q’s. Duas molécula de água fornecem 4 electrões, mas cada
um desloca-se independentemente. São necessários dois para se formar QH2, pelo que
cada duas moléculas de água levam à formação de dois QH2.
O electrão que saiu do fotossistema II vai reduzir a quinona e, depois, entra na
cadeia de transporte. Chega à plastocianina, sendo recebido pelo cobre desta proteína.
A plastocianina reduzida vai transferir os electrões para o complexo do fotossistema I.
b) Fotólise da água
Quando o fotossistema II é excitado pela luz, há uma primeira quantisdade de
eneriga a incidir. A perda de um electrão leva a que passe ao estado S1. A sucessiva
perda de electrões por acção dos quanta de energia leva à formação dos estados S2, S3 e
S4 de oxidação. Ao perder um electrão, o fotossistema fica oxidado e apto a ir buscar
um electrão à água, mas, no entanto, para libertar O2, duas moléculas de água têm de
perder 4 electrões. Só quando o fotossistema está no estado S4 vêm os 4 electrões.
O manganésio é importante neste processo. 2 manganésios coordenam 2
moléculas de água.
4 quanta de energia levam à libertação de O2, 4 H+ e 4 electrões, que vão para o
fotossistema. Este é o mecanismo molecular que explica a extrusão de electrões da
água.
c) Reacções do fotossistema I
O fotossistema I também é um complexo com várias subunidades, um sistema
de proteínas que atravessa a membrana dos tilacóides. As subunidades psa A e psa B
são importates pois é lá que se encontra o centro de reacção (na figura, o A 0 é o A1, e
vice-versa). O electrão passa de A0, uma clorofila, para o A1, deste para Fx e daqui salta
para psa C. Finalmente, os electrões são lançados na ferredoxina.
A psa F serve para permitir a ligação da plastocianina, enquanto a psa D liga a
ferredoxina no lado do estroma, onde os electrões a vão reduzir.
Para formar NADPH são necessários 2 electrões, pelo que é necessário reduzir
2 ferredoxinas, tendo o ciclo de ocorrer 2 vezes.
O fotossistema, quando excitado, vai buscar os electrões à plastocianina e passálos à ferredoxina, que vai reduzir o NADP+ a NADPH.
75
d) Formação de ATP por fotofosforilação
A reacção net entre o fotossistema II, o citocromo bf (o fotossistema I) e o
fotossistema I é:
luz
2 H2O + 2 NADP → O2 + 2 NADPH + 2 H+
+
A luz promove o fluxo de electrões de H2O para NADPH e leva à formação de
uma força protomotriz, que permite a síntese de ATP.
O fotossistema II é fotoexcitado, os electrões convertem Q em QH2, depois
passam pelo conjunto de citocromos, de seguida para a plastocianina e para o
fotossistema I, depois, e daí para a ferredoxina, formando-se, no final, NADPH. Formase um gradiente de protões e a síntese de ATP dá-se por acção de uma ATP sintetase
semelhante à da mitocôndria (F0F1 ATP sintetase), a C F0F1 ATP sintetase. Quando
os protões passam por esse complexo, forma-se ATP; os protões translocados, passando
pela ATP sintetase, levam à síntese de ATP.
A força protomotriz, Δp, tem duas componentes, uma eléctrica, ΔΨ, porque este
gradiente forma um potencial, e uma componente química. Na mitocôndria, e á
componente eléctrica que contribui mais. No cloroplasto, o ΔΨ contriobui pouco para
Δp. Neste organito, quando se forma o gradiente de protões, o potencial eléctrico é
fraco, pois, juntamente com os protões, entra Cl-, e as cargas neutralizam-se. O
potencial não é, por isso mesmo, alto. Para além disso, quando entra H+, sai magnésio.
É por isso que o potencial eléctrico é fraco.
Para cada electrão que vem da água, são translocados 2 protões e fica 1. Na
passagem das quinonas para os citocromos, há translocação de mais 1 e, da oxidação
da água, fica mais um. São assim translocados 3 protões, o necessário para a síntese de
ATP. Há translocação de um fosfato que basifica ________.
3. Fotofosforilação não cíclica
O electrão libertado pela excitação do P700 vai reduzir a ferredoxina. Se as
células tiverem muito NADPH, é preciso NADP+ para receber os electrões. Se o P700
perder um electrão e as células não precisarem de NADPH porque têm muito, os
electrões voltam para o sistema de citocromos, vão para a plastocianina e voltam ao
P700. O electrão não segue o trajecto normal para o NADP+. Sem gradiente de protões
não há síntese de ATP. Neste caso, não actua o fotossistema II, não havendo fotólise da
água nem libertação de O2.
76
Reacções de escuro
O NADPH e o ATP formados nas reacções de luz permitem a fixação de CO2
que ocorre nas reacções de escuro, que não necessitam de luz e levam à formação dos
hidratos de carbono.
1. Fixação de CO2
Os estudos das reacções de escuro foram feitos por Calvin. Ele estudou
suspensões da alga Chlorella, que submeteu a carbono radioactivo. Passados 5 s, a
radioactividade estava toda no ácido-3-fosfoglicémico; aos 60s estava em vários
compostos. Se o ácido-3-fosfoglicérido tem 3 carbonos, a molécula que fixaria o CO2
teria 2 carbonos, formando-se moléculas com 3 carbonos. No entanto, a molécula que
fica o CO2 tem 5 carbonos: é a ribulose-1,5-bifosfato.
Numa reacção catalisada pela ribulose-1,5-bifosfato carboxilase oxigenase
forma um intermediário, o enediol, que recebe o CO2, formando 2’-carboxi-ceto-Darabinitol-1,5-bifosfato. Por hidratação, este forma um interemdiário hidratado que
é clivado em carbanião e ácido-3-fosfoglicérido. O carbanião também forma o mesmo
ácido.
2. Ribulose-1,5-bifosfato carboxilase oxidase – RUBISCO
A ribulose-1,5-bifosfato carboxilase oxigenase, RUBISCO, funciona como
carboxilase, introduzindo CO2. É importante, existindo nas plantas verdes, nas quais há
uma certa complexidade, havendo 8 cadeias longas, L, e 8 cadeias pequenas, s. As s
estimulam as L. Em bactérias há várias enzimas análogas, com estrutura um pouco
diferente. Há um dímero semelhante às cadeias L das plantas verdes. A RUBISCO,
para actuar, precisa de ser activada. Há um aminoácido importante para a catálise, uma
lisina, que tem sempre um ε-aminogrupo. A sua carboxilação forma carbamato,
importante para quelar Mn2+ ou Mg2+. O CO2 é importante, não só como substrato, mas
também como activador da enzima.
A RUBISCO funciona normalmente para fixar CO2, mas também pode fixar O2,
podendo funcionar como oxigenase. A velocidade da RUBISCO é maior como
carboxilase e a concentração de CO2 será menor que a de O2 no estroma das (dessas)
plantas. A enzima funciona mais como carboxilase, mas, em certas condições, funciona
mais como oxigenase. O intermediário enediol, recebendo oxigénio, forma um
intermediário hidroperóxido que, após hidratação, forma ácido-3-fosfoglicérido, mas
também fosfoglicolato. Quando tem actividade de oxigenase, forma fosfoglicolato, que
vai ser desfosforilado e origina glicolato. Por oxidação, este pode dar origem a
glioxilato. Entra O2 numa reacção e forma-se peróxido de hidrogénio. O glioxilato, __
__ transaminação onde intervem serina, que forma hidroxipiruvato, resultando
também glicina. Duas glicinas formam serina, CO2 e NH4+. Gasta-se O2 e forma-se
CO2, o processo ____ _ respiração. É uma fotorrespiração, mas não se forma nada de
importante em termos bioenergéticos, seja ATP ou equivalentes de redução. O
hidroxipiruvato forma glicerato, usado para produzir ácido-3-fosfoglicérido.
A fotorrespiração não é importante, pelo que é importante ________. Tem de se
impedir que a RUBISCO actue como oxigense. Os investigadores tentaram evitar esta
77
“imperfeição” da RUBISCO por modificação genética. As plantas de zonas tropicais,
em que a actividade de oxigenase é grande, arranjaram forma de a diminuir.
3. Formação de hexoses-fosfato
A RUBISCO, funcionando como carboxilase, catalisa a fixação de CO2. O
objectivo da fotossíntese é fazer a síntese de hexoses, isto é, o que interessa é fazer a
síntese de hidratos de carbono. O primeiro produto da fixação é o ácido-3fosfoglicérido. Existendo CO2 forma-se esse composto. A ____ segue-se uma via muito
semelhante à gluconeogénese.
O
ácido-3-fosfoglicérido
é
fosforilado,
originando-se
ácido-1,3bifosfoglicérido e sendo o ATP necessário formado nas reacções de luz. O ácido-1,3bifosfoglicérido passa a gliceraldeído-3-fosfato, numa reacção de redução que requer
NADPH. O composto formado passa a frutose-1,6-bifosfato que, depois de
desfosforilação, origina frutose-6-fosfato, sendo já estes dois compostos hexoses. A
frutose-6-fosfato, após desfosforilação, pode originar frutose.
4. Ciclo de Calvin
É necessário regenerar a ribulose-1,5-bifosfato. Na regeneração desse composto
há reacções semelhantes às da via das pentoses-fosfato. A frutose-6-fosfato, mais o
gliceraldeído-3-fosfato, numa reacção catalisada por uma transcetolase, formam xilose5-fosfato e eritrose-4-fosfato (C6 + C3 = C4 + C5) Por acção de uma aldolase, esta
última e dihidroxiacetona-fosfato originam sedoheptulose-1,7-bifosfato. Esta, mais
gliceraldeído-3-fosfato, formam ribose-5-fosfato e xilose-5-fosfato, por acção de uma
transcetolase. A ribose-5-fosfato e a xilose-5-fosfato podem converter-se em ribulose5-fosfato (ribulose), a primeira por isomerização, catalisada por uma isomerase, e a
outra por epimerização, catalisada por uma epimerase. Para regenerar ribulose-1,5fosfato, há fosforilação de ribulose-5-fosfato, por uma cinase.
Este é o ciclo de Calvin.
No ciclo de Calvin, a ribulose-1,5-bifosfato fixa CO2, formando ácido-3fosfoglicérido. Gasta-se ATP, 2, vindos das reacções de luz, para formar ácido-1,3bifosfoglicérido, e, depois, há redução deste composto a gliceraldeído-3-fosfato, vindo
os electrões de 2 NADPH. Forma-se frutose-6-fosfato que, juntamente com o
gliceraldeído-3-fosfato, é gasta para regenerar a ribulose. Parte da frutose-6-fosfato é
também usada para regenerar glicose. A ribulose-5-fosfato, regenerada pelo conjunto de
reacções catalisadas por transcetolases, transaldolases e outras enzimas, é fosforilada a
ribulose-1,5-bifosfato. Formam-se 12 gliceraldeídos-3-fosfato, 8 são gastos para
sintetizar hidratos de carbono e os outros ficam para regeneração.
Chama-se a este ciclo ciclo de Calvin pois foi Calvin quem o estudou. A reacção
net vem:
6 CO2 + 18 ATP + 12 NADPH + 12 H+ + 12 H2O →
glucose + 18 ADP + 18 Pi 12 NADP+
Este processo ocorre nas plantas C3, que fixam carbono em moléculas de 3
carbonos.
78
5. Estratégia das plantas C4
A actividade de oxigenase da RUBISCO é desfavorável e, a altas temperaturas,
ela funciona desse modo. As plantas de zonas com essas condições, como a cana-do
açúcar, que ocorre em zonas tropicais, criaram adaptações para evitar a actividade da
RUBISCO como oxigenase.
Nestas plantas, C4, o fosfoenolpiruvato é o fixador de CO2 atmosférico,
formando oxaloacetato, com 4 carbonos, sendo por isso que se chamam C4 (3C). O
oxaloacetato passa a malato, que vem do mesófilo para as células da bainha, nas quais
se procerssa o ciclo de Calvin. O malato sofre uma descarboxilação e o CO2 vai ser
fixado normalmente no ciclo de Calvin, pelo _____. Da descarboxilação resulta
piruvato, que vai para as células do mesofilo, onde a piruvato-Pi dicinase o converte
em fosfoenolpiruvato.
Este processo tem como objectivo aumentar a concentração de CO2 na bainha,
levando a RUBIUSCO a funcionar como carboxilase. O consumo de ATP extra é o
preço do transporte de CO2 para a bainha. Nas plantas C4 gastam-se 18 ATP’s no ciclo
de Calvin e mais 12 para transportar o CO2 para a bainha (mesófilo).
79
Capítulo 7: Catabolismo das proteínas
As proteínas resultam da expressão de genes. A proteólise, o catabolismo de
proteínas, pode servir para a regulação da concentração destas moléculas no meio
intracelular. Elas devem ocorrer num steady-state, homeostasia, equilíbrio dinâmico e,
por isso, a formação deve ser controlada por uma degradação. A degradação é
importante para manter a concentração de proteínas, quando a síntese é constitutiva
(constante). Pode também servir para eliminar proteínas defeituosas e é também
importante como fonte de amionoácidos, quando eles são necessários.
Proteólise lisossómica
A degradação ocorre nos lisossomas, que têm várias enzimas, hidrolases, que
degradam várias moléculas. As proteasas, nos lisossomas, degradam as proteínas. Estes
compartimentos têm um pH muito baixo, mantido por uma bomba de protões (ATPase
protónica), que mantém o gradiente destas partículas. As proteases referidas requerem
esse pH baixo para funcionar. As enzimas do interior do lisossoma não são ____ fora
dele, pois não funcionam para valores de pH aí existentes. Os lisossomas têm também
importantes proteínas transportadoras, que transportam os produtos a degradar e os
produtos da degradação. Há também proteínas glicosiladas, protegidas contra as
enzimas hidrolíticas.
Os lissomas são também importantes para degradar organismos estranhos
fagocitados. Outros processos digestivos podem ocorrer relativamente a partículas ou a
partes da própria célula (autofagia). Uma mitocôndria pode ser digerida.
A proteólise lisossómica não é selectiva, digerindo tudo. É importante, mas
mais para os processos digestivos referidos.
80
Proteólise extralisossómica
Há também proteólise extralisossómica, com grande selectividade, já que, neste
caso, as proteínas (Elas) têm de ser reconhecidas para serem degradadas. Esses
mecanismos ocorrem no citoplasma.
1. Tipos de proteólise extralisossómica
A proteólise do tipo A é dependente de ubiquitina, enquanto a do tipo B é uma
proteólise de processamento, necessária para as enzimas ficarem activas. Esta última é
dependente de cálcio. As proteases dependentes de cálcio são calpaínas. O cálcio é um
importante regulador e, quando aumenta na célula, pode induzir processos proteolíticos.
No tipo A, a selectividade é determinada pela conjugação entre as proteínas
substrato e a ubiquitina. No tipo B, a selectividade é determinada por peptídeos
sinalizantes ou por variações na concentração de Ca2+ intracelular reconhecidas pelas
calpaínas.
2. Proteólise extralisossómica do tipo A
2.1. Ubiquitina
A ubiquitina é uma proteína ubiquista (existe em todo o lado) muito importante.
Ela liga-se a proteínas para marcar as proteínas substrato para serem degradadas e tem
três faces de interacção. Ela leva à degradação das proteínas com que se liga, e, ao
ligar-se, pode também levar a mudanças da forma e da função.
2.2. Processo global
O primeiro passo de mecanismo proteolítico é a activação da ubiquitina. Ela é
activada pela enzima E1 e é, de seguida, transferida para essa mesma enzima. Depois há
uma transesterificação catalisada por E2 e ocorre, então, uma selecção da proteína
substrato, feita por uma enzima E3, uma ligase seleccionadora. Por fim, há uma
conjugação entre a ubiquitina e as proteínas-alvo, catalisada pela enzima E3.
Para a ubiquitina se ligar, ela tem de activada, por E1, à qual fica ligada. Depois,
(a E2) é transferida para E2 e, por fim, a ubiquitina liberta-se desta e fica ligda à
proteína alvo, da qul a E3 entretanto se soltou.
2.3. Análise das reacções
a) Activação da ubiquitina
Ao início, a ubiquitina é adenilada, por acção da E1, usando-se ATP e
libertando-se pirofosfato. A ubiquitina fica ligada a AMP.
81
b) Transferência da ubiquitina para E1
A ubiquitina activada é transferida para um local tiol de E1, formando uma
ligação tioéster de altas energia.
c) Transesterificação da ubiquitina
Depois, a ubiquitina, ligada a E1, é transferida para E2, a enzima
transportadora.
d) Selecção das proteínas substrato
As proteínas a degradar têm de ser reconhecidas e é a enzima E3 que faz esse
reconhecimento.
e) Conjugação da ubiquitina com as proteínas-alvo
Depois de haver o reconhecimento, vem a fase final, em que se transfere a
ubiquitina, transportada por E2, para a proteína a degradar. Saem depois a E2 e a E3,
uma ligase, e a ubioquitina conjuga-se, assim, com a proteína-alvo.
2.4. Clivagem das proteínas
Proteínas que estejam marcadas com ubiquitina são degradadas no
proteossoma. O proteossoma é o complexo onde são degradadas as proteínas. As
proteínas, marcadas com ubiquitina, são degradadas, libertando-se a ubiquitina e
resultando peptídeos.
2.5. Reconhecimento de proteínas substrato
Os α-aminogrupos são muito importantes no reconhecimento. Todas as
proteínas têm um terminal amínico e é ele que determina o período de meia-vida das
proteínas. Terminais amínicos de Tyr, Ile, Glu, His, Arg, Lys, Phe, Trp, Leu, Asn ou
Asp determinam períodos de meia-vida curtos. Se tiverem resíduos terminais de Met,
Ser, Ala, Thr, Val, Gly, Pro ou Cys, as proteínas têm meia-vida longa. Quando são
sintetetizadas têm sempre um resíduo de meteonina no terminal amínico, que é
removido por uma enzima, a meteonina aminopeptidase. Isso é necessário porque,
depois, expõe-se o segundo resíduo. A acetil transferase também modifica, alterando a
enzima por acetilação. Muitas vezes, nas proteínas, há lisinas, com ε-aminogrupos,
não terminais, laterias, a que se liga a ubiquitina, aumentando-se a velocidade.
Este sistema de proteólise envolve esta selectividade. É um sistema que remove
proteínas defeituosas e proteínas reguladoras de vida curta. Dentro dos vários factores
reguladores, importantíssimos, há proteínas reguladoras, que devem ter um tempo de
meia-vida curto.
É a enzima E3 que identifica os substratos. Há vários tipos de E3, que
reconhecem certos tipos de proteínas com certos terminais amínicos. As proteínas com
terminais amínicos básicos são reconhecidas pelo tipo I; o tipo II reconhece proteínas
com terminais hidrofóbicos; o tipo III reconhece proteínas com terminais amínicos de
Ser, Ala e Thr; o tipo IV reconhece proteínas com terminais amínicos de Met, Ile, Pro,
Gly e Val., mas não pelo terminal. Estas últimas proteínas são reconhecidas por
82
sequências PEST que possuem, relativas a Pro, Glu, Ser e Tr. A acetilação dos
aminoácidos reconhecidos pelos tipos I, II e III impede o reconhecidmento. As
proteínais reconhecidas pelo tipo IV, se forem acetiladas, são reconhecidas na mesma,
pois o que se reconhece é a sequência PEST. As proteínas com aminoácidos terminais
acídicos não são reconhecias por E3. Os aminoácidos terminais Asn e Glu têm de ser
arginilados, por adição de arginina, passando a ser básicos e a ser reconhecidos pelo
tipo I. A asparagina e a glutamina, por uma asparaginase e uma glutaminase,
respectivamente, passam a aspartato e glutamato. Estes podem ser arginilados,
passando a ser básicos. Proteínas com terminais amínicos acídicos necessitam de RNAt
para serem arginiladas. É preciso um RNAt que traga o grupo arginil, que irá arginilar
os aminoácidos. E3 tem locais negativmente carregados que necessitam de resíduos
básicos para se ligar.
83
- Parte III Integração metabólica
84
Integração metabólica intra e intercelular
1. Interrelação entre blocos de metabolismo intermediário
O metabolismo é um processo altamente regulado e integrado, o que é
favorável, pois permite um rápido ajuste para satisfazer as necessidades das células A
regulação e integração permitem que a resposta seja o mais económica possível.
Os compostos produzidos nas células autotróficas são usados pelas células
heterotróficas, quer no catabolismo, quer no anabolismo. O catabolismo também
fornece intermediários para o anabolismo. Este produz compostos utilizados noutros
blocos metabólicos, em que se produzem macromoléuclas. Diferentes nucleótidos são
gastos para produzir diferentes macromoléculas:
- GTP é usado para proteínas
- CTP é usado para lípidos complexos
- UDP é usado para polissacarídeos
São essas macromoléculas que constituem as células, formando membranas,
organelos e outras estruturas. Isto permite o crescimento dos organismos. Diferentes
nucleótidos equivalem a ATP.
2. ATP como “moeda” energética
O objectivo biológico do ATP é conduzir reacções termodinamicamente
desfavoráveis. É graças à energia libertada na hidrólise de ATP que as reacções
termodinamente desfavoráveis se tornam favoráveis.
O coeficiente de acoplamento é o número de moles de ATP gastas por
molécula produzida. O equivalente de ATP corresponde à conversão destas moléculas
de ATP em ADP, equivalente -1, ou AMP, equivalente -2.
3. Ciclos de substrato
Na reacção da glicólise em que a fosfofrutocinase converte frutose-6-fosfato
em frutose-1,6-bifosfato, o equivalente de ATP é -1, já que o ATP é convertido em
ADP. Na gluconeogénese, na passagem de frutose-1,6-bifosfato a frutose-6-fosfato,
catalizada pela enzima frutose-bifosfatase, não há transformação de ATP, sendo o
equivalente 0. Há uma hidrólise net de ATP, sem haver conversão net de substrato.
A isto chama-se ciclos de substrato, que são fúteis em termos energéticos. Uma
maneira de serem evitados é utilizar os processos reguladores do metabolismo. No caso
visto, as duas enzimas são reguladas de maneira contrária, o que impede estes ciclos
fúteis.
Às vezes os ciclos fúteis também são necessários. Há uma abelha que necessita
de uma tempertura de 30ºC no tórax para bater as asas. Elas conseguem voar em
menores temperaturas, pois há ciclos de substrato a produzir calor. Para que o ciclo se
dê, o regulador, AMP, é inibido. De uma maneira estes ciclos são fúteis mas, em alguns
casos, podem ter utilidade.
85
Integração metabólica entre órgãos
1. Padrões de metabolismo energético nos tecidos animais
Para além da integração metabólia intercelular, há integração metabólica ao
nível de órgãos diferentes.
Para haver integração, tem de haver uma ligação entre eles – a corrente
sanguínea, que transporta os nutrientes para os órgãos. Os combustíveis metabólicos
(Um combustível metabólico) são moléculas circulantes que depois entram nas células
para serem metabolizadas.
Há também moléculas de armazenamento, que armazenam substâncias. Entre
elas contam-se os triglicerídeos, armazenados nos adipócitos (Os triglicerídeos
também são circulares e a sua alta concetração não é favorável), e o glicogénio,
armazenado no fígado. Estes órgãos são órgãos de armazenamento. O fígado armazena
glicogénio, mas também recebe ácidos gordos. Os adipócitos recebem muito glicerol.
No tecido adiposo armazenam-se ácidos gordos, na forma de triglicerídos e a glicose é
convertida em acetil-Coenzima A, servindo para sintetizar ácidos gordos.
Cada órgão tem especificidade metabólica. O cérebro é um tecido com grande
actividade, mesmo a dormir, mas não tem reservas, estando dependente dos
combustíveis circulares; não armazena nada, estando dependente do que lhe chega. O
coração tem um trabalho constante e rítmico e funciona sempre em aerobiose Está na
mesma situação que o cérebro, mas tem algumas reservas, embora poucas. O cérebro
prefere glicose, mas pode usar corpos cetónicos, enquanto o coração prefere ácidos
gordos a glucose. O músculo tem um trabalho intermitente, contraindo ou não quando é
preciso. Pode funcionar anaerobicante, em caso de exercício rigoroso. Ele contem
fosfocreatina que sintetiza ATP.
2. Papel central do fígado
O fígado tem um papel importante na integração metabólica. Ele tem uma
localização estratégica: de um modo geral, os órgãos são irrigados de maneira paralela,
mas o fígado tem uma localização em sério com o intestino, fazendo dele algo muito
importante no metabolismo. Todos os nutrientes que resultam da digestão vão para a
corrente sanguínea e para o fígado. Ele é importantíssimo na interconversão
metabólica e é também o principal exportador de nutrientes, para outras partes do corpo.
Ele tem nutrientes armazenados, e pode fornecê-los, podendo exportar os combustíveis
para a periferia. O fígado tem um papel central pois serve de tampão metabólico,
assegurando que não há um excesso ou uma deficiência de combustível.
3. Ciclos metabólicos
Os vários órgãos têm uma certa especificidade metabólica. Tém processos
específicos, o que é importante. Os órgãos podem comunicar entre si em termos
metabólicosm e isso é importante.
86
3.1. Ciclo glucose-ácidos gordos
Entre o tecido adiposo (adipócitos) e o músculo ocorre um desses ciclos, o
ciclo glucose-ácidos gordos. O músculo requer glicose para realizar glicólise, para
produzir energia. Se houver um baixo nível de glicose, há um baixo nível de insulina, a
hormona que facilita o transporte deste açúcar. A insulina inibe a lipólise no adipócito,
pelo que, quando a glicose é baixa, a inibição da lipóise é levantada. Os triglicerídeos
dão origem aos ácidos gordos e ao glicerol. Os primeros entram nos músculos e são
usados para produzir energia, tendo como produto final o acetil-Coenzima A. Quando
este é abundante, vai regular negativamente a enzima que catalisa a conversão do
piruvato em acetil-Coenzima A. Este pode entrar no ciclo de Krebs, no qual um dos
intermediários é o citrato, que também inibe a glicólise, inibindo a fosfofrutocinase. A
degradação de ácidos gordos também leva à formação de NADH.
Quando a glicose é pouco abundante, os músculos vão utilizar ácidos gordos,
produzindo-se compostos que inibem a glicólise, já que não é favorável que a glicose
seja degradada. A inibição leva a que o músculo prefira os ácidos gordos.
3.2. Ciclo de Cori
O ciclo de Cori é importante porque permite a interligação de órgãos, passandose entre dois, o fígado e o músculo. Neste último usa-se fundamentalmente glicose,
produzindo-se ATP usado na contracção. Em anaerobiose, a glicólise, no músculo
(fígado), forma lactato, que vai até ao fígado pela corrente sanguínea. Aí, o lactato,
por gluconeogénese, forma glicose, que volta, depois, pela corrente sanguínea, ao
músculo. A gluconeogénese requer energia, que provém da degradação de ácidos
gordos existentes no fígado.
No ciclo, há uma reciclagem de carbono e um transporte de energia.
3.3. Ciclo glucose-alanina
Outro ciclo metabólico importante é o ciclo glucose-alanina, que se passa entre
os mesmo órgãos. No músculo, a glicose é convertida em piruvato, que pode originar
alanina, em vez de originar lactato, o que pode ser vantajoso. A alanina é um regulador
de um tipo de piruvato cinase. A alanina formado nos músculos pode ir para o fígado
e, aí, ser metabolizada po acção de transaminases, e originar piruvato. Há formação de
iões amónio que podem ser excretados pela urina, na forma de ureia. O piruvato, por
gluconeogénese, pode originar glucose, que volta para o músculo, onde há utilização
desse açúcar.
A alanina pode, então, formar glucose, no fígado. Há um aproveitamento
energético. A passagem de piruvato a lactato levou à perda de energia, tendo-se perdido
NADH, uma molécula importante.
Estes ciclos dependem da especificidade de vários órgãos, que é usada por todo
o organismo, por acção destes reguladores metabólicos.
4. Homeostasia de combustíveis
O fígado é um órgão de grande importância em termos metabólicos,
apresentando função de tampão, impedindo o excesso ou a deficiência de combustíveis.
87
Após uma refeição, há abundância de glucose no sangue. Nestas condições e graças á
hormona insulina, há síntese de glicogénio, onde a glucose fica armazenada, no fígado.
A glucose passa a glucose-6-fosfato. Parte é armazenada e outra é usada para sintetizar
ácidos gordos e para sintetizar energia para o próprio fígado. A glucose-6-fosfato pode
formar ácidos gordos pois, no final da glicólise, converte-se em acetil-Coenzma A.
Uma vez sintetizados no fígado, os ácidos gordos vão para o tecido adiposo. Se se
passar muito tempo sem comer (de noite, por exemplo), o glicogénio armazenado é
degradado em glicose, que é distribuída. É uma hormona, glucágono, a responsável por
isto. Muitos ácidos gordos podem ir para o fígado, para serem também convertidos em
glicose.
Durante fome progressiva, os níveis de glicose vão baixando, os ácidos gordos
vão subindo e os corpos cetónicos vão aumentando. A insulina baixa, pois não é
preciso armazenar glicose, e o glucágono aumenta.
Nas primeiras quatro horas depois de comer, a glucose no sangue é abundante e
é a primeira a ser utilizada. Esta fase é a absorptiva. Se, passadas quatro horas, não se
comer, a glucose exógena já foi gasta, e o organismo vai buscar a glicose ao glicogénio.
Esta fase é a pós-absorptiva. Se se continuar em fome, atinge-se a terceira fase, uma
fome mais perigosa, a fome inicial. O organismo começa a sintetizar glicose a partir da
gluconeogénese, no fígado. Se os dias forem passando, ao início ainda há
gluconeogénese, mas depois ela vai diminuindo. É a fome intermédia. A quinta fase
pode durar ainda mais tempo e é muito perigosa. O primeiro órgão a ser afectado é o
cérebro, que requer sempre glicose. Ele está sempre a funcionar, mesmo a dormir, e
não tem reservas.
88