Metabolismo e Endocrinologia
Grupo 1
29 de Março de 2006
Metabolismo e Endocrinologia
2.º Ano LEBM, 29 de Março de 2006
Grupo 4: Ana Carapeto, Ana Rita Gafaniz, Bruna Mota
Tema: Interconversão energética.
Interconversão energética
Bioenergética e Termodinâmica
A Bioenergética consiste no estudo quantitativo das relações e conversões de
energia que ocorrem em sistemas biológicos.
Todas as transformações bioenergéticas obedecem às leis da Termodinâmica:
•
1ª Lei da Termodinâmica - Princípio da conservação de energia: “a
energia do Universo é constante”;
•
2ª Lei da Termodinâmica: “a entropia do Universo tende a um máximo”.
Existem três quantidades termodinâmicas que descrevem as alterações de
energia que ocorrem numa reacção química:
•
Energia livre de Gibbs: quantidade de energia capaz de realizar
trabalho, a temperatura e pressão constantes. Se a reacção ocorre com
uma libertação de energia livre (∆G<0) dá-se o nome de reacção
exergónica. Se ∆G>0, chama-se reacção endergónica.
•
Entalpia: calor do sistema reaccional. Quando há libertação de calor
(∆H<0) a reacção é exotérmica, quando o sistema recebe calor do
exterior (∆H>0), a reacção é endotérmica.
•
Entropia: mede a desordem do sistema.
A relação entre estas é traduzida pela expressão: ∆G = ∆H – T ∆S.
A variação de energia livre transformada padrão, ∆G’º, é uma constante física
característica para uma dada reacção e pode ser calculada através da constante de
equilíbrio da reacção, K’eq: ∆G’º = - RT ln K’eq.
A variação de energia livre real, ∆G, depende de ∆G’º e da concentração dos
reagentes e produtos: ∆G = ∆G’º + RT ln([produtos]/[reagentes]). Como tal, ∆G é
independente do modo como a reacção ocorre.
As reacções químicas tendem a evoluir na direcção que resulta numa
diminuição da energia livre do sistema. Quando ∆G é negativa, a reacção tende a
1
Metabolismo e Endocrinologia
Grupo 1
29 de Março de 2006
evoluir no sentido directo, quando é positiva tende a evoluir no sentido inverso e
quando é zero o sistema está em equilíbrio.
As variações de energia livre são aditivas. Deste modo, a rede de reacções
químicas resultante de sucessivas reacções que partilham um intermediário comum,
apresenta um ∆G correspondente à soma dos valores de ∆G das reacções individuais.
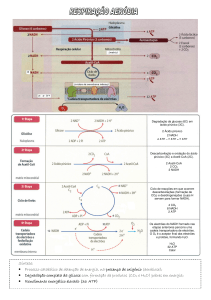
Transferência de grupos fosfato e ATP
O ATP (adenosina trifosfato) é essencial como fonte de energia. É uma ligação
química entre o catabolismo (degradação de moléculas complexas) e o anabolismo
(construção de moléculas complexas a partir de simples).
Papel do ATP no ciclo de energia na célula. Importância do ATP em processos
endergónicos
O ciclo de energia nas células acontece graças ao papel especial do ATP na
interligação dos processos catabólicos e anabólicos.
As células heterotróficas obtêm energia livre de forma química, pelo
catabolismo de nutrientes e empregam esta energia para sintetizar ATP a partir de
ADP + Pi.
O ATP transfere parte de sua energia para processos de síntese de
macromoléculas, intermediários metabólicos e para o transporte de substâncias
através das membranas contra gradientes de concentração. Essa transferência de
energia pelo ATP resulta na conversão do ATP em ADP + Pi.
A maior parte dos casos de utilização da energia do ATP envolve a
transferência de grupos e não a simples hidrólise do ATP.
A participação do ATP numa reacção é sempre um processo de dois passos.
Parte das moléculas do ATP, do grupo fosfato ou da porção adenilato (AMP), é
primeiro transferida para uma molécula de substrato ou para um resíduo de
aminoácido numa proteína, ficando covalentemente ligado a ele e aumentando o
conteúdo de energia livre do substrato e da enzima.
No passo seguinte, a metade contendo o fosfato e que foi transferida no
primeiro passo é deslocada, gerando Pi ou AMP.
2
Metabolismo e Endocrinologia
Grupo 1
29 de Março de 2006
Assim, o ATP participa na reacção catalisada enzimaticamente e para a qual
ele fornece energia livre.
Reacções de oxidação-redução
O fluxo de electrões nas reacções redox é responsável directa ou
indirectamente por todo o trabalho feito pelos organismos vivos.
O percurso de electrões no metabolismo é complexo. As células têm um
circuito biológico com um composto relativamente reduzido (como a glucose) como
fonte de electrões. Enquanto a glucose é oxidada enzimaticamente, os electrões
libertados flúem espontaneamente através de uma série de portadores de electrões
intermediários para outras espécies químicas como o oxigénio. Este fluxo de electrões
é exoenergético, porque o oxigénio tem uma grande afinidade electrónica, maior do
que a dos portadores de electrões intermediários.
A força electromotriz resultante fornece energia a uma variedade de
transdutores moleculares (enzimas e outras proteínas) que realizam o trabalho
biológico.
O carbono das células existe numa escala de graus de excitação. Quando o
carbono compartilha um par de electrões com outro átomo, a partilha é desequilibrada
a favor do átomo mais electronegativo. Nos casos em que a oxidação é coincidente
com a perda de hidrogénios (alcano para alceno por exemplo), há uma
desidrogenação e as enzimas que catalizam essa oxidação são as desidrogenases.
O termo genérico para designar os electrões que são transferidos numa
reacção redox é equivalente redutor.
Quando dois pares conjugados de oxidação – redução estão juntos em solução
a transferência de electrões pode ocorrer espontaneamente. A tendência para cada
reacção depende da afinidade relativa do receptor de electrões a cada par de
electrões. O potencial de redução padrão Eº, mede esta afinidade.
Pode referir-se a oxidação completa de uma molécula de piruvato a CO2 no
ciclo de Krebs que ocorre na matriz mitocondrial, pelo que as reacções redox
desempenham um papel muito importante na bioenergética.
3
Metabolismo e Endocrinologia
Grupo 1
29 de Março de 2006
Bibliografia
•
D.L. Nelson, M. M. Cox, “Lehninger Principles of Biochemistry” (4th edition),
Freeman, New York, 2005;
•
http://www.icb.ufmg.br/~lbcd/cromatina/farmacia/cap13b.html,
mantido
pelo
Instituto de Ciências Biológicas da Universidade Federal de Minas Gerais,
Brasil, consultado em 23/3/06.
4