QUÍMICA
Funções inorgânicas II
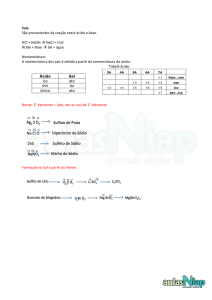
Sais
QUÍMICA
QUÍMICA
Classificação dos sais
Sal Hidratado: contém moléculas de água
em seu retículo cristalino.
Exemplo: MgSO4 . 7H2O
Importante: nesse sal a água é chamada
de água de cristalização ou água de
hidratação.
QUÍMICA
Classificação dos sais
Sal anidro: sal que não
apresenta água cristalizada.
Exemplo: KNO3
QUÍMICA
Classificação dos sais
Sal normal: tem apenas um tipo de cátion
e um tipo de ânion, formado pela
neutralização total de um ácido por uma
base.
Exemplo: KNO3
QUÍMICA
Classificação dos sais
Hidrogenossal: tem um ou mais
+
hidrogênios ionizáveis, H , e é formado
pela neutralização parcial de um ácido
por uma base.
Exemplo: Ca(HCO3)2
QUÍMICA
Classificação dos sais
Hidroxissal: tem uma ou mais hidroxilas,
OH , e é formado pela neutralização
parcial de uma base por um ácido.
Exemplo: Mg(OH)Cl
QUÍMICA
Classificação dos sais
Sal duplo ou misto
- Quanto ao cátion: tem dois ou mais
cátions que não são hidrogênios
ionizáveis e que provêm de duas bases.
Exemplo: LiNaSO4
QUÍMICA
Classificação dos sais
Sal duplo ou misto
- Quanto ao ânion: tem dois ou mais
ânions que não são hidroxilas e que
provêm de dois ácidos.
Exemplo: CaClNO3
QUÍMICA
Características
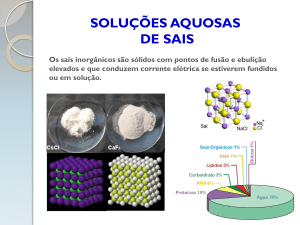
- São compostos iônicos;
- São sólidos à temperatura ambiente e à
pressão normal;
- Têm sabor salgado (mas muitos deles
são venenosos);
- Conduzem corrente elétrica quando
fundidos ou em solução aquosa;
QUÍMICA
Características
- Apresentam elevadas temperaturas de
fusão e ebulição;
- São armazenados em frascos de vidro
ou de polietileno.
QUÍMICA
Nomenclatura dos sais normais
Nox fixo
nome do ânion (de) nome do cátion
Exemplos:
_
2+
Mg Cl _= MgCl2 = cloreto de magnésio
2+
Ca NO3 = Ca(NO3)2 = nitrato de cálcio
QUÍMICA
Nomenclatura dos sais normais
Nox variável
Oficial
(nome do ânion) de (nome do cátion)
Nox em algarismo romano
QUÍMICA
Exemplos:
22+
Fe SO4 FeSO4 = sulfato de ferro II
3+
2Fe SO4 Fe2(SO4)3 = sulfato de ferro III
Nomenclatura dos sais normais
Nox variável
Usual
ico (maior Nox)
(nome do ânion)
+ ou
(nome do cátion)
oso (menor Nox)
QUÍMICA
Exemplos:
22+
Fe SO4 FeSO4 = sulfato ferroso
3+
2Fe SO4 Fe2(SO4)3 = sulfato férrico
Nomenclatura dos sais normais
Os nomes dos ânions são obtidos por meio
das trocas dos sufixos dos nomes dos ácidos
que lhes deram origem. Assim, temos:
QUÍMICA
Nomenclatura dos sais normais
Nome do ácido
QUÍMICA
Nome do ânion
_
elemento
ídrico
troca
_
elemento
eto
hipo
elemento
oso
troca
hipo
elemento
ito
_
elemento
oso
troca
_
elemento
ito
_
elemento
ico
troca
_
elemento
ato
per
elemento
ico
troca
per
elemento
ato
Nomenclatura dos sais normais
Exemplos:
HCl = ácido clorídrico
HNO2 = ácido nitroso
H2CO3 = ácido carbônico
_
Cl = cloreto
NO = nitrito
CO = carbonato
_
2
QUÍMICA
23
Reação de neutralização parcial do
ácido: hidrogenossal
QUÍMICA
Nomenclatura dos hidrogenossais
Exemplos:
KHSO = (mono) hidrogenossulfato de
potássio ou sulfato (mono)ácido de potássio.
KH PO = di-hidrogenofosfato de potássio ou
fosfato diácido de potássio.
4
2
QUÍMICA
4
O prefixo mono pode ser omitido.
Nomenclatura dos hidrogenossais
Observação: na nomenclatura usual, quando o
hidrogenossal for originário de um ácido com
dois hidrogênios ionizáveis (diácido),
poderemos substituir o prefixo di por bi.
Exemplos:
NaHSO = bissulfato de sódio
NaHSO = bissulfito de sódio
NaHCO = bicarbonato de sódio
4
QUÍMICA
3
3
Reação de neutralização parcial da
base: hidroxissal
QUÍMICA
Reação de neutralização parcial da
base: hidroxissal
QUÍMICA
Exemplos:
Ca(OH)Cl = hidroxicloreto de cálcio ou cloreto
básico de cálcio;
Al(OH)Cl2 = hidroxicloreto de alumínio ou cloreto
básico de alumínio;
Pb(OH)3Br = tri-hidroxibrometo de chumbo IV ou
tri-hidroxibrometo plúmbico ou brometo tribásico
de chumbo IV ou brometo tribásico plúmbico.
Nomenclatura dos sais hidratados
nome do sal neutro
(prefixo de nº, moléculas de água) +
hidratado
Exemplos:
_
2+
Mg Cl _= MgCl2 = cloreto de magnésio
2+
Ca NO3 = Ca(NO3)2 = nitrato de cálcio
QUÍMICA
Curiosidades
- Galinho do tempo;
- Cloreto de Sódio (NaCl);
- Bicarbonato de Sódio (NaHCO );
- Fluoreto de Sódio (NaF);
- Carbonato de Cálcio (CaCO );
- Sulfato de Cálcio (CaSO );
- Hipoclorito de Sódio (NaClO).
3
3
4
QUÍMICA
QUÍMICA