TERMODINÂMICA – O
QUE SIGNIFICA?
TERMODINÂMICA
calor
força,
movimento
• No início, ocupou-se do estudo
dos processos que permitiam
converter calor em trabalho
MÁQUINA A VAPOR DE
THOMAS NEWCOMEN
• Como aumentar a eficiência
destas máquinas?
Termodinâmica ramo da Física
que tem por objecto de estudo:
• os processos em que há transferência de energia
e/ou transformações de energia em sistemas
macroscópicos, em termos de variáveis macroscópicas
como pressão (P), volume (V), área (S) ou comprimento (L),
temperatura (T), campo magnético (B), magnetização do material (M),
tensão superficial ( ), etc (as variáveis de interesse dependem do
sistema que se está a estudar);
• as propriedades físicas dos sistemas que são
determinantes nos processos de transferência de
energia (condutividades e capacidades térmicas,
coeficientes de expansão e compressibilidade, ...)
Sistemas macroscópicos → contêm um grande número de
partículas constituintes (átomos, moléculas, iões, ...)
NA 6,022 10 23
nº de Avogadro
Formalismo termodinâmico pode ser aplicado aos mais
diversos sistemas. Exemplos são:
• gás, líquido ou sólido num recipiente;
• corda esticada ou barra metálica;
• membrana esticada;
• circuito eléctrico;
• íman num campo magnético.
Exemplo: líquido num recipiente
Energia potencial gravítica,
mgh
Energia cinética de rotação
das pás
Energia interna das
moléculas de água
TERMODINÂMICA – VOCABULÁRIO
Sistema
termodinâmico
Vizinhança
do sistema
Fronteira
Uma certa porção de matéria, que
pretendemos estudar, suficientemente
extensa para poder ser descrita por
parâmetros macroscópicos.
Aquilo que é exterior ao sistema e com
o qual o sistema pode, eventualmente,
trocar energia e/ou matéria.
Superfície fechada, real (uma parede,
uma membrana, etc) ou abstracta
(imaginada por nós), que separa o
sistema da sua vizinhança.
Exemplo: Gás contido num cilindro
com uma parede móvel
Vizinhança: ar exterior
ao recipiente
Parede móvel (êmbolo)
+
Superfície lateral do
cilindro
+
Sistema: gás num
recipiente de parede
móvel
Base do cilindro
Fronteira: paredes do
recipiente
Sistema
isolado
Não troca energia nem matéria
com a sua vizinhança.
Sistema
fechado
Não troca matéria com a sua
vizinhança (pode trocar energia).
Sistema
aberto
Troca matéria com a sua
vizinhança.
Paredes móveis
(contrário: fixas)
Permitem transferência de
energia na forma de trabalho
mecânico.
Paredes diatérmicas
(contrário: adiabáticas)
Permitem transferência de
energia na forma de calor.
Paredes permeáveis
(contrário: impermeáveis)
Permitem transferência de
matéria.
Variáveis de estado
ou variáveis termodinâmicas
Grandezas macroscópicas mensuráveis e
que servem para caracterizar o sistema.
(Ex: temperatura (t), pressão (P), volume (V),
magnetização de um íman (M), área superficial
de um líquido (S), tensão numa corda (T), etc.)
TEMPERATURA
Interpretação microscópica medida da energia cinética
média dos átomos ou moléculas que constituem o sistema.
(gases: energia cinética de translação; sólidos: energia
cinética de vibração)
TEMPERATURA
Definição operacional a grandeza que se mede com um
termómetro.
A temperatura é lida no termómetro ao fim
de um certo tempo (tempo de relaxação),
quando A e B atingirem o equilíbrio térmico.
Relação entre escalas de
temperatura
Celsius e Kelvin
T (K ) t (ºC ) 273,15
Escala Kelvin:
Escala Celsius:
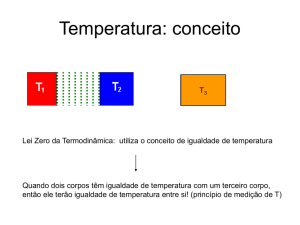
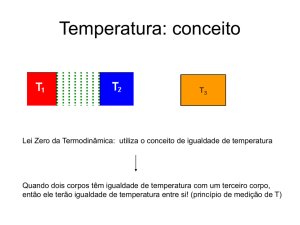
Princípio Zero
SISTEMA C
SISTEMA
A
SISTEMA
B
SISTEMA C
SISTEMA
A
SISTEMA
B
Dois sistemas (A e B) em equilíbrio térmico com um terceiro
sistema (C) estão também em equilíbrio térmico um com o
outro. Isto é, verifica-se a propriedade transitiva da relação de
equilíbrio térmico.
A temperatura é a propriedade que é comum a sistemas que
se encontram em equilíbrio térmico (mesma classe de
equivalência).
PRESSÃO
Pressão:
• força por unidade de área
• independente da orientação da superfície
• forças de pressão sempre perpendiculares à superfície
dF
p
dA
Estado de equilíbrio
termodinâmico
Estado termodinâmico caracterizado por
um valor uniforme (o mesmo por todo o
sistema) e estacionário (não varia com o
tempo) das variáveis termodinâmicas.
Equilíbrio térmico
Equilíbrio mecânico
Equilíbrio químico
Valor uniforme da temperatura
(contacto térmico entre subsistemas)
Valor uniforme da pressão (no
caso de gases).
Valor uniforme das concentrações
químicas.
Equação de estado
Equação que relaciona as diferentes
variáveis termodinâmicas de um sistema
em estados de equilíbrio.
Em geral, são precisas unicamente 2 variáveis de estado
para caracterizar um sistema fechado e de uma
componente (Exs: (P,V), (T,L),...)
Exemplo: Equação de estado do gás ideal
v
V 1
n
(m 3 / mol) → volume molar
R 8,314510 JK 1mol 1
Pv
T
Gases reais:
Pv
lim R
P 0
T
R const. molar dos gases ideais
Gás ideal (ou gás perfeito):
Pv
R PV nRT
T
Eq. de estado
do gás perfeito
Diagrama PV ou de Clapeyron
Estado 2
P2
Estados
intermédios de
equilíbrio Estado 1
P1
V2
V1
Processo
termodinâmico
Transformação de um estado de equilíbrio
do sistema noutro estado de equilíbrio,
por variação das propriedades termodinâmicas do sistema.
Exemplo: Expansão/compressão
de um gás ideal
GÁS IDEAL: SUPERFÍCIE PVT
Cada estado de equilíbrio é
representado por um ponto na
superfície PvT e cada ponto na
superfície representa um
estado de equilíbrio possível.
Processo isocórico
Processo isotérmico
Processo isobárico
Leis de Gay-Lussac:
P const.T
v const.T
(rectas)
Lei de Boyle-Mariotte:
Pv const.
(hipérboles
equiláteras)
Gás de van der Waals
a
P 2 v b RT
v
Eq. de van der Waals
(as constantes a e b variam com o tipo de gás)
volume finito das moléculas volume disponível para o mov. das molec. = v – b
P(v-b) = RT
forças intermoleculares P = RT/(v-b) - P, com P = a/v2
v
F
Na colisão das moléculas do gás com qualquer superfície,
as forças atractivas das moléculas não estão
contrabalançadas e têm por efeito diminuir a velocidade
de colisão. O termo que se adiciona à pressão tem por
efeito restabelecer o valor que existiria na ausência de
forças atractivas.
ENERGIA E PRIMEIRO PRINCÍPIO
Energia total de um sistema
E
Emec
Eint
U
Ec E p macrosc Ec E p moléculas
Ex: Sistema de n moles de partículas num campo gravítico
1
2
E mvCM mghCM U
2
mnM
M massa molar
Consideraremos sistemas cujo movimento de conjunto é
nulo ou quase nulo e cuja variação de energia potencial
devido a campos de forças externas é desprezável. Nesse
caso, E = U.
U pode variar como resultado de:
trabalho, W, realizado sobre o sistema
(U > 0) ou pelo sistema (U < 0)
calor, Q, que entra (U > 0) ou que sai do
sistema (U < 0)
Trabalho termodinâmico
num sistema PVT
Fe força externa
W Fe dx
Fe
dx
Pe Adr PedV
+
compressão (dV < 0) trabalho da força externa é
positivo
expansão (dV > 0) trabalho da força externa é
negativo
Trabalho infinitesimal
-
W Pe dV
dV 0 (expansão) : trabalho realizado pelo sistema
dV 0 (compressão) : trabalho realizado sobre o sistema
Processo quase-estático
Pe P
em todas as configurações de equilíbrio
W P dV
W PV F2 L3 F L
L
Unidade SI de trabalho: Joule (J)
+
Trabalho termodinâmico, num processo que leva o
sistema do estado 1 ao estado 2
2
W P dV ;
P P (V )
1
V2
W P (V ) dV
V1
dA P dV
A
V2
A P (V ) dV
V1
diagrama P-V ou de Clapeyron
Expansão
W A
Trabalho termodinâmico, num processo que leva o
sistema do estado 2 ao estado 1
V1
V2
V2
V1
W P (V ) dV P (V ) dV
A
V2
A P (V ) dV
V1
Compressão
WA
Em geral: o trabalho é uma função do processo;
não depende apenas dos estados 1 e 2
A1-A2
A1
WI P(V ) dV
A2
WII P(V ) dV
I
II
W
P (V ) dV
P (V ) dV P (V ) dV
I
A1 A2 0
II
Caso particular: o trabalho adiabático depende
apenas dos estados 1 e 2
O trabalho adiabático sobre um sistema termodinâmico
só depende dos estados inicial e final e não do
processo realizado entre esses dois estados.
Podemos, por isso, definir a função de estado
energia interna tal que
Wadia Uf Ui U
Num processo não-adiabático, o trabalho realizado
sobre um sistema entre os estados inicial (i) e final
(f) é diferente do trabalho adiabático realizado entre
os mesmos estados (i) e (f). A diferença entre ambos
é o calor trocado durante o processo:
Q Wadia W Q U W U W Q
Formulação matemática da 1ª Lei
Calor e Trabalho
U W Q
Primeira Lei:
A energia interna de um sistema fechado pode variar:
por trocas de trabalho com a vizinhança
por trocas de calor com a vizinhança
Capacidades térmicas
Capacidade térmica
Quantidade de calor que é necessário fornecer
ao sistema (lentamente), para que a temperatura
do sistema aumente de 1 kelvin.
T T+T
Sistema
Q
Q
Q
C lim
T 0 T
dT
Mas a quantidade de calor fornecida é uma função do
processo (ou caminho) ...
CP
CV
QP
Q capacidade térmica a pressão constante
dTP dT P
QV
Q
capacidade térmica a volume constante
dTV
dT
V
CP
CV
coeficiente adiabático
C
c
n
Capacidade térmica molar
e
c
C
m
Capacidade térmica mássica
(ou calor específico)
CP e CV para um gás ideal
Sistemas ideais U=U(T)
U CVT
eq. da energia interna para o gás ideal
C P CV nR
CP
CV
coef. adiabático
Equação da adiabática para um gás ideal
Processo infinitesimal dum gás ideal
Q
dU PdV
CV dT PdV
nRT
CV dT
dV
V
Processo adiabático infinitesimal dum gás ideal
0 CV
dT
dV
nR
T
V
CV ln T (C P CV ) ln V const
ln T ( 1) ln V const
ln T ln V 1 const
TV 1 const
PV const
Adiabática :
P
P
1
P const .V
const
.
V
V
V
V adia
Isotérmica :
P
P
2
P const .V 1
const .V
V
V T
O declive da adiabática num ponto (P,V) é vezes o declive da
isotérmica que passa nesse ponto.