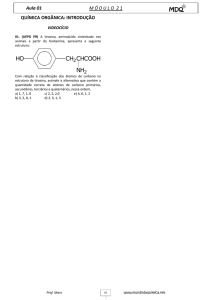
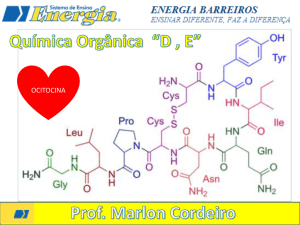
Química da vida:
química orgânica e biológica.
Professor: Élcio
Alunos: Vagner Vinícius Miyazato, 14472
Renan Morales de Góes, 14464
Tópicos:
Introdução à Química Orgânica.
Classificação das Cadeias Carbônicas.
Nomenclatura Orgânica.
Petróleo.
Funções da Química Orgânica.
Alcanos, Alcenos e Alcinos.
Tipos Isomerias.
Introdução à Bioquímica
Proteínas
Carbohidratos
Ácidos Nucléicos
Introdução à Química Orgânica
Em geral, compostos orgânicos são substâncias
que contêm átomos de carbono.
Características do carbono constituem a chave
estrutural dos bilhões de compostos orgânicos.
Exemplos de compostos orgânicos utilizados
em nosso dia-a-dia: algodão, lã, seda, náilon,
poliéster; combustíveis derivados de petróleo,
carvão e gás natural; cosméticos, perfumes;
borrachas, plásticos e inseticidas.
Friedrich Wöhler
Em 1828, o alemão Friedrich
Wöhler obteve uma substância
orgânica a partir de uma
inorgânica.
Átomos Organógenos
São átomos que constituem os compostos
orgânicos: C, N, O, H, Cl etc.
Propriedades Especiais do Carbono
Possuem a propriedade de ligarem entre si.
Podem formar ligações simples, duplas ou
triplas.
Freqüentemente formam grandes cadeias.
Classificação das Cadeias Carbônicas
Cadeia saturada: somente ligações simples
entre carbonos.
Cadeia insaturada: pelo menos uma dupla ou
tripla entre carbonos.
De acordo com a composição:
Cadeia homogênea: a seqüência de átomos não
é interrompida por átomos de outros elementos
químicos.
Cadeia heterogênea: apresenta pelo menos um
átomo diferente de carbono interrompendo.
De acordo com a forma:
Cadeia aberta: não apresenta ciclos.
Cadeia fechada ou cíclica: apresenta ciclo(s).
Cadeias carbônicas aromáticas
Apresenta três ligações duplas e três simples
entre seis átomos de carbono em ciclo. Este
complexo fenômeno eletrônico denomina-se
ressonância eletrônica.
Simetria nos Anéis Aromáticos
orto-
meta-
para-
Nomenclatura Orgânica (IUPAC)
Três partes distintas, cada uma contendo uma
informação sobre o composto:
Nomenclatura de Hidrocarbonetos Simples
Hidrocarbonetos Insaturados e
Ramificados
Escolha a cadeia principal, numere os átomos de carbono;
os radicais são ordenados em ordem alfabética.
Petróleo
Mistura complexa de compostos orgânicos
principalmente hidrocarbonetos.
Funções da Química Orgânica
Função Química: conjunto de compostos que
possuem propriedades químicas semelhantes.
Grupo Funcional: é um grupo de átomos
responsável pelas propriedades comuns entre
compostos de uma função.
Álcoois
São compostos que apresentam o grupo (–OH),
denominado hidroxila, são muito solúveis em
solventes polares como a água.
Usa-se a terminação “ol”, quando necessário
numere os átomos para indicar a posição do grupo
funcional.
Fenóis
São compostos que apresentam uma hidroxila
(-OH) ligada ao um átomo de carbono benzênico.
Nomenclatura dos fenóis:
Aldeídos
São compostos que apresentam uma carbonila
em um carbono primário.
O mais simples representante é o metanal ou
formaldeído, usado na conservação de cadáveres.
Exemplo de Nomenclatura:
Cetonas
Compostos carbonílicos, com grupo carbonila
em um carbono secundário.
Usa-se o sufixo “ona” de cetona.
A numeração é necessária a partir de cinco
átomos de carbono na cadeia principal.
Exemplo de Nomenclatura:
Ácidos Carboxílicos
Possuem uma carbonila unida a uma carboxila,
(-COOH).
É indicada pelo sufixo “óico” e a numeração
sempre que necessária é realizada a partir da
carboxila.
Os ácidos carboxílicos são extremamente comuns na
natureza, quando a cadeia carbônica for maior que
11 carbonos é considerado como um ácido graxo,
importante na síntese de lipídeos.
Ésteres
São derivados dos ácidos carboxílicos pela
substituição do (– H) da (–COOH) por um radical
orgânico (–R).
Nomenclatura:
Exemplo de Nomenclatura:
Sais de Ácidos Carboxílicos
Compostos iônicos, formados na reação entre
ácido (neste caso carboxílico) com uma base.
Amidas
São derivados de ácidos carboxílicos pela
substituição do (–OH) da (–COOH) por grupos de um
átomos de nitrogênio (–NH2, –NHR ou –NRR).
Éteres
Caracterizados pela presença de oxigênio
(– O –) entre dois átomos de carbono.
Aminas
Derivadas da amônia (NH3).
A nomenclatura: escreve-se os radicais (R, R’,
R”) ligados ao nitrogênio seguidos da palavra
amina.
Exemplo de Nomenclatura:
Haletos Orgânicos
São compostos orgânicos com pelo menos um
átomo de halogênio.
Exemplo de Nomenclatura:
Alcanos
Ligações simples entre “carbonos”.
Possuem fórmula geral CnH2n+2
Ex: Propano (C3H8) – gás de cozinha (GLP).
Alcenos
Possuem
dupla ligação entre “carbonos”.
Possuem fórmula geral CnH2n
Etileno (C2H4), substância utilizada para maturação de
frutos.
Alcinos
Possuem
tripla ligação entre “carbonos”.
Possuem fórmula geral CnH2n-2
Etino (C2H2), conhecido como acetileno, gás utilizado
para solda industrial.
Isomeria Plana
Podem ser diferenciados com o uso de
fórmulas estruturais planas.
A Isomeria Plana é classificada e subdividida em :
1. Isomeria Funcional.
2. Isomeria de Cadeia
3. Isomeria de Posição
1. Isomeria Funcional
Neste caso os isômeros possuem
diferentes funções químicas.
2. Isomeria de Cadeia
Neste caso os isômeros pertencem à
mesma função química, mas diferem na
cadeia carbônica.
3. Isomeria de Posição
Possuem a mesma função e o mesmo tipo de
cadeia, mas diferem na posição de radical(ais)
de insaturação(ões) ou grupo(s) na cadeia
carbônica.
Isomeria Espacial
Possuem a mesma fórmula molecular e
estrutural plana e somente podem ser
diferenciados por fórmulas estruturais espaciais
Isomeria Espacial Geométrica (Cis-Trans).
Condições mínimas para ocorrência:
Existência de uma dupla ligação.
Cada carbono da dupla ligação está ligado a grupos diferentes.
Modelos Espaciais
Diferenças nas Propriedades Físicas
Compostos Cíclicos Saturados
Cadeia cíclica saturada.
Dois átomos de carbono do ciclo com radicais
diferentes.
Isomeria Espacial Óptica
Moléculas assimétricas, presença do
“Carbono Quiral” (C*), caracterizado por estar
ligado a quatro ligantes diferentes.
Compostos Opticamente Ativos
Introdução à Bioquímica
Química dos organismos vivos.
Sintetizadas a partir de moléculas mais
simples.
Muitas são biopolímeros e podem ser
caracterizadas em três categorias:
1.
2.
3.
Proteínas.
Polissacarídeos(carboidratos).
Ácidos Nucléicos.
Proteínas
Macromoléculas
presentes em células
vivas.
Principal componente estrutural (pele,
unha, cartilagens e pelos).
Catalisam reações e regulam processos
específicos.
Compostas por aminoácidos*.
Aminoácidos*
Diferem entre si pelo grupo “R”.
*Os polipeptídios são
formados quando
ocorre grande número
de ligações peptídicas
entre aminoácidos.
Ligação peptídica:
Carboidratos
Nome
vem de Hidrato de Carbono, que
vem da formula mínima das substâncias
que podem ser escritas na forma
Contêm
São
função aldeído e cetonas.
classificados como monossacarídeos,
dissacarídeos e polissacarídeos.
Monossacarídeos
Glicose e frutose são exemplos de
monossacarídeos, que são açúcares simples,
que não podem ser quebrados em moléculas
menores por hidrólise
Dissacarídeos
São
formados a partir da ligação de dois
monossacarídeos através de ligações
especiais denominadas "Ligações
Glicosídicas“.
Polissacarídeos
São macromoléculas
formadas por milhares
de unidades monossacarídicas, ligadas
entre si por ligações glicosídicas, unidas
em longas cadeias lineares ou
ramificadas.
Ácidos Nucléicos
Os ácidos nucléicos são uma classe de
biopolímeros transportadores das informações
genéticas do organismo.
Moléculas constituídas por unidades menores
denominadas nucleotídeos, que são constituídas
por ácido fosfórico ligado a uma pentose.
Podem ser de dois tipos: ribose e desoxirribose.
Referências bibliográficas
Química: A ciência central - 9ª edição
Theodore L. Brown
H. Eugene LeMay , Jr.
Bruce E. Bursten
Julia R. Burdge
Richey Jr., Herman G. - Química Orgânica. 1983. Pretice-Hall, Rio
de Janeiro.
Apostila ETAPA
Referências da Internet
www.wikipedia.com
www.prenhall.com/brown_br