Sinalização Intracelular – PKB/Akt
Costa A., Gomes J., Negrões S., Português J. e Sá M.J.
Faculdade de Medicina da Universidade do Porto, Serviço de Biologia Celular e Molecular
Introdução
Todas as células contêm complexas redes de uma classe de proteínas, proteínas cínases,
que actuam como “sensores” no controlo e propagação de informação do meio exterior e na
organização do seu próprio sistema, permitindo manter uma resposta rápida e apropriada
às alterações a que são sujeitas. 5
A função das proteínas cínases é transferir um fosfato terminal do ATP para um destes
três aminoácidos. Existem duas famílias de proteínas cínases, que podem ter especificidade
quer para treoninas/serinas como para a tirosinas, responsáveis pela sinalização
intracelular. Estas famílias de cínases dividem-se em subclasses que incluem enzimas com
funções semelhantes. Estas podem ser dependentes de nucleótidos cíclicos (PKA e PKG),
de diacilglicerol (PKC), e activadas por mitogénio (ERK1). 6
Nas células existe um mecanismo de morte celular programada, denominado apoptose,
que compensa o crescimento celular anormal. 6
Por vezes há uma perturbação da transdução de sinal ou dos outros sinais celulares que
regulam a actividade celular, originando um crescimento celular desregulado – neoplasia.
Esta pode ser benigna, quando não tem características invasivas, ou maligna quando
invade os tecidos periféricos- metastização- podendo atingir locais bastante distantes da
zona da neoformação. 6
Certas classes de proteínas e cascatas sinalizadoras são alvos muito frequentes de
mutações oncogénicas. O facto de múltiplos factores de crescimento poderem contribuir
para o desenvolvimento ou progressão do cancro, mostra a importância de compreender
como são transcritos os sinais dos mesmos factores nas células do cancro do cólon de
modo a chegar a uma terapêutica. 4
A PKB é uma cínase específica para treoninas/serinas que se encontra inactiva nas
células em descanso, tornando-se activa após fosforilação. A fosforilação da PKB acentua a
proliferação das células cancerígenas e metastização e contribui para a resistência à
quimioterapia e radioterapia, tendo um papel primordial no desenvolvimento e progressão
do cancro do cólon, ao promover o crescimento celular e ao evitar que ocorra apoptose. 2
PKB/Akt
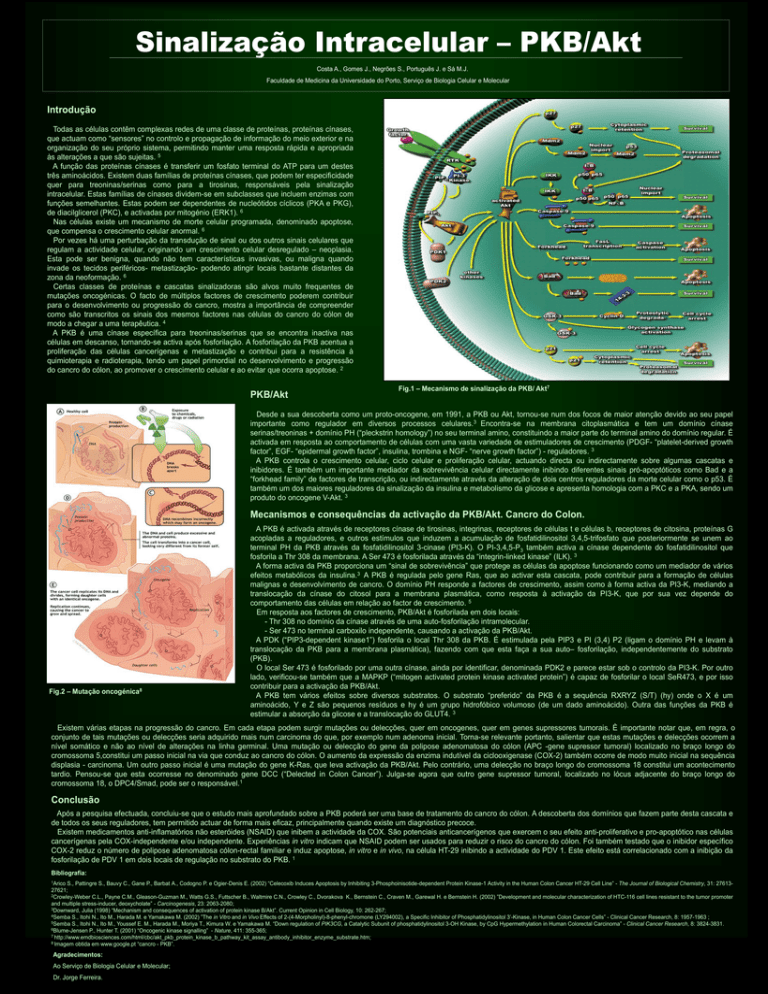
Fig.1 – Mecanismo de sinalização da PKB/ Akt7
Desde a sua descoberta como um proto-oncogene, em 1991, a PKB ou Akt, tornou-se num dos focos de maior atenção devido ao seu papel
importante como regulador em diversos processos celulares.3 Encontra-se na membrana citoplasmática e tem um domínio cínase
serinas/treoninas + domínio PH (“pleckstrin homology”) no seu terminal amino, constituindo a maior parte do terminal amino do domínio regular. É
activada em resposta ao comportamento de células com uma vasta variedade de estimuladores de crescimento (PDGF- “platelet-derived growth
factor”, EGF- “epidermal growth factor”, insulina, trombina e NGF- “nerve growth factor”) - reguladores. 3
A PKB controla o crescimento celular, ciclo celular e proliferação celular, actuando directa ou indirectamente sobre algumas cascatas e
inibidores. É também um importante mediador da sobrevivência celular directamente inibindo diferentes sinais pró-apoptóticos como Bad e a
“forkhead family” de factores de transcrição, ou indirectamente através da alteração de dois centros reguladores da morte celular como o p53. É
também um dos maiores reguladores da sinalização da insulina e metabolismo da glicose e apresenta homologia com a PKC e a PKA, sendo um
produto do oncogene V-Akt. 3
Mecanismos e consequências da activação da PKB/Akt. Cancro do Colon.
Fig.2 – Mutação oncogénica8
A PKB é activada através de receptores cínase de tirosinas, integrinas, receptores de células t e células b, receptores de citosina, proteínas G
acopladas a reguladores, e outros estímulos que induzem a acumulação de fosfatidilinositol 3,4,5-trifosfato que posteriormente se unem ao
terminal PH da PKB através da fosfatidilinositol 3-cinase (PI3-K). O PI-3,4,5-P3 também activa a cínase dependente do fosfatidilinositol que
fosforila a Thr 308 da membrana. A Ser 473 é fosforilada através da “integrin-linked kinase” (ILK). 3
A forma activa da PKB proporciona um “sinal de sobrevivência” que protege as células da apoptose funcionando como um mediador de vários
efeitos metabólicos da insulina.3 A PKB é regulada pelo gene Ras, que ao activar esta cascata, pode contribuir para a formação de células
malignas e desenvolvimento de cancro. O domínio PH responde a factores de crescimento, assim como à forma activa da PI3-K, mediando a
translocação da cínase do citosol para a membrana plasmática, como resposta à activação da PI3-K, que por sua vez depende do
comportamento das células em relação ao factor de crescimento. 5
Em resposta aos factores de crescimento, PKB/Akt é fosforilada em dois locais:
- Thr 308 no domínio da cínase através de uma auto-fosforilação intramolecular.
- Ser 473 no terminal carboxilo independente, causando a activação da PKB/Akt.
A PDK (“PIP3-dependent kinase1”) fosforila o local Thr 308 da PKB. É estimulada pela PIP3 e PI (3,4) P2 (ligam o domínio PH e levam à
translocação da PKB para a membrana plasmática), fazendo com que esta faça a sua auto– fosforilação, independentemente do substrato
(PKB).
O local Ser 473 é fosforilado por uma outra cínase, ainda por identificar, denominada PDK2 e parece estar sob o controlo da PI3-K. Por outro
lado, verificou-se também que a MAPKP (“mitogen activated protein kinase activated protein”) é capaz de fosforilar o local SeR473, e por isso
contribuir para a activação da PKB/Akt.
A PKB tem vários efeitos sobre diversos substratos. O substrato “preferido” da PKB é a sequência RXRYZ (S/T) (hy) onde o X é um
aminoácido, Y e Z são pequenos resíduos e hy é um grupo hidrofóbico volumoso (de um dado aminoácido). Outra das funções da PKB é
estimular a absorção da glicose e a translocação do GLUT4. 3
Existem várias etapas na progressão do cancro. Em cada etapa podem surgir mutações ou delecções, quer em oncogenes, quer em genes supressores tumorais. È importante notar que, em regra, o
conjunto de tais mutações ou delecções seria adquirido mais num carcinoma do que, por exemplo num adenoma inicial. Torna-se relevante portanto, salientar que estas mutações e delecções ocorrem a
nível somático e não ao nível de alterações na linha germinal. Uma mutação ou delecção do gene da polipose adenomatosa do cólon (APC -gene supressor tumoral) localizado no braço longo do
cromossoma 5,constitui um passo inicial na via que conduz ao cancro do cólon. O aumento da expressão da enzima indutível da ciclooxigenase (COX-2) também ocorre de modo muito inicial na sequência
displasia - carcinoma. Um outro passo inicial é uma mutação do gene K-Ras, que leva activação da PKB/Akt. Pelo contrário, uma delecção no braço longo do cromossoma 18 constitui um acontecimento
tardio. Pensou-se que esta ocorresse no denominado gene DCC (“Delected in Colon Cancer”). Julga-se agora que outro gene supressor tumoral, localizado no lócus adjacente do braço longo do
cromossoma 18, o DPC4/Smad, pode ser o responsável.1
Conclusão
Após a pesquisa efectuada, concluiu-se que o estudo mais aprofundado sobre a PKB poderá ser uma base de tratamento do cancro do cólon. A descoberta dos domínios que fazem parte desta cascata e
de todos os seus reguladores, tem permitido actuar de forma mais eficaz, principalmente quando existe um diagnóstico precoce.
Existem medicamentos anti-inflamatórios não esteróides (NSAID) que inibem a actividade da COX. São potenciais anticancerígenos que exercem o seu efeito anti-proliferativo e pro-apoptótico nas células
cancerígenas pela COX-independente e/ou independente. Experiências in vitro indicam que NSAID podem ser usados para reduzir o risco do cancro do cólon. Foi também testado que o inibidor específico
COX-2 reduz o número de polipose adenomatosa cólon-rectal familiar e induz apoptose, in vitro e in vivo, na célula HT-29 inibindo a actividade do PDV 1. Este efeito está correlacionado com a inibição da
fosforilação de PDV 1 em dois locais de regulação no substrato do PKB. 1
Bibliografia:
S., Pattingre S., Bauvy C., Gane P., Barbat A., Codogno P. e Ogier-Denis E. (2002) “Celecoxib Induces Apoptosis by Inhibiting 3-Phosphoinisotide-dependent Protein Kinase-1 Activity in the Human Colon Cancer HT-29 Cell Line” - The Journal of Biological Chemistry, 31: 2761327621;
2Crowley-Weber C.L., Payne C.M., Gleason-Guzman M., Watts G.S., Futtscher B., Waltmire C.N., Crowley C., Dvorakova K., Bernstein C., Craven M., Garewal H. e Bernstein H. (2002) ”Development and molecular characterization of HTC-116 cell lines resistant to the tumor promoter
and multiple stress-inducer, deoxycholate” - Carcinogenesis, 23: 2063-2080;
3Downward, Julia (1998) “Mechanism and consequences of activation of protein kinase B/Akt”. Current Opinion in Cell Biology, 10: 262-267;
4Semba S., Itohi N., Ito M., Harada M. e Yamakawa M. (2002) ”The in Vitro and in Vivo Effects of 2-(4-Morpholinyl)-8-phenyl-chromone (LY294002), a Specific Inhibitor of Phosphatidylinositol 3’-Kinase, in Human Colon Cancer Cells” - Clinical Cancer Research, 8: 1957-1963 ;
5Semba S., Itohi N., Ito M., Youssef E. M., Harada M., Moriya T., Kimura W. e Yamakawa M. “Down regulation of PIK3CG, a Catalytic Subunit of phosphatidylinositol 3-OH Kinase, by CpG Hypermethylation in Human Colorectal Carcinoma” - Clinical Cancer Research, 8: 3824-3831.
6Blume-Jensen P., Hunter T. (2001) “Oncogenic kinase signalling” - Nature, 411: 355-365;
7 http://www.emdbiosciences.com/html/cbc/akt_pkb_protein_kinase_b_pathway_kit_assay_antibody_inhibitor_enzyme_substrate.htm;
8 Imagem obtida em www.google.pt “cancro - PKB”.
1Arico
Agradecimentos:
Ao Serviço de Biologia Celular e Molecular;
Dr. Jorge Ferreira.