LISTA DE EXERCÍCIO QUÍMICA GERAL
Nome do Aluno:_______________________Data entrega:___________
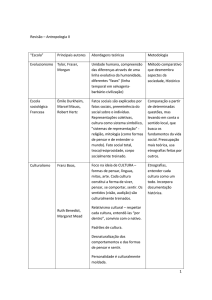
1) Consulte um livro de química geral e responda qual das substâncias abaixo é uma base forte
(dissociação total) e qual é uma base fraca (dissociação parcial, portanto tem Kb). No caso de bases
fracas, anote do lado o valor do Kb encontrado no livro que você consultou e transforme o valor
em pKb.
Base
Forte ou Fraco?
Kb (base fraca) pKb (base fraca)
Amônia
uréia
Hidroxilamina, NH2OH
NaOH(aq)
Trimetilamina, (CH3)3N
Metilamina, CH3NH2
KOH(aq)
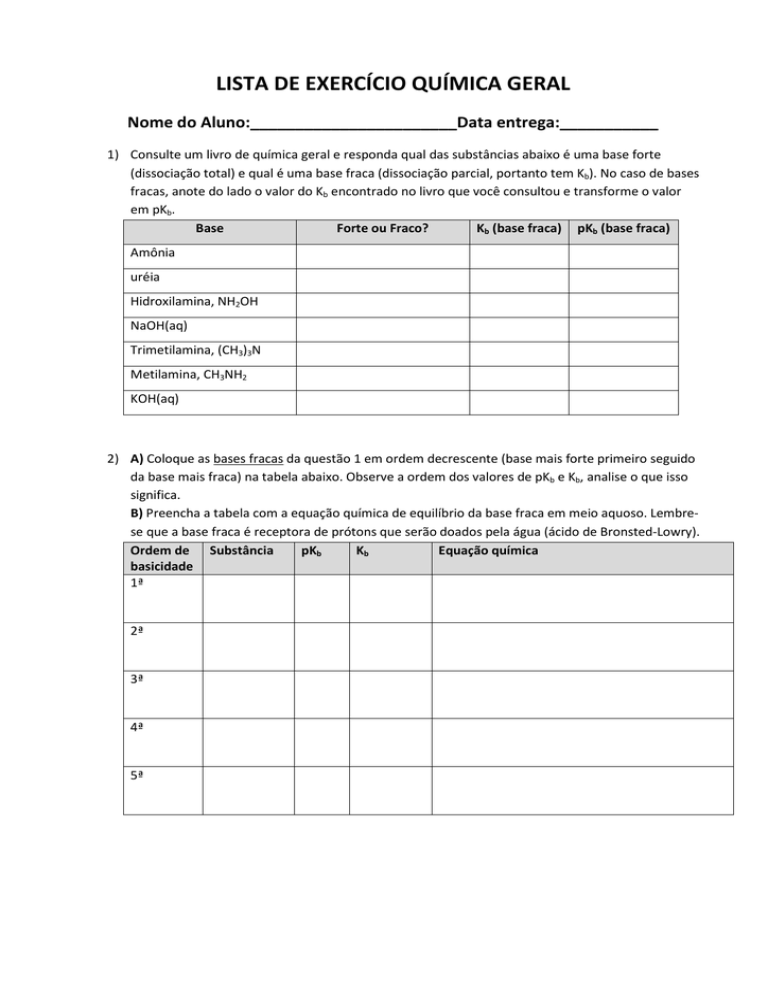
2) A) Coloque as bases fracas da questão 1 em ordem decrescente (base mais forte primeiro seguido
da base mais fraca) na tabela abaixo. Observe a ordem dos valores de pKb e Kb, analise o que isso
significa.
B) Preencha a tabela com a equação química de equilíbrio da base fraca em meio aquoso. Lembrese que a base fraca é receptora de prótons que serão doados pela água (ácido de Bronsted-Lowry).
Ordem de Substância
pKb
Kb
Equação química
basicidade
1ª
2ª
3ª
4ª
5ª
C) considere que cada uma destas bases fracas foi dissolvida em água, formando uma solução 0,10
mol/L. Represente béquers contendo esta solução e mostre quais sãos as espécies químicas
presentes.
1º
2º
3º
4º
5º
6º
D) Qual destes béquers terá maior população de moléculas de ácido conjugado em equilíbrio?
Qual destes béqueres terá menor população de ácido conjugado em equilíbrio? Você percebe a
relação com pKb?
Resposta:
E) Preencha a tabela abaixo com a base e seu respectivo ácido conjugado formado (a partir do
item C) e preencha o respectivo valor de pKa deste ácido conjugado (dica: calcule o pKa do ácido
conjugado a partir do pKb da base). Transforme pKa em Ka.
Analise criticamente os valores de pKa e pKb com a força da base (ordem de basicidade do item B).
Ordem Base
1º
2º
3º
4º
5º
pKb
Respectivo ácido
conjugado
pKa
Ka
F) Qualitativamente avalie qual destas soluções aquosas de bases de mesma concentração terá o
pH mais elevado e a base que terá o menor pH? Qual é mais alcalina? Tem alguma relação com o
pKb e Kb?
Resposta:
G) Agora confira sua resposta do item F. Para isso calcule o pOH e pH de soluções aquosas 0,10
mol/L de cada uma destas bases fracas.
Considere para todos os casos que (0,10 –x) = 0,10, pois o valor de x é muito pequeno!
Preencha a tabela abaixo. No final, observe se há alguma relação entre pKb, pOH e pH.
Ordem Base
pKb
[OH-]
pOH
[H3O+]
pH
1º
2º
3º
4º
5º
H) Qual será o pH das soluções aquosas de base forte, ver questão 1, se suas concentrações forem
0,10 mol/L? Compare com os valores de pH do item G, a diferença faz sentido?
Resposta:
I) Agora suponha que a base fraca mais forte (1ª no ranqueamento) terá seu equilíbrio perturbado
pela adição de HCl. Escreva a reação química de dissociação da base (na ausência de HCl, portanto
a mesma do item B) e responda como o equilíbrio será deslocado (para produtos ou reagentes) ao
adicionar HCl. O pH da solução após adição do ácido irá aumentar ou diminuir?
Entenda o papel do HCl em presença da base e escreva a nova reação química (base+HCl
reagindo).
J) Se várias alíquotas de HCl forem adicionados e o pH medido criaremos uma curva de titulação
potenciométrica, conforme modelo abaixo:
Suponha que você colocou no erlenmeyer
erle
40 mL de uma solução aquosa da base fraca mais forte (1ª no
ranqueamento), cuja concentração é desconhecida. Na bureta você colocou a solução padrão de HCl 0,10
mol/L. O pH da solução no erlenmeyer
meyer foi monitorado por um pHmetro. A cada alíquota de ácido
adicionado ao erlenmeyer
meyer você registrou o pH e criou a curva
curv de titulação acima.
Com base nestas informações e no gráfico qual é a concentração da base que você utilizou?
Resposta:
K)Represente
Represente as espécies químicas presentes no erlenmeyer
erle
nas situações
tuações A (sem adição de ácido), B e C
(ilustrados na curva de titulação potenciométrica acima).Avalie
acima)
se as espécies previstas
revistas estão condizentes
com o pH registrado.
A
B
C