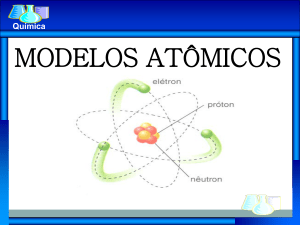
Modelos atômicos
. . . do começo aos nossos dias
CURSO DE FÍSICA E QUÍMICA
Professores Gustavo e Luiz Antônio
Átomo: indivisível
Surgido praticamente de
forma intuitiva, o conceito
de átomo teve sua origem
na Grécia Antiga (há 2400
anos) com os filósofos
Demócrito, Leucipo. Não
tendo base científica, tais
gregos imaginavam um
modelo atômico no qual o
átomo fosse indestrutível,
imutável.
Pensamento aristotélico
Ainda na Grécia antiga
surgiu algum tempo
depois a teoria dos
quatro elementos, que
foi apoiada por
Aristóteles.
Terra, ar, fogo, água
Aristóteles divagando em seus
pensamentos tenta integrar os
quatro elementos . . .
"Da terra passamos à água
pelo frio.
Da água passamos ao ar
pela via úmida.
Do ar passamos ao fogo
pelo calor.
Do fogo passamos à terra
pela via seca."
O tempo passa . . .
Graças a isso, o
atomismo de
Demócrito e Leucipo
perdeu força e . . .
. . . permaneceu em
descrédito durante
muitos séculos.
*O mundo muçulmano continuou acreditando no atomismo.
Séculos depois, surgem os modelos atômicos . . .
. . . Dalton
. . . Thomson
. . . Rutherford
. . . Bohr
. . . Sommerfeld
. . . Modelo atual
Um modelo experimental
John Dalton propõe um
modelo atômico que ficou
conhecido por “bola de bilhar”,
por lembrar uma bola maciça e
indivisível, foi suficiente para
explicar as reações químicas
como sendo um “rearranjo”
entre os átomos.
John Dalton
(1766-1844)
“Bola de Bilhar”
Modelo de Dalton.
(1808)
Eletricidade é realidade
Thomson sugeriu que o átomo
seria formado por uma esfera
positiva “incrustada” de
elétrons (carga elétrica
negativa). A conclusão de que
a esfera deveria ser positiva
está relacionada ao fato de os
átomos apresentarem carga
elétrica total nula.
Joseph Thomson
(1856-1940)
“Pudim de Ameixas”
O grande mérito de Thomson
foi admitir (e comprovar) que o
átomo seria divisível.
Modelo de Thomson.
(1897)
Experimento de Thomson
Os raios catódicos – estudou a passagem de corrente elétrica
por um gás (rarefeito) no interior de um tubo de vidro, que
continha duas peças metálicas, uma positiva e outra negativa.
Esquema de funcionamento
(experimento de Thomson)
Importância...
J. J. Thomson demostrou, em 1897, a existência de
partículas carregadas negativamente, os elétrons. Os
átomos, portanto, são divisíveis!
Também, determinou a relação entre a carga e a massa dos
elétrons, demonstrando que esta relação era constante e
independente do material utilizado.
Modelos evoluem
Ernest Rutherford
(1871-1937)
Rutherford propôs o modelo
que admite um núcleo com
cargas elétricas positivas
(denominou-as prótons). Ao
redor, muitos distantes
estariam girando os elétrons
(negativos). Entre prótons e
elétrons haveria grande
espaço vazio.
“Planetário”
Modelo de Rutherford.
(1911)
Experimento de Rutherford
Rutherford bombardeou uma fina lâmina de ouro (0,0001 mm)
com partículas "alfa" (núcleo de átomo de hélio: 2 prótons e 2
nêutrons), emitidas pelo "polônio" (Po), contido num bloco de
chumbo (Pb), provido de uma abertura estreita, para dar
passagem às partículas "alfa" por ele emitidas.
Após a lâmina de ouro (Au), foi colocada uma tela protetora
revestida de sulfeto de zinco (ZnS).
Experimento de Rutherford
Esquema de funcionamento
Equipamento utilizado
Experimento de Rutherford
Explicação . . .
?
Conclusões de Rutherford
O átomo seria um imenso vazio, no qual o núcleo ocuparia
uma pequena parte, enquanto que os elétrons o circundariam
numa região negativa chamada de eletrosfera, modificando
assim, o modelo atômico proposto por Thomson.
Como ficou o modelo de Rutherford?
Um grande salto
Bohr formulou um modelo
atômico com elétrons girando em
orbitas circulares e somente a
determinadas distâncias do
núcleo (órbitas, camadas ou
níveis de energia).
Niels Bohr
(1885 -1962)
Níveis energia
Modelo de Bohr.
(1913)
núcleo
elétrons
órbita
Energia é o que importa
Saliente-se que um elétron
não pode permanecer entre
dois níveis de energia. Pode
“saltar” de níveis internos
para níveis externos, quando
absorve energia. Ao retornar,
devolve ao a energia
recebida, geralmente na
forma de luz.
Postulados de Bohr
Lei de Coulomb
Órbitas circulares
1º Postulado: Bohr admitiu que, tanto a lei de Coulomb
como as leis de Newton são ainda aplicáveis no
domínio atômico. Assim o elétron mover-se-á numa
orbita circular em volta do núcleo, sendo a força central
a responsável pelo movimento;
Postulados de Bohr
2º Postulado: fornecendo energia (elétrica, térmica, ....) a um
átomo, um ou mais elétrons a absorvem e saltam para níveis
mais afastados do núcleo. Ao voltarem as suas órbitas
originais, devolvem a energia recebida em forma de luz.
Absorção/devolução de energia
(modelo de Bohr)
Postulados de Bohr
A linha vermelha no espectro atômico
é causada por elétrons saltando
da terceira órbita para a segunda
órbita
Fogos de artifício
Os subníveis de energia
Sommerfeld aperfeiçoou o
modelo de Rutherford e de Bohr
admitindo não só a existência de
orbitas circulares, mas também
elípticas.
Isso permite explicar a existência
não só de níveis de energia, mas
também de subníveis.
Arnold Johannes Sommerfeld
(1868-1951)
Núcleo pesado
James Chadwick
descobriu/comprovou uma
outra partícula subatômica de
massa muito próxima à massa
do próton, mas sem carga
elétrica (neutra, portanto).
Essa partícula passou a ser
chamada nêutron e localizase no núcleo do átomo.
James Chadwick
(1891 -1974)
Trabalho de equipe
Modelo de
.Rutherford-Bohr- Sommerfeld
Chadwick.
(1932)
Modelo atual ou modelo de
nuvens eletrônicas
(modelo quântico).
Fundamentação
Dualidade da matéria de De Broglie.
Princípio da Incerteza de Heisenberg.
Equação de onda de Schrödinger.
Louis De Broglie
(1892-1987)
Werner Heisenberg
(1901-1976)
Erwin Schrödinger
(1887-1961)