Fluxo de energia
Primeira Lei da Termodinâmica
Energia: capacidade de realizar trabalho
Fluxo de energia
Primeira Lei da Termodinâmica
Trabalho:
sentido mecânico = mover um corpo contra uma força
opositora.
O trabalho (W) realizado é o produto da força (f) pela distância
do deslocamento (Δl)
W = f.Δl
Sentido biológico = deslocamento contra quaisquer das forças
que permitem aos seres vivos gerar potencial mecânico,
elétrico, osmótico ou químico.
Fluxo de energia
Primeira Lei da Termodinâmica
Energia potencial
Capacidade de realizar trabalho derivada da posição de um
objeto.
Fluxo de energia
Primeira Lei da Termodinâmica
A energia total é sempre conservada
ΔU = ΔQ+ΔW
Q = quantidade de calor absorvida pelo sistema
W = quantidade de trabalho realizado no sistema
U = energia líquida colocada no sistema (calor ou trabalho)
Fluxo de energia
Primeira Lei da Termodinâmica
•trabalho
• a variação da
energia interna de
um sistema é igual
à diferença entre o
calor transferido
para o sistema e o
trabalho executado
pelo sistema.
•Gás comprimido
por êmbolo
•Calor
Fluxo de energia
o sistema: é o objeto do estudo (meio de
reação,uma quantidade de um corpo puro, um ser
vivo,etc.)
meio externo; é o resto do universo (que poderá ser
limitado ao meio ambiente próximo)
Fluxo de energia
a fronteira entre o sistema e o meio externo
suas propriedades irão determinar quais trocas podem
existir entre o sistema e o meio externo:
sistema fechado: a fronteira não permite troca de matéria
sistema isolado: nenhuma troca de matéria ou energia entre
sistema e meio externo. É a bomba calorimétrica.
sistema aberto: trocas de matéria são possíveis entre sistema
e meio externo.
Ser vivo (sistema) que se alimenta no seu meio externo.
Fluxo de energia
Fluxo de energia
A execução de um trabalho corresponde a uma
variação de energia.
Mas nem toda variação de energia tem a
contrapartida de um trabalho realizado.
Um corpo pode transferir energia para outro devido a
diferenças de energia cinética média das suas
moléculas, ou seja, diferenças de temperaturas. Essa
transferência de energia sem trabalho físico visível é
denominada calor.
Fluxo de energia
Primeira Lei da termodinâmica = princípio da
conservação da energia
Se um sistema não troca energia com a vizinhança, o
sistema permanece com a mesma energia
A mudança da energia no sistema é a diferença
entre a energia perdida e ganha da vizinhança
Energia e trabalho são interconversíveis
Como isto ocorre numa planta???
.
Fluxo de energia
.
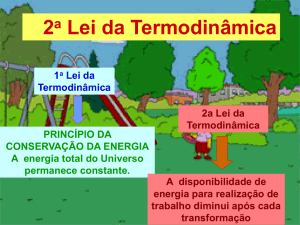
Fluxo de energia – segunda lei
Direção dos processos espontâneos
Na natureza, certos eventos têm um desfecho
previsível...
A maçã não voltará naturalmente à copa da árvore
Os processos tendem a ocorrer no sentido em que a
energia interna é menor
ΔU é negativo
Fluxo de energia
Há exceções:
Derretimento do gelo:
a 1 ºC o gelo derrete e a água na forma líquida tem energia
maior do que o gelo (houve aumento na energia livre??) – o
quê mais foi mudado?
Fluxo de energia
Entropia
quantidade de energia no sistema não disponível para
realizar trabalho, corresponde ao grau de
aleatoriedade do sistema
Fluxo de energia
Segunda Lei da Termodinâmica:
a entropia total sempre aumenta
ΔS = positivo = processo espontâneo
Fluxo de energia
A entropia está relacionada com a
temperatura
Alguma energia é armazenada nas vibrações e
oscilações dos átomos
ΔS = ΔQ / T
ΔQ = calor
T = temperatura
Capacidade de calor de um sistema
Quantidade de energia requerida para mudar em 1 ºC a
temperatura
Equilíbrio
Equilíbrio
Sem tendência de mudança (as forças que atuam
em sentidos opostos estão equilibradas)
Estado inicial
Equilíbrio
Energia livre e potencial químico
ΔG = energia livre (Gibbs) – máximo trabalho
que é possível realizar
ΔG≈ ΔU-T ΔS
ΔG = negativo (processo espontâneo)
A energia livre ao final será menor que no início do
processo
Um reação é dita exergônica se ΔG é
negativo.
As reações endergônicas necessitam de
energia externa.
No equilíbio ΔG=0
Energia livre e potencial químico
Processo espontâneo?
Reações Redox
Oxidação e redução referem-se à transferência
de elétrons entre um doador e um aceptor
Doador = oxidado (agente redutor)
Aceptor = reduzido
Reações Redox
2 Fe2+ ↔ 3 Fe3+ + 2 e- (oxidação do Ferro)
½ O2+2H++2e - ↔ H2O (redução da água)
2Fe2+ ½ O2+2H+ ↔ 3 Fe3+ + H2O
A tendência da substância doar ou receber
elétrons é medida pelo potencial redox
Reações Redox
Reações Redox
Potencial químico
1) Transporte de substâncias sem carga
elétrica entre dois compartimentos com
concentrações diferentes (C1 e C2)
depende de diferenças de potencial
químico (concentração):
o trabalho necessário para
movimentar 1 mol de soluto de C1
para C2 é dado por:
C2
G 2,3RT log
C1
C1
C2
C1
C2
Membrana
que permite
a passagem
somente do
soluto
Potencial eletroquímico
Se C1>C2 ∆G é negativo (processo natural)
C1
C2
Aumenta a entropia
Caso C2>C1 ∆G é positivo (processo endergônico – necessita
de energia)
C1
C2
Reduz a entropia
Potencial eletroquímico
2) Transporte de íons através de membrana: depende de
diferenças de potencial elétrico (cargas) e químico
(concentração).
A diferença entre as cargas no interior e exterior da membrana é
o potencial de membrana.
O trabalho para mover 1 mol de um íon de 1 para 2, contra
um potencial de membrana de ∆E volts é dado por: G
z = valência do íon, F é a constante de Faraday.
+
1
+
+
- +
- +
- +
- +
+
+
2
+
+
+
+
+
+
+
+
+
+
+
zFE
Potencial eletroquímico
O ∆G na figura é positivo (processo endergônico)
Na figura o cátion se move contra um potencial de
membrana (excesso de cargas positivas no interior da
célula) e contra a alta concentração do soluto no
interior da célula.
+
1
+
+
+
- +
- +
- +
+
+
2
+
+
+
+
+
+
+
+
+
+
+
Potencial eletroquímico
O acúmulo de cátions numa célula ou
compartimento desta é chamado de força
próton motora
C2
G zFE 2,3RT log
C1
Potencial
elétrico
Potencial
químico
Potencial eletroquímico
Complexo ATP-sintase
Enzima
Membrana
H+ acumulado no
Interior do tilacóide