LIGAÇÕES QUÍMICAS
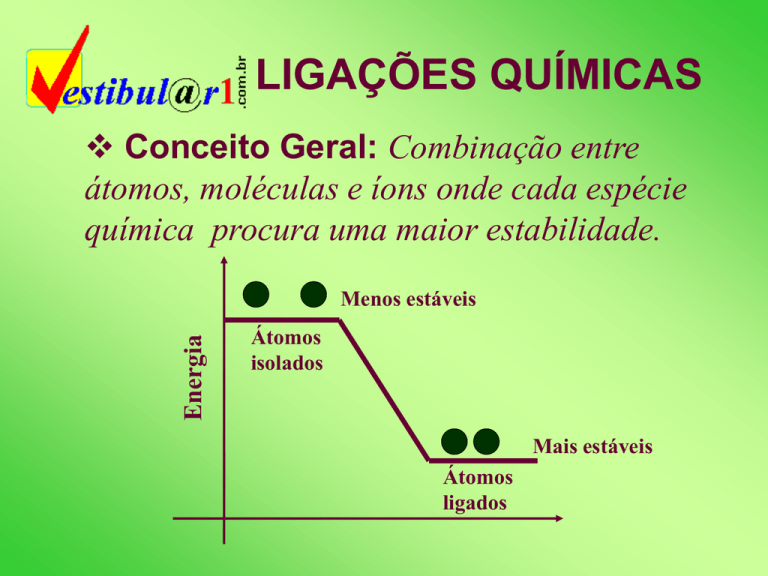
Conceito Geral: Combinação entre
átomos, moléculas e íons onde cada espécie
química procura uma maior estabilidade.
Energia
Menos estáveis
Átomos
isolados
Mais estáveis
Átomos
ligados
Definições
Estado Natural dos Átomos: encontrados
na natureza combinados de modo a adquirir maior
estabilidade.
Estabilidade química: precisam completar
seus orbitais incompletos perdendo ou ganhando
elétrons.
Camada de Valência: em geral as ligações
químicas envolvem apenas a última camada do
átomo.
Regra do Octeto
Descrição: O átomo adquire estabilidade
ao completar oito elétrons camada de
valência, imitando os gases nobres.
Configuração Geral: ns2 np6
Obs. Esta regra só é válida para os elementos
representativos. Exceção para o H, Li, B e Be.
Regra do Dueto
Descrição: O átomo adquire estabilidade
ao completar a camada de valência com dois
elétrons, imitando o gás nobre - He.
Configuração Geral: ns2
Obs. Esta regra só é válida para os elementos
representativos: H, Li, B e Be.
TIPOS DE LIGAÇÃO
IÔNICA ou ELETROVALENTE
COVALENTE ou MOLECULAR:
- Simples
- Dativa
INTERMOLECULAR
METÁLICA
LIGAÇÃO IÔNICA
Definição: elétrons são transferidos de um átomo
para outro dando origem a íons de cargas contrárias que
se atraem.
Exemplo: formação do cloreto de sódio – NaCl.
Na (Z = 11) 1s2) 2s2, 2p6) 3s1
Cl ( Z = 17) 1s2) 2s2, 2p6) 3s2, 3p5
Na
Cl
Na+
Cl-
Ligação Iônica
Configuração dos Átomos:
Na
Cl
Ligação Iônica
Transferência do elétron:
Na
Cl
Ligação Iônica
Formação dos íons:
Na+
Cl-
Ligação Iônica
Atração Eletrostática:
Na+
Cl-
Ligação Iônica
Atração Eletrostática:
Na+
Cl-
Ligação Iônica
Aglomerado Iônico ou Retículo Cristalino:
Fórmula dos Compostos
Iônicos
[A]
[B ]
+X
-Y
Y
X
Cargas = + xy – xy = zero
Exemplos:
Ca+2 + Br-1 CaBr2
AL+3 + S-2
Al2S3
Ligações dos Grupos - A
Grupo Carga Grupo Carga
1A
+1
5A
-3
2A
+2
6A
-2
3A
+3
7A
-1
Exemplos:
a) K+Cl- KCl
c) Al+3S-2 Al2S3
b) Ca+2I-1 CaI2
d) Fe+3O-2 Fe2O3
Características dos
Compostos Iônicos
Sólidos a temperatura ambiente.
Ponto de Fusão e Ebulição muito
elevados.
Conduzem corrente elétrica fundidos ou
em solução aquosa.
Melhor solvente é a água.
Participantes dos
Compostos Iônicos
Metal com: - Hidrogênio
- Semimetal
- Ametal
- Radical salino (SO4-2)
Radical Catiônico (NH4+) com os ânions
listados para os metais.
Exercícios de fixação:
Página - 55
1. Para que haja uma ligação iônica é necessário que:
a) O potencial de ionizção dos átomos participantes tenha
valores próximos.
b) A eletronegatividade dos átomos participantes tenha
valores próximos.
c) a eletronegatividade dos átomos participantes tenha
valores bastantes diferentes.
d) Os életrons de ligação sejam de orbitais s.
e) As afinidades eletrônicas sejam nulas.
2. Átomos do elemento X (número atômico = 20) e do
elemento Y (número atômico = 7) unem-se por ligações
iônicas originando o composto de fórmula:
a) XY
b) X2Y
c) X3Y2 d) X2Y3 e) X3Y4
Exercícios de fixação:
3. Os compostos iônicos, como o cloreto de sódio,
apresentam as propriedades:
a) Líquidos nas condições ambientais, bons condutores de
eletricidade e baixo ponto de fusão.
b) Líquidos ou gasosos, maus condutores de eletricidade
em solução aquosa e baixo ponto de fusão.
c) Sólidos, maus condutorers de eletricidade em solução
aquosa e baixo ponto de fusão.
d) Sólidos, bons condutores de eletricidade no estado
sólido e alto ponto de fusão.
e) Sólidos, bons condutores de eletricidade em solução
aquosa e elevado ponto de fusão.
LIGAÇÃO COVALENTE
OU MOLECULAR
Definição: Ocorre através do compartilhamento
de um par de elétrons entre átomos que possuem
pequena ou nenhuma diferença de eletronegatividade.
Tipos de Ligações Covalentes:
- Covalente Simples.
- Covalente Dativa.
Ligação Covalente
Simples ou Normal
Definição: o par eletrônico compartilhado é
formado por um elétron de cada átomo ligante.
Exemplo: formação do cloro – Cl2.
Cl ( Z = 17) 1s2) 2s2, 2p6) 3s2, 3p5
Cl
Cl
Fórmula de Lewis
Cl2 ou Cl - Cl
Molecular
Estrutural
Ligação Covalente
Simples ou Normal
Configuração dos Átomos:
Ligação Covalente
Simples ou Normal
Atração Quântica:
Ligação Covalente
Simples ou Normal
Atração Quântica:
Ligação Covalente
Simples ou Normal
Nuvem Eletrônica ou Orbital Molecular:
Cl
Cl
Exemplos de Ligações
Covalentes Simples
O
O
O2 ou O = O
N
N
N2 ou N N
H
O
H
H
Cl
H2O ou H - O - H
HCl ou H - CL
Ligação Covalente
Dativa ou Coordenada
Definição: o par eletrônico compartilhado pertence a um dos
átomos, só ocorre quando todas as ligações covalentes simples
possíveis já aconteceram.
Exemplo: formação do SO2.
O
S
O
+
O
S=O + O S=O
O
S
O
NÚMERO DE VALÊNCIA
Definição: número de ligações covalentes normais
e dativas que um átomo é capaz de formar.
Valências dos grupos A
GRUPOS
Fórmula de
Lewis
N° de Valências
simples
N° de Valências
dativas
Hidrogênio - H
4A
5A
6A
7A
E
E
E
E
4
3
2
1
0
1
2
3
1 covalente normal
Moléculas do Tipo HxEOy
Ácidos Oxigenados
Todos os átomos de oxigênio aparecem ligados ao elemento central
e cada átomo de hidrogênio ficará ligado a um átomo de oxigênio.
Exemplo: ácido sulfúrico - H2SO4
O
H
O
S
O
O
O
H
H-O-S-O-H
O
LIGAÇÕES SÍGMA () E PI ()
Ligações : interpenetração de orbitais dos átomos
ao longo de um mesmo eixo.
Ligações : interpenetração lateral segundo eixos
paralelos, ocorrem apenas com orbitais do tipo p.
Obs. As ligações só ocorrem após a ligação , que é
única entre dois átomos.
HIBRIDIZAÇÃO DE ORBITAIS
Definição: artifício utilizado por alguns elementos
para formarem um maior número de ligações
covalentes simples.
Hibridização Ocorrências
sp
sp2
sp3
Be e Mg
B e Al
C e Si
Geometria Ângulo
Linear
180°
Trigonal
120°
Tetraédrica 109° 28’
Obs. O Carbono pode apresentar os três tipos de Hibridização.
Exemplos de Hibridização
O átomo híbrido não completa o seu octeto.
BeF2
F
Be
BF3
F
B
F
F
F
F - Be - F
F-B-F
F
Hibridização do Carbono
Hibridização
Estrutura
l
3
Sp
2
Sp
–C –
l
–C =
l
Sp
– C ou =C=
Características dos
Compostos Moleculares
Sólidos, líquidos ou gasosos a
temperatura ambiente.
Ponto de Fusão e Ebulição inferiores
aos dos compostos iônicos.
Bons isolantes: térmico e elétrico.
Participantes dos
Compostos Moleculares
Ametal, Semimetal e Hidrogênio:
- Ametal
- Semimetal
- Hidrogênio
Exercícios de fixação:
Página 58
1. Indique entre os compostos a seguir aqueles em que encontramos
apenas ligações covalentes:
I- NaCl
II- CCl4
a) I e II
b) II e III
III- SO2
IV- KCl
V- Na2SO4
c) I e IV d) IV e V e) III e IV
2. O número máximo de ligações covalentes normais e coordenadas do
átomo do elemento químico cloro, que é halogênio, do 3° período,
pode ser representado por:
a) – Cl
b) Cl –
c) – Cl –
d) – Cl –
e) – Cl –
3. (UCSal) Uma certa molécula linear é formado por três átomos
ligados entre si por uma ligação simples covalente e uma ligação
tripla covalente. Sendo assim, existirão nessa molécula:
a) 4 ligações
b) 4 ligações
c) 1 ligação e 3 ligações
d) 3 ligações e 1 ligação
e) 2 ligações e 2 ligações
Exercícios de fixação:
4. Qual das fórmulas abaixo é prevista para o composto formado por
átomos de fósforo e flúor, considerando o número de elétrons da
camada de valência de cada átomo?
F |
P
|
|
|
a) P F b) P – F P c) F – F P d) F – P – F e) P – F – P
5. Nas moléculas: O = C = O e H – C N
As hibridizações apresentadas pelos átomos de carbono são,
respectivamente:
a) sp e sp2
b) sp e sp3
c) sp e sp
d) sp3 e sp3
e) sp3 e sp3
GEOMETRIA MOLECULAR
DEPENDE:
Disposição espacial dos núcleos dos
átomos.
Repulsão dos pares eletrônicos das
ligações ou pares livres dos átomos.
Obs. Toda molécula formada por dois
átomos é sempre linear.
Nuvens Eletrônicas
Quando se tratar de moléculas com três ou
mais átomos, considera-se uma nuvem
eletrônica para os casos:
Ligação covalente simples
Ligação covalente dupla
Ligação covalente tripla
Par de elétrons não ligante
Formas Geométricas
ÁTOMOS HIBRIDIZADOS:
1) sp linear (ex: BeH2, CO2, etc.)
2) sp2 trigonal (ex: BF3,, BH3, etc.)
3) sp3 tetraédrica (ex:CH4, SiH4, etc.)
ÁTOMOS NÃO HIBRIDIZADOS:
1) 2 átomos linear (ex: H2, HCl, etc.)
2) 3 átomos angular (ex: H2O, SO2, etc.)
3) 4 átomos piramidal (ex: PH3, NH3, etc.)
Exercícios de fixação:
Página 59
Determine a forma geométrica das espécies químicas abaixo:
•
SCl2
•
BF3
•
HCl
•
O3
•
PH3
•
CO2
•
P4
•
SiH4
POLARIDADE DAS LIGAÇÕES
Definição: acúmulo de cargas elétricas iguais em
regiões distintas da ligação – pólos.
Ligações iônicas: são fortemente polarizadas,
cada íon define um pólo da ligação.
+
_
Polaridade das Ligações
Ligações covalentes: é função da diferença de
eletronegatividade entre os átomos da ligação.
Classificação:
- Apolar: formadas por átomos de eletronegatividades
iguais, a nuvem não se deforma.
- Polar: formadas por átomos de eletronegatividade
diferentes, a nuvem se deforma.
Obs. Quanto maior a diferença de eletronegatividade
entre os átomos maior a polarização.
Polaridade das Ligações
Ligação covalente apolar:
H2
H
H
Ligação covalente polar:
+
HCl
H
Cl
-
POLARIDADE DAS MOLÉCULAS
Definição: acúmulo de cargas elétricas em regiões
distintas da molécula, sua força depende da polaridade
das ligações e da geometria molecular.
Momentum dipolar: é o vetor que orienta a
polaridade da ligação, pólo positivo para o negativo.
Ex:
H Cl
Momentum dipolar resultante (r): vetor que
define a polaridade da molécula, soma dos vetores.
Polaridade das Moléculas
Molécula apolar: momentum dipolar (r) = zero.
Ex: molécula do gás carbônico – CO2.
O=C=O
OCO
r = Zero
Molécula polar: momentum dipolar (r) zero.
Ex: molécula da água – H2O.
O
H
H
r Zero (polar)
O
H
H
Exercícios de fixação:
Página 60
1. Os tipos de ligações dos compostos LiF, SCl2 e Cl2 são,
respectivamente:
a) covalente apolar, covalente polar e iônica.
b) iônica, covalente apolar e covalente apolar.
c) covalente polar, iônica e covalente apolar.
d) covalente apolar, iônica e covalente polar.
e) iônica, covalente polar, covalente apolar.
2. Dadas as moléculas O2, PCl3, BeH2, C5H10 e CHCl3 o número de
moléculas polares é:
a) 1
b) 2
c) 3
d) 4
e) 5
3. Dos solventes abaixo, o mais indicado para dissolver enxofre (S8) é:
a) H2O
(água)
d) CS2
(dissulfeto de carbono)
b) C2H5OH
(álcool etílico) e) C3H8O3 (glicerina)
c) HCCl3
(clorofórmio)
LIGAÇÕES INTERMOLECULARES
DEFINIÇÃO: ligações entre as moléculas de
substâncias no estado sólido ou líquido.
Tipos de ligações intermoleculares:
1) Ligação Dipolo – Dipolo: ocorrem entre as
moléculas polares.
2) Pontes de Hidrogênio: ocorrem entre moléculas
fortemente polarizadas, quando o H se encontra ligado
aos átomos de F, O e N.
3) Ligação Dipolo Induzido – Dipolo Induzido:
ocorrem entre as moléculas apolares.
Forças Intermoleculares e as
Propriedades PF e PE
Dois fatores influem nos PF e PE:
1) Ligações intermolecular: quanto maior a
intensidade das forças de ligação, maiores os PF e
PE da substância.
Ordem crescente da intensidade de interação:
Dipolo induzido < dipolo – dipolo < pontes de H
2) O tamanho das moléculas: quanto maior o
tamanho das moléculas, maiores o PF e PE da
substância.
Forças Intermoleculares e as
Propriedades PF e PE
Exemplos:
PE
PE
SnH4
100
H2O
GeH4
SeH4
0
H2Te
H2S
CH4
H2Se
- 100
Tamanho da molécula
Tamanho da molécula
LIGAÇÃO METÁLICA
Definição: ligações entre átomos de metais que
formam retículos cristalinos de cátions fixos unidos
por uma nuvem de elétrons livres da camada de
valência.
Retículo Cristalino
Características dos Metais
Sólidos a temperatura ambiente, exceção do Hg (líquido).
Apresentam brilho metálico, fundidos perdem o brilho,
exceção para o Mg e Al.
Densidade superior a da água, exceção para os alcalinos.
Menor Li = 0,53 g/mL, maior Os = 22,5g/mL.
PF muito variável, menor Cs = 28,5°C, maior W = 3382°C.
Bons condutores de eletricidade e calor. Ag maior
condutividade elétrica, seguida do Cu, Au e Al.
Maleabilidade e ductibilidade.
Ligas Metálicas
Definição: materiais com propriedades metálicas
que contém dois ou mais elementos, sendo pelo menos
um deles metal. Exemplos:
- Liga de metais para fusíveis ( Bi, Pb, Sn e Cd)
- Liga de ouro de joalharia (Au, Ag e Cu)
- Amálgama dental (Hg, Ag e Cu)
- Bronze ( Cu e Sn)
- Latão (Cu e Zn)
Exercícios de fixação:
Página 62
1. Considere as seguintes substâncias químicas: H2, CH4, HCl, H2S e
H2O. Qual delas apresenta moléculas associados por pontes de
hidrogênio?
a) H2
b) CH4
c) HCl
d) H2S
e) H2O
2. A figura que melhor representa a evaporação do metanol (CH3OH) é:
a)
b)
c)
d)
e)
H
H
O
C
OH
H
OH
O
OH-
CH3OH
H
H
CH3OH
CH3OH
CH3OH
H
C
H
O
H
OH-
CH3OH
O
H
CH3OH
H
Exercícios de fixação:
3. Dentre os cloretos a seguir, o mais volátil, provavelmente é:
a) CCl4
b) SiCl4
c) GeCl4
d) SnCl4
e) PbCl4












