ICS – Instituto de Ciências e Saúde
Curso – Química Geral – Nutrição – Prof. Dr. Barbieri
1a lista de exercícios
1) A palavra átomo é originária do grego e significa indivisível, ou seja, segundo os
filósofos gregos, o átomo seria a menor partícula da matéria que não poderia ser
mais dividida. Atualmente essa idéia não é mais aceita. A respeito dos átomos, é
verdadeiro afirmar que:
01. não podem ser desintegrados;
02. são formados por, pelo menos, três partículas fundamentais;
04. possuem partículas positivas denominadas elétrons;
08. apresentam duas regiões distintas, o núcleo e a eletrosfera;
16. apresentam elétrons, cuja carga elétrica é negativa;
32. contêm partículas sem carga elétrica, os nêutrons.
2) Dalton, Rutherford e Bohr propuseram, em diferentes épocas, modelos atômicos.
Algumas características desses modelos são apresentadas abaixo:
modelo I: Núcleo atômico denso, com carga positiva. Elétrons em órbitas circulares.
modelo II: Átomos maciços e indivisíveis.
modelo III: Núcleo atômico denso, com carga elétrica positiva. Elétrons em órbitas
circulares de energia quantizada.
A associação modelo/cientista correta é:
a) I/Bohr , II/Dalton , III/Rutherford
b) I/Dalton , II/Bohr , III/Rutherford
c) I/Dalton , II/Rutherford , III/Bohr
d) I/Rutherford , II/Bohr , III/Dalton
e) I/Rutherford , II/Dalton , III/Bohr
3) Considerando a experiência de Rutherford, assinale a alternativa falsa:
a) A experiência consistiu em bombardear películas metálicas delgadas com
partículas alfa.
b) Algumas partículas alfa foram desviadas do seu trajeto devido à repulsão
exercida pelo núcleo positivo do metal.
c) Observando o espalhamento das partículas alfa, Rutherford concluiu que o átomo
tem densidade uniforme.
d) Essa experiência permitiu descobrir o núcleo atômico e seu tamanho relativo.
e) Rutherford sabia antecipadamente que as partículas alfa eram carregadas
positivamente.
4) Quais são os experimentos utilizados por cada modelo?
1
ICS – Instituto de Ciências e Saúde
Curso – Química Geral - – Nutrição
2a lista de exercícios
1) Do que é constituído o átomo ?
2) Que sabe a respeito das dimensões do átomo e do núcleo?
3) Quais são as partículas fundamentais conhecidas até o presente?
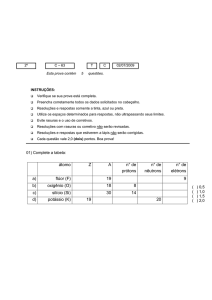
4) Um átomo de número atômico Z e número de massa A:
a) tem A nêutrons.
b) tem A elétrons.
c) tem Z prótons.
d) tem A – Z nêutrons.
e) tem Z elétrons.
5) O átomo constituído de 17 prótons, 18 nêutrons e 17 elétrons, possui número
atômico e número de massa igual a:
a) 17 e 17
b) 17 e 18
c) 18 e 17
d) 17 e 35
e) 35 e 17
6) O que é massa atômica, molecular, elemento químico, substancia química ?
7) O que são íons? Quais são os íons positivos e negativos?
8) Somando-se todas as partículas (prótons, nêutrons e elétrons) de um átomo de
28Ni59 com as do átomo de 80Hg201, o total de partículas será:
a)
281.
b)
158.
c)
368.
d)
108.
e)
360.
9) Um átomo genérico X apresenta a seguinte estrutura:
O número de massa deste átomo é igual a:
a)
13.
b)
14.
c)
26.
d)
27.
e)
40.
2
10) O átomo de telúrio (Te) possui 52 elétrons e 75 nêutrons. O seu número atômico e
o número de massa são, respectivamente:
a)
52, 52.
b)
52, 127.
c)
127, 52.
d)
52, 75.
e)
127, 52.
11) Quais são os subníveis que forma a camada eletrônica L?
12) Quais são os subníveis que podem existir no nível energético de número quântico
principal (n) igual a 4 ?
13) Encontre os 4 números quânticos para os seguintes elementos químicos:
Mg (Z= 12);
Ni (Z= 28);
Cl (Z= 17);
14) Pelos 4 números quânticos, que elemento químico são representados pelos:
a) n = 4
b) n = 3
c) n = 3
l=1
l=1
l=2
m=0
m = +1
m = +1
s=+½
s=+½
s=+½
3
ICS – Instituto de Ciências e Saúde
Curso – Química Geral Nutrição
3a lista de exercícios
1) Como são classificadas as ligações químicas, explique e dê um exemplo da cada
ligação.
2)
a)
b)
c)
d)
Faça a distribuição eletrônica dos elementos sódio (Na) e cloro (Cl) e mostre:
quantos elétrons apresentam na última camada dos dois elementos;
mostre sua fórmula das moléculas que se formam;
mostre a sua representação gráfica que existe e
que tipo de ligação ocorre neste tipo de composto?
3) Qual é o tipo de ligação química que ocorre no composto dióxido de enxofre
(SO2), mostre a representação eletrônica (Lewis) e estrutural (Kossel).
4) O que é ligação covalente dativa? Dê um exemplo?
5) Dados algumas fórmulas estruturais abaixo, qual apresenta eletrosfera iguais
aos gases nobres?(Faça a fórmula eletrônica (Lewis) para cada).
a) O __ F
d) F __ O __ F
b) O = F
e) O __ F __ O
c) F = O = F
6) Faça a distribuição eletrônica das seguintes substâncias a partir das fórmulas
moleculares, mostre as fórmulas estruturais e eletrônicas.
a) SO2
b) N2
c) CO
d) HCN
e) CO2
f) O2
Alguns dados importantes
4
massa atômica: H =1u, Na =23u, Cl=35,5 u, O=16 u, F =19u
5
ICS – Instituto de Ciências e Saúde
Curso – Química Geral – Nutrição – Prof. Dr. Barbieri
4a lista de exercícios
1) Segundo Arrhenius defina:
a) ácidos
b) Bases
c) sais
2) Qual é importância das funções inorgânicas para a área na área de nutrição?
3) Dê o nome dos seguintes ácidos
a) H2S
b) HNO2
c) H2SO4
d) H2SO3
e) HBrO
f) H3BO3
4) Dê o nome das seguintes bases e
a) KOH
b) Sn(OH)2
c) Zn(OH)2
d) Pb(OH)4
e) NaOH
f) Al(OH)3
5) Dê o nome dos seguintes sais
a) CdS
b) NaCN
c) NH4HCO3
d) Al(OH)2NO2
e) BaHPO3
f) Mg(OH)Cl
6
6) Indique os conceitos de acidos e base formulada por Bronsted-Lowry
7) Um próton pode ser representado por:
a) H0
b) Hc) e+
d) ee) H+
8) Segundo Brönsted-Lowry, um ácido é uma base conjugada, diferem entre si por:
a) um próton
b) uma hidroxilia
c) um hidroxônio
d) um par de elétrons
e) uma ligação covalente
9) “Ácido é uma substância capaz de receber 1 par de elétrons”.
A definição acima corresponde à proposta de:
a) Arrhenius
b) Brönsted
c) Lavoisier
d) Lewis
e) Ostwald
7
ICS – Instituto de Ciências e Saúde
Curso – Química Geral – Nutrição – Prof. Dr. Barbieri
5a lista de exercícios
1) Complete com hidrogênio as ligações que estão faltando nos átomos dos
compostos abaixo:
a)
b)
c)
8
2) Complete com as ligações para que as valências dos átomos envolvidos sejam
satisfeitas:
a)
b)
3) Complete com hidrogênio as ligações que estão faltando nos átomos dos
compostos abaixo:
a)
b)
9
c)
4) Classifique os átomos de carbono primários, secundários, terciários e
quaternários nas cadeias mencionadas a seguir:
a)
b)
5) Quantos átomos de carbono possui a cadeia principal da molécula representada
abaixo?
10
6) Dê a fórmula estrutural dos seguintes radicais:
a)
b)
c)
d)
e)
f)
g)
h)
metil
etil
butil
isopropil
fenil
t-butil
iso-butil
propil
7) Os nomes dos radicais orgânicos
8) Com relação ao composto a seguir, os nomes dos radicais ligados ao carbono
terciário são:
11
ICS – Instituto de Ciências e Saúde
Curso – Química Geral – Nutrição – Prof. Dr. Barbieri
6a lista de exercícios
1) O que são hidrocarbonetos e como são classificados.
2) Como é explicada a nomenclatura segundo a IUPAC de um hidrocarboneto?
3) Para o composto orgânico a seguir formulado, aplicando a nomenclatura IUPAC,
o seu nome correto é:
4) Dê os nomes, segundo a IUPAC dos seguintes hidrocarbonetos orgânicos:
a)
b)
c)
d)
e)
g)
f)
h)
12
5) Um alcano encontrado nas folhas do repolho contém em sua fórmula 64 átomos
de hidrogênio. O número de átomos de carbono na fórmula é:
6) Um alcino tem peso molecular igual a 68 u.m.a. A fórmula molecular deste alcino
é:
Dados: H = 1 u; C = 12 u
7) Quantos carbonos existem no ciclano de menor peso molecular?
8) Dê as fórmulas estruturais dos seguintes compostos:
13
ICS – Instituto de Ciências e Saúde
Curso – Química Geral – Nutrição – Prof. Dr. Barbieri
7a lista de exercícios
1) O que são e como são classificadas as seguintes funções orgânicas:
a)
b)
c)
d)
e)
f)
g)
h)
i)
j)
k)
l)
m)
álcool
enól
fenol
éter
aldeído
cetona
ácidos carboxílico
éster
haleto de acila
anidrido
sais de ácidos
aminas
amidas
2) Dê os nomes dos seguintes compostos orgânicas:
14
15
3) Escreva as fórmulas estruturais dos seguintes compostos:
a)
b)
c)
d)
e)
f)
g)
h)
i)
j)
k)
l)
m)
n)
o)
Ciclopentanol
6-metil-heptan-1-ol
1-hidroxi-3,5-dimetil–benzeno
etóxi-etano
metóxi-etano
N-metil-propanoamida
etanoato de potássio
3,5-dimetil-hexanal
4-metil-hexan-2-ona
ácido metil-propanóico
metil isopropilamina
3-metil-pentanamida
butanoato de metila
dimetilamina
2–etil-3,3–dimetil-butanoamida.
4) Considere as seguintes substâncias:
e as seguintes funções químicas:
a – ácido carboxílico.
d – cetona.
b – álcool.
e – éster.
c – aldeído.
f – éter.
A opção que associa corretamente as substâncias com as funções químicas é:
a) I - d ; II - c ; III - e ; IV - f.
b) I - d ; II - c ; III - f ; IV - e.
c) I - c ; II - d ; III - e ; IV - a.
d) I - a ; II - c ; III - e ; IV - d.
e) I - c ; II - d ; III - f ; IV - e.
16