Investigação de
Marcadores Moleculares
em Lesões Benignas e
Neoplasias do Trato
Digestório
Profa. Dra. Ana Elizabete Silva
Departamento de Biologia
IBILCE-UNESP
NEOPLASIAS TRATO DIGESTÓRIO
CÂNCER DE ESÔFAGO:
3º tipo (mundo)
6º tipo Brasil (10.590 casos)
~85% carcinomas
CÂNCER GÁSTRICO:
2º tipo (mundo)
3º tipo Brasil (23.200 casos)
~95% adenocarcinomas
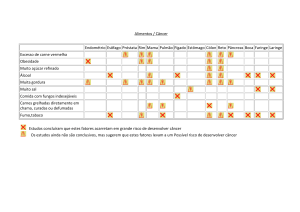
CARCINOGÊNESE DO ESÔFAGO
ÁLCOOL E FUMO
FATORES DE
RISCO
Ambiental e genéticos
História familial
Agentes infecciosos
(HPV)
Megaesôfago chagásico
Esôfago de Barrett
Lesões cáusticas
Aneuploidias
Mutação genes
supressores: TP53, P16,
P17, FHIT
Ativação de oncogenes:
CCND1, HER-2/neu
Doença de Chagas - Fase crônica
Brasil: 50-60% chagásicos na fase crônica sem
manifestações clínicas
2-4% fase crônica sintomática
Intestino grosso (megacólon)
Coração
80%
Esôfago
(megaesôfago)
Risco de 3-8%
Megaesôfago
chagásico
Carcinoma de
células escamosas
do esôfago
Complicação tardia mais séria do
megaesôfago
5% dos pacientes com MC em idade mais
jovem em relação àqueles sem a doença
Contato prolongado de agentes
carcinógenos alimentares com a mucosa
estase alimentar aumento do
crescimento bacteriano e irritação química
esofagite crônica
C ARCINOMA DE ESÔFAGO
Megaesôfago chagásico
(MC)
FISH:
aneuploidias 7, 11, 17
deleção TP53
amplificação CCND1
MC: 60% aneuploidias
(-7,+7, -17, +17)
54,5% deleção TP53
CE: 100% tri e tetrassomias
100% deleção TP53
70% CCND1
Chagásicos crônicos: com
e sem megaesôfago
Esofagites crônicas
Molecular:
Mutações TP53, MTS-1
e FHIT (PCR-SSCP,
sequenciamento)
T. cruzi: polimorfismos
do kDNA (sangue e
mucosa)
CGH
Imuno:
Expressão
proteínas: p53,
p16 e fhit
Apoptose:
caspase-3 ativada
Proliferação
celular: antígeno
Ki-67
CARCINOGÊNESE GÁSTRICA
CÂNCER GÁSTRICO
•Incidência elevada: Japão, China, Costa Rica, Chile e Portugal
•Brasil: Estimativas para 2006 (INCA)
•23.200 casos novos
•Homens: 2x mais afetados
TIPOS HISTOLÓGICOS DO
ADENOCARCINOMA GÁSTRICO
• ADENOCARCINOMA TIPO INTESTINAL OU
BEM DIFERENCIADO:
• Presença de lesões pré-neoplásicas
• Predominante em homens e idosos
• ADENOCARCINOMA TIPO DIFUSO OU
POUCO DIFERENCIADO:
• Prognóstico pior
• Não associado a lesões pré-cancerosas
• Mais frequente em mulheres e jovens
Lesões précancerosas
Helicobacter
pylori
Predisposição
Genética
Gastrectomia
Anterior
Tabaco
Lesões do DNA
Álcool
Alimentos salgados ,
enlatados e defumados
CARCINOGÊNESE GÁSTRICA
Colonização da mucosa gástrica pela
Helicobacter pylori (modificado Yoshiyama e Nakazawa, 2000)
• Prevalência da Hp: 40 a
50% na população
• 9 vezes risco de câncer
gástrico
• Geração de radicais livres
(espécies de oxigênio e
nitrogênio reativos) →
danos no DNA
• Alterações na secreção de
fatores de crescimento e
citocinas
• Desregulação do ciclo
celular do epitélio gástrico
→ proliferação celular ↑ x
apoptose ↑
Estômago
Normal
Apoptose regulada
Gastrite
H.pylori
Úlcera
Gastrite atrófica
Apoptose
Apoptose
+
Proliferação
regulada
+
Inflamação
TNF
CD95
NO
Inflamação
TNF
CD95
NO
Proliferação
Proliferação
Homeostase
(renovação celular
normal)
Homeostase
( da proliferação celular)
Desequilíbrio
(perda de células)
HOMEOSTASE E DESEQUILÍBRIO DA MUCOSA GÁSTRICA
(modificado Wagner et al., 1997)
CARCINOGÊNESE DO ESTÔMAGO
•
•
•
•
•
•
•
•
Alterações genéticas e epigenéticas
Oncogenes
Genes supressores de tumor
Reguladores do ciclo celular
Moléculas de adesão celular (caderinas)
Genes de reparo do DNA
Instabilidade genética
Ativação de telomerases
PERDAS E GANHOS CROMOSSÔMICOS
Cromossomos
1
2
3
4
5
7
8
9
12
13
14
15
16
17
18
19
20
22
Regiões Cromossômicas
1p (1p36) ; 1q22-q31
2pter-p23; 2q; 2q
3p14; 3q (3q12-qter)
4q32
5q21
7pq; 7q22; 7q31
Genes
p73
FHIT
APC
ERBB; EGFR, HGF;
c-MET
c-MYC
CDKN2A (p21)
EPS8; DOC-1
receptor de serotonina
8pq; 8q (8q23-24)
9p (9p21)
12q (12q24)
13q (13q21-22)
14q (14q24)
15q (15q11-q15)
16pq, 16q22
17p (17p13); 17q; 17q (17q12-q21)
18q21; 18q
19p(19p13); 19q(19q13)
20pq; 20q11-q12
22q
E-Caderina
TP53, c-ERBB2,
gastrina
DCC
CARCINOGÊNESE DO ESTÔMAGO (modificado Tahara, 2004)
INTESTINAL
TP53
APC
D1S191
HIPERMETLAÇÃO
MUCOSA
NORMAL
C-ERBB2
C-MET
CICLINA E
TP53
METAPLASIA
INTESTINAL
p27
ADENOMA
CÂNCER
AVANÇADO
CÂNCER
INICIAL
DIFERENCIADO
LOH 1p36 (p73)
TELÔMEROS
INSTABILIDADE
GENÉTICA
CD44 ALTERADO
CICLINA E
CD44 ALTERADO
MUCOSA
NORMAL
LOH 17q21
DIFUSO
LOH 7q
p27
TELOMERASE
hTERT
H. pylori
INVASÃO
METÁSTASES
MUTAÇÃO/LOH
TP53
CÂNCER
INICIAL
CÂNCER
AVANÇADO
DIFERENCIADO
INVASÃO
METÁSTASES
MUTAÇÃO/PERDA
E CADERINA
AMPLIFICAÇÃO
K-SAM
c-MET
Escasses de estudos genéticos em lesões gástricas precursoras
com potencial pré-neoplásico indicar marcadores
cromossômicos associados com a carcinogênese gástrica
FISH
-aneuploidias (3, 7, 8, 9 e 17)
-deleções no gene TP53,
-amplificação CCND1 e
Her-2/neu (c-erbb-2)
lesões gástricas benignas e
adenocarcinoma gástrico
MOLECULAR
IMUNO-HISTOQUÍMICA Avaliação da H. pylori
Polimorfismos: CYP,
expressão das proteínas:
GST, XRCC1, XRCC3,
COX2, NOS2
-p53
Expressão gênica:
-ciclina D1 e p185 (HerPCR Real Time
2/neu)
RaSH (hibridação
subtrativa rápida)
Metilação
Comparar os resultados obtidos em lesões benignas com aqueles
de adenocarcinomas gástricos ressaltar alterações genéticas
que possam estar relacionadas com a progressão das lesões
benignas, e maior risco de malignização utilizadas no
diagnóstico precoce e prognóstico
MATERIAL
Controle: 10 biópsias mucosas gástricas
histologicamente normais e H. pylori negativas
Lesões gástricas: 113 (biópsias/frag. cirúrgico)
• 38 gastrites crônicas
• 13 gastrites atróficas crônicas
• 21 úlceras gástricas
• 21 metaplasias intestinais
• 20 adenocarcinomas gástricos
•Gastrite crônica e gastrite atrófica associada com H.
pylori precede a formação do câncer gástrico
•Úlcera péptica maior risco de câncer gástrico
•Objetivos: avaliar a ocorrência de aneuploidias (3, 7, 8, 9 e
17); deleção e expressão do gene TP53.
Amostras: 38 gastrite crônica
13 gastrite atrófica
21 úlcera gástrica
Aneuploidias: frequência crescente de GC (21%) para GAC (31%) e para UG (62%)
Gastrite crônica: 8/38 casos -7, +7 75% Hp+
Gastrite atrófica crônica: 4/13 casos +7, +8 100% Hp+
Deleção TP53: não observada
Expressão aumentada da p53:
Gastrite crônica: 5/11 (45%)
Úlcera gástrica: 13/21 casos (62%) +7,+8; +17 69% Hp+
Expressão aumentada da p53: 2/17 (12%)
GC: +7
GC: -7
UG: +8
↑p53 em GC e UG: super
expressão da proteína selvagem
→ resposta fisiológica ao
processo inflamatório do
epitélio gástrico (H. pylori)
Metaplasia intestinal: (substituição do epitélio gástrico por
células colunares intestinal)
•Alguns estudos: mutação do TP53 e superexpressão da
proteína p53 em metaplasia adjacente ao tumor.
•Objetivo:
•Investigar ocorrência de aneuploidias (3, 7, 8, 9 e 17), deleção e
expressão do gene TP53, em metaplasia intestinal de pacientes
sem câncer gástrico.
•71% (15/21) casos MI:
aneuploidias +7, +8, +9
•Associação: aneuploidias x H.
pylori
•60% (3/5) casos: deleção
TP53
•12% (2/17) casos: expressão
p53
•100% casos: aneuploidias (tri/tetra)
•3/3 casos: deleção TP53
•30% (6/20 ): trissomias múltiplas
•80% (12/15): expressão
p53
Metaplasia: +7
Adenocarcinoma
+9; +17
Mucosa normal:
TP53 (vermelho)
adenocarcinoma
Deleção TP53
1 sinal vermelho
17 (verde)
AUMENTO PROGRESSIVO NA FREQÜÊNCIA E
COMPLEXIDADE DE CASOS COM ANEUPLOIDIAS
100
100
80
80
3
3
60
7
60
7
40
8
40
8
9
20
17
9
20
17
0
0
GC GAC UG
MI
CG
monossomias
GC
GAC
UG
MI
trissomias
CG
IMUNO-HISTOQUÍMICA – p53
Mucosa normal
p53-
Metaplasia
Adenocarcinoma
p53+ (fraca)
p53+ (forte)
•Cromossomos 7, 8, 9 e 17 carregam genes importantes
que atuam no controle da proliferação celular
•7q31: MET
•8q24: MYC
•9p21: CDKN2A
•17p13: TP53
Dosagem anormal e
expressão gênica
vantagem proliferativa
•17q21: ERBB-2 (HER-2/NEU)
•Primeira evidência de alterações numéricas em MI de
pacientes sem câncer gástrico alterações presentes em
frequências adenocarcinoma conecção cronológica
entre essas lesões expansão monoclonal
•Ocorrência de instabilidade cromossômica em lesões
benignas (GC e UG) que podem ter função importante na
carcinogênese do estômago
APOPTOSIS IN DIFFERENT GASTRIC LESIONS
AND ASSOCIATION WITH H. pylori AND
EXPRESSIONS OF p53
• Apoptose: homeostase do tecido
equilíbrio entre proliferação e
morte celular programada
• Desequilibrio: taxa proliferativa
excessiva potencializa o efeito
de carcinógenos risco de
câncer
• Associação: H. pylori x Apoptose
lesões gástricas ???
• H. pylori: risco de 2,7 a 12 vezes
de câncer gástrico
OBJETIVO: avaliar os IA em diferentes lesões gástricas e
comparar com adenocarcinoma gástrico técnicas que
detectam apoptose em fases diferentes:
•Caspase-3 ativada (CPP32) mais precoce
•TUNEL fragmentação do DNA
•Associar com H. pylori, aneuploidias e expressão da p53
•AM0STRAS:
8 mucosa normal Hp34 gastrite crônica
11 gastrite atrófica
17 úlcera gástrica
12 adenocarcinomas
Índice Apoptótico (IA)
Técnica
Amostra
N
x DP
Mínimo
Mediana
Máximo
Casos
s
TUNEL
TUNEL
positivos
MN
08
1,820,47
0,0
2,0
3,6
0/8
GC
34
2,600,32
0,0
2,3
7,4
GAC
11
3,930,63*
0,0
4,4
7,0
UG
17
2,030,39
0,0
2,0
7,0
MI
15
2,360,41
0,0
2,4
5,2
AG
12
1,970,42
0,4
1,6
6,0
3/34
(26,5%)
6/11
(54,5%)
2/17
(11,8%)
2/15
(13,3%)
1/12 (8,3%)
CPP32
positivos
CPP32
MN
08
3,201,31
0,0
2,7
11,0
0/8
GC
34
13,822,58
0,0
8,4
52,0
15/34
(44,1%)
3/11
(27,3%)
4/17
(23,5%)
1/15 (6,7%)
*
GAC
11
6,201,57
0,0
5,0
13,4
UG
17
9,472,92
0,0
3,4
34,8
MI
15
6,721,47
0,8
6,8
24,4
AG
12
8,072,75
0,0
4,7
30,8
4/12
(33,3%)
IA aumentados:
TUNEL: GAC
CPP32: GC
Adenocarcinomas:
IA baixos, sem
diferença entre
intestinal e difuso
TUNEL
CPP32
A-B:gastrite crônica
A
B
C
D
E
F
G
H
C-D: úlcera gástrica
E-F: metaplasia
intestinal
G-H: adenocarcinoma
gástrico
CONCLUSÕES
• Não houve associação entre apoptose aumentada e
infecção pela H. pylori, aneuploidias e super
expressão da proteína p53
• não houve correlação entre os IA encontrados por
ambas as técnicas,
• aumento de apoptose em GC e GAC, não relacionado
com infecção pela H. pylori reforçando a
participação de lesões gástricas com potencial précanceroso na tumorigênese do estômago enfatiza a
importância do emprego de métodos diferentes para
detecção de apoptose.
Double minutes
(DM)
aumento do número de cópias: dezenas a
centenas de vezes (erros de replicação)
Aumento da expressão gênica→proteína
Regiões
homogeneamente
coradas (HSR)
Carcinogênese: Genes Amplificados
-CCND1
-c-MET
-c-MYC
-c-ERBB-2 (HER-2/NEU)
-40 carcinoma esôfago
-12 mucosa normal
-40 adenocarcinoma gástrico
Avaliar a relação entre
-14 mucosa normal
amplificação e polissomia de
CCND1 e Her-2/neu com
expressão aumentada das
IMUNO
FISH
proteínas e aspectos
clinicopatológicos→prognóstico Cyclin D1 (vermelho) Anticorpos:
Her-2 (vermelho)
ciclina D1(nuclear)
Centrômeros (verde)
Her-2 (membrana)
AMPLIFICAÇÃO:
CCND1: carcinoma esôfago 45% (18/40)
câncer gástrico 10% (4/40)
HER-2/NEU: carcinoma esôfago 7,5% (3/40)
câncer gástrico 5% (2/40)
IMUNO:
Cyclin D1+:
câncer esôfago 37,5% (15/40)
câncer gástrico 35% (14/40)
Her-2/neu+:
câncer esôfago 12,5% (5/40)
câncer gástrico 7,5% (3/40)
FISH:
(A-B) Amplificação CCND1( vermelho) – câncer de esôfago e gástrico
(E-F) Polissomia 11 (verde) gene CCND1 (vermelho)
FISH:
(C-D) Amplificação Her-2 ( vermelho) – câncer de esôfago e gástrico
(E-F) Polissomia 17 (verde) gene Her-2 (vermelho)
IMUNO: (A-B) proteína Cyclin D1+ câncer esôfago e gástrico
(C-D) proteína Her-2+ câncer esôfago e gástrico
CONCLUSÕES:
-CCND1: mais frequentemente amplificado e proteína super-expressada (ambas
neoplasias) → função na progressão de infiltração e metástases → marcador
molecular → prognóstico pior e comportamento mais agressivo →
invasão, metástases, recorrência e sobrevida reduzida,
-Baixa associação entre amplificação x super-expressão → outras vias de
expressão
alteração na síntese ou estabilidade da proteína
alterações na regulação de transcrição gênica
EQUIPE
•
•
•
•
•
•
•
•
COORDENADORA:
Profa. Dra Ana Elizabete Silva – UNESP
COLABORADORES:
Profa. Dra. Marileila Varella-Garcia – Cancer Center-USA
Prof. Dr. Aldenis Albaneze Borim – FAMERP
Profa. Dra. Patrícia Maluf Cury – FAMERP
Dr. Alaor Caetano – FAMERP
Profa. Dra. Kátia Ramos Lopes – Hospital Sírio Libânes - SP
•
•
•
•
•
•
•
•
•
•
•
•
•
PÓS-GRADUANDOS:
Ana Cristina Gobbo César
Lucimari Bizari
Fernanda da Silva Manoel Caetano
Marilanda Ferreira Bellini
Márcia Cristina Duarte
Juliana Garcia de Oliveira
Aline Cristina Targa
Aparecida Perpétuo Fedossi
Héctor Matiolli
INICIAÇÃO CIENTÍFICA:
Isabella Katz Migliori
Yvana Cristina Jorge
•
Auxílio e Bolsa: FAPESP, CAPES e CNPq