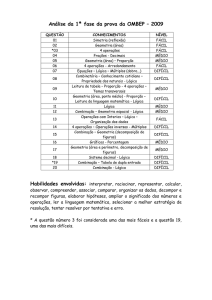
Geometria e Polaridade Molecular
Geometria Molecular
É o estudo de como os átomos estão distribuídos
espacialmente em uma molécula.
As principais classificações são: linear, angular,
trigonal plana, piramidal e tetraédrica.
Para se determinar a geometria de uma molécula, é
preciso conhecer a teoria da repulsão dos pares
eletrônicos da camada de valência.
VSEPR (repulsão dos pares de elétrons da
camada de valência)
Baseia-se na idéia de que pares eletrônicos da
camada de valência de um átomo central, estejam
fazendo Ligação química ou não, se comportam
como nuvens eletrônicas que se repelem, ficando
com a maior distância angular possível uns dos
outros.
Uma nuvem eletrônica pode ser representada por
uma ligação simples, dupla, tripla ou mesmo por
um par de elétrons que não estão a fazer ligação
química.
Geometria Molecular
No quadro a seguir, podemos observar a relação da
geometria das moléculas com número de nuvens
eletrônicas localizadas ao redor do átomo central.
Linear
HCl
l80º
HBr
Linear
CO2
180º
Angular
H2O
104,5º
Trigonal Plana
BF3
120º
Pirâmide Trigonal
NH3
107,3º
Tetraédrica
CH4
109,28º
Polaridade Molecular
A polaridade de uma molécula é verificada pelo valor do
momento de dipolo →µ
A polaridade de moléculas com mais de dois átomos é
expressa por: →µR (momento dipolo resultante).
H2
H─H
HF
H ─F
CO2 O═C ═ O
HCN H ─ C≡N
geometria linear →µ = zero
geometria linear
→µ ≠ 0
geometria linear →µ = 0
geometria linear →µ ≠ 0
Apolar
Polar
Apolar
Polar
Para determinar o momento dipolar devem-se considerar
dois fatores:
a) A escala de eletronegatividade, que nos permite
determinar a orientação dos vetores de cada ligação:
b) A geometria da molécula, que nos permite determinar a
disposição espacial desses vetores.
EXEMPLOS
H2O Polar
Amônia(NH3) Polar
HCCl3 Polar
CH4 Apolar