TERMODINÂMICA
QUÍMICA
CAPÍTULO 19
Leonardo de A. Mendes
Marcus Vinicíus R. Calzavara
Prof. Elcio Barrak
TEMAS ABORDADOS:
■
■
■
■
■
■
■
Processos espontâneos
Entropia e Segunda Lei da Termodinâmica
Interpretação molecular da entropia
Variações de entropia nas reações químicas
Energia livre de Gibbs
Energia livre e temperatura
Energia livre e constante de equilíbrio
Na natureza nada se cria, nada
se perde, tudo se transforma.
(“Antoine Lavoisier”)
Processos Espontâneos
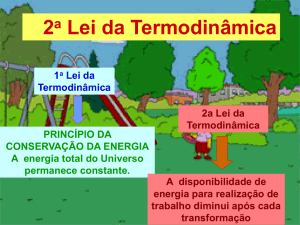
• 1ª Lei da termodinâmica:
Energia de um sistema é conservada
= variação da energia interna
= calor absorvido pelo sistema
= trabalho realizado pela vizinhança
Processos Espontâneos
• Espontâneo
Não Espontâneo
Processos Espontâneos
Espontâneo para T > 0
Espontâneo para T < 0
Processos Espontâneos
• Processos Reversíveis: o sistema pode
ser restaurado ao seu estado original sob
as mesmas condições de energia.
• Processos Irreversíveis: não podem
simplesmente ser revertidos para se
restaurar o sistema ao estado original.
Entropia e a 2ª Lei da
Termodinâmica
• Expansão espontânea de um gás:
Espontâneo
Não
Espontâneo
Entropia e a 2ª Lei da
Termodinâmica
Entropia (S): é uma grandeza
termodinâmica que expressa a desordem.
= variação de entropia do sistema
= transferência de calor (‘rev’ indicando
reversibilidade)
= temperatura constante
Entropia e a 2ª Lei da
Termodinâmica
A entropia do
universo deve
aumentar durante um
processo espontâneo
mesmo a entropia do
sistema diminuindo
Entropia e a 2ª Lei da
Termodinâmica
• Geralmente, quando um aumento na
entropia em um processo está associado
a uma diminuição na entropia em outro
sistema, predomina o aumento em
entropia.
• A entropia é uma função de estado.
• Para um sistema, S = Sfinal - Sinicial
• Se S > 0, a desordem aumenta, se S <
0 a ordem aumenta.
Entropia e a 2ª Lei da
Termodinâmica
• Para um sistema isolado, Ssis = 0 para um
processo reversível e Ssis > 0 para um
processo espontâneo.
• Para um processo reversível: Suniv = 0.
• Para um processo espontâneo (e irreversível):
Suniv > 0.
Entropia e a 2ª Lei da
Termodinâmica
• Existem três modos atômicos de movimento:
– translação (o movimento de uma molécula de um
ponto no espaço para outro);
– vibração (o encurtamento e o alongamento de
ligações, incluindo a mudança nos ângulos de
ligação);
– rotação (o giro de uma molécula em torno de
algum eixo).
3ª Lei da Termodinâmica
• No zero absoluto, a entropia de uma
substância cristalina pura é zero:
S(0 K) = 0
3ª Lei da Termodinâmica
• A entropia varia dramaticamente em uma
mudança de fase.
• Ao aquecermos uma substância a partir do
zero absoluto, a entropia deve aumentar.
• Se existem duas formas de estado sólido
diferentes para uma substância, a entropia
aumenta na mudança de fase do estado
sólido.
3ª Lei da Termodinâmica
3ª Lei da Termodinâmica
Segundo Ludwig Boltzmann, para um
sistema isolado, a entropia é:
S = k ln W
Constante de Boltzmann: k = 1,38 x 10-²³ J/K
ln: logaritmo natural
W: número de arranjos possíveis no sistema
Energia livre de Gibbs
• Geralmente um processo espontâneo ocorre com
aumento na entropia. Mas há exceções, como a
formação do NaCl em que mesmo sendo espontâneo
há uma diminuição na entropia.
• A energia livre de Gibbs, G, de um estado é definida
como:
G = H – TS
• Mas Gibbs chegou a conclusão que mantendo a
temperatura e a pressão constante conseguiria saber
se a reação era espontânea ou não.
Energia livre de Gibbs
• Variação da energia livre de Gibbs:
∆G = ∆H - T∆S
• O sinal de ∆G nos indica se a reação é espontânea ou
não:
Se ∆G é negativo, a reação é espontânea no sentido
direto, ou seja, da esquerda para a direita.
ii. Se ∆G é zero, passamos a indicar a variação de
energia livre como ∆G0 e a reação está em
equilíbrio.
i.
Energia livre de Gibbs
iii. Se ∆G é positivo, quer dizer que a reação direta
(esquerda para a direita) não é espontânea, ou seja,
esta passando de um lugar de maior energia para um
de menor energia, assim o sistema tem que fornecer
energia para que ela ocorra, então a reação inversa
(direita para a esquerda) é espontânea.
Energia livre de Gibbs
• Considere a formação de amônia a partir de
nitrogênio e hidrogênio:
N2(g) + 3H2(g)
2NH3(g)
• Q < Keq, ocorre no início, enquanto a amônia esta
sendo produzida espontaneamente.
• Q > Keq, ocorre após um certo tempo, quando a
amônia produz N2 e H2 espontaneamente.
• Q = Keq, ocorre no equilíbrio, quando a quantidade
de N2 e H2 produzida é igual à quantidade produzida
de amônia
Energia livre de Gibbs
Energia livre de Gibbs
Variações da energia livre padrão
• Energia livres padrão de formação:
∆G0 = Σn∆G0f (produtos) - Σm∆G0f (reagentes)
∆G0f
∆G0 < 0
∆G0 > 0
∆G0 = 0
energia livre padrão
espontâneo
não-espontâneo
em equilíbrio
Energia livre e temperatura
• Para se relacionar a variação de entropia com a
temperatura utilizamos:
• ∆H
• ∆S
G H TS H (TS )
Termo da entalpia
Termo da entropia
Energia livre e constante de equilíbrio
• Equação utilizada somente quando o sistema
encontra-se em seu estado padrão:
∆G = ∆H - T∆S
• Equação utilizada para sistemas que não se encontram
em seu estado-padrão:
ΔG = ΔG° + RTlnQ
Q
Quociente de reação correspondente à mistura
em questão.
R
Constante ideal do gás
T
Temperatura absoluta
Energia livre e constante de equilíbrio
• Sob condições padrão as concentrações de todos os
reagentes e produtos são iguais a 1,
então, Q = 1 e lnQ = 0
Assim, ΔG = ΔG°
• A expresão para Q é idêntica à expressão da constante
de equilíbrio, exceto porque os reagentes e os
produtos não estão em equilíbrio.
Energia livre e constante de equilíbrio
• Quando temos um sistema em equilíbrio:
Q = Keq e ΔG = 0, assim obtemos uma nova equação:
Energia livre e constante de equilíbrio
• Da equação podemos concluir que:
i. ΔG° < 0, logo K > 1
ii. ΔG° = 0, logo K = 1
iii. ΔG° > 0, logo K < 1
•
A equação também nos permite calcular o valor da
Keq, se conhecermos o valor de ∆G0.
Keq e
G o
RT
Referência Bibliográficas
• Livro-texto: T. L. Brown, H. E. LeMay Jr., B.
E. Bursten e J. R. Burdge. Química: A Ciência
Central, 9ª. ed.. São Paulo: Pearson, 2005.