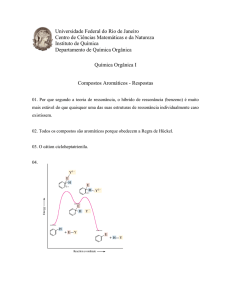
H
H
C
H
+
Cl
Cl
H
Houve a troca do HIDROGÊNIO pelo CLORO
É quando um átomo ou grupo de
REAÇÃO DE SUBSTITUIÇÃO
átomos é substituído por um
radical do outro reagente.
Cl
H
H
C
H
H + Cl
Cl
LUZ
H
C
H
H + H
Cl
H
H
H
C
C
H + Cl
Cl
Houve a adição dos átomos de CLORO aos carbonos INSATURADOS
REAÇÃO DE ADIÇÃO
H
H
C
É quando duas ou mais moléculas
reagentes formam uma única como produto
H
C
H + Cl
Cl
CCl
4
H
H
H
C
C
Cl
Cl
H
H
H
OH
C
C
H
H
H
+
H 2O
Ocorreu a saída de ÁGUA do etanol
É quando de uma molécula são retirados
REAÇÃO DE ELIMINAÇÃO
dois átomos ou dois grupos de átomos
sem que sejam substituídos por outros
H
H
OH
C
C
H
H
H
H+
H
C
C
H
H
H
+
H 2O
Entre os compostos orgânicos que sofrem
reações de substituição destacam-se
Os alcanos.
O benzeno e seus derivados.
Os haletos de alquila.
Os alcoóis.
Os ácidos carboxílicos.
É quando substituímos um ou mais átomos de
hidrogênio de um alcano por átomos dos
halogênios
H
H
LUZ
H
C
H
H + Cl
Cl
H
C
H
Cl + H
Cl
Podemos realizar a substituição dos demais
átomos de hidrogênio sucessivamente,
resultando nos compostos
CH4 + 2 Cl2 H2CCl2 + 2 HCl
CH4 + 3 Cl2 HCCl3 + 3 HCl
CH4 + 4 Cl2 CCl4 + 4 HCl
Nos alcanos de cadeias maiores, teremos vários átomos
de hidrogênios possíveis de serem substituídos
A reatividade depende do CARBONO onde ele se encontra;
a preferência de substituição segue a seguinte ordem:
C terciário > C secundário > C primário
H
I
CH3 – C – CH3 + Cl2
I
CH3
LUZ
Cl
I
CH3 – C – CH3 + HCl
I
CH3
produto principal
Neste caso todos os átomos de hidrogênios são equivalentes e
originará sempre o mesmo produto em uma mono – halogenação
Cl
+ Cl2
AlCl3
+ HCl
Consiste na reação do benzeno com ácido nítrico (HNO3) na
presença do ácido sulfúrico (H2SO4), que funciona como catalisador
NO2
+ HNO3
H2SO4
+ H2O
Consiste na reação do benzeno com o ácido sulfúrico
concentrado e a quente
SO3H
+ H2SO4
H2SO4
+ H2O
Consiste na reação do benzeno com haletos de alquila
na presença de ácidos de Lewis
CH3
+ CH3Cl
AlCl3
+ HCl
01) No 3 – metil pentano, cuja estrutura está representada
a seguir:
1
H3C
2
3
CH 2
CH
6
4
CH 2
5
CH 3
CH 3
O hidrogênio mais facilmente substituível por halogênio
está situado no carbono de número:
a) 1.
b) 2.
c) 3.
d) 4.
e) 6.
02) Fenol (C6H5OH) é encontrado na urina de pessoas
expostas a ambientes poluídos por benzeno (C6H6).
Na transformação do benzeno em fenol ocorre
a) substituição no anel aromático.
b) quebra na cadeia carbônica.
c) rearranjo no anel aromático.
d) formação de ciclano.
e) polimerização.
OH
+ ...
BENZENO
+ ...
FENOL
03) Considere a reação de substituição do butano:
LUZ
BUTANO + Cl2
X
+
ORGÂNICO
Y
INORGÂNICO
O nome do composto X é:
a)
b)
c)
d)
e)
cloreto de hidrogênio.
1-cloro butano.
2-cloro butano.
1,1-cloro butano.
2,2-dicloro butano.
CH3 – CH2 – CH2 – CH3
+
Cl2
carbono secundário é mais
reativo que carbono primário
2 – cloro butano
LUZ
1
2
3
4
CH3 – CH – CH2 – CH3
Cl
+
HCl
Diferem na velocidade de ocorrência e nos produtos obtidos que
dependem do radical presente no benzeno que orientam a
entrada dos substituintes
ORIENTADOR
NO2
+ HNO3
H2SO4
NO2
+ HNO3
H2SO4
NO2
Assim teremos:
ORIENTADORES ORTO – PARA
( ATIVANTES )
– Cl
ORIENTADORES META
( DESATIVANTES )
– OH
– NO2
– NH2
– SO3H
– CH3
– CN
– Br
–I
– COOH
( DESATIVANTES )
Os orientadores META possuem um átomo com ligação
dupla ou tripla ligado ao benzeno
MONOCLORAÇÃO DO FENOL
OH
ORIENTADOR
ORTO – PARA
– Cl
+ HCl
AlCl3
OH
+ Cl2
OH
AlCl3
+ HCl
Cl
ORIENTADORES ORTO – PARA
( ATIVANTES )
– OH
– NH2
– CH3
– Cl – Br – I
( DESATIVANTES )
ORIENTADORES META
( DESATIVANTES )
– NO2
– SO3H
– CN
– COOH
MONOCLORAÇÃO DO NITROBENZENO
ORIENTADOR
META
NO2
NO2
+ Cl2
AlCl3
ORIENTADORES ORTO – PARA
( ATIVANTES )
– OH
– NH2
– CH3
– Cl – Br – I
( DESATIVANTES )
– Cl
ORIENTADORES META
( DESATIVANTES )
– NO2
– SO3H
– CN
– COOH
+ HCl
01) (UNICAP-98) O clorobenzeno, ao reagir por substituição eletrofílica com:
V
0 0 HNO3, em presença de H2SO4, produz 2-nitroclorobenzeno.
F
1 1 Cl2, em presença de FeCl3, produz preferencialmente metadiclorobenzeno
V
2 2 CH3Cl, em presença de AlCl3, produz 4-metilclorobenzeno.
V
3 3 H2SO4, em presença de SO3, produz 2-hidrogenosulfato de clorobenzeno.
F
4 4 Br2, produz preferencialmente, em presença de FeCl3 3-bromo, cloro
benzeno.
Cl
1
6
2
3
5
4
o “cloro” é orientador
orto-para e desativante
02) Da nitração [ HNO3 (concentrado) + H2SO4 (concentrado), a 30°C ] de um certo
derivado do benzeno equacionada por:
6
A
+ NO
A
5
1
+
2
4
Fazem-se as seguintes afirmações:
F
V
2
3
I. O grupo “A” é orto-para-dirigente.
II. O grupo “A” é meta-dirigente.
V
III. Ocorre reação de substituição eletrofílica.
F
IV. Ocorre reação de adição nucleófila.
F
V. Ocorre reação de eliminação.
São corretas as afirmações:
a)
b)
c)
d)
e)
II e IV.
I e III.
II e V.
I e IV.
II e III.
NO 2
o “nitro” entrou na
posição “3”
então “A” é
orientador meta
REAÇÕES DE ADIÇÃO
As reações de adição mais importantes ocorrem nos ...
alcenos
alcinos
aldeídos
cetonas
REAÇÕES DE ADIÇÃO NOS ALCENOS
H
H
C
H
C
H + H
Cl
CCl
4
Os haletos de hidrogênio
reagem com os alcenos produzindo
haletos de alquil
H
H
H
H
C
C
C
H
+ H
Cl
H
CCl4
REGRA DE MARKOVNIKOV
“O hidrogênio ( H+ ) é adicionado ao
carbono da dupla ligação
mais hidrogenado”
o produto principal será o 2 – cloro propano
ADIÇÃO DE ÁGUA (HIDRATAÇÃO) AOS ALCENOS
H
H
H
H
C
C
C
H
+ H
OH
H
H+
o produto principal será o 2 –propanol
ADIÇÃO DE HALOGÊNIOS (HALOGENAÇÃO) AOS ALCENOS
H
H
H
H
C
C
C
H
+ Cl
Cl
H
CCl4
o produto será o 1, 2 – dicloro propano
HIDROGENAÇÃO DOS ALCENOS
H
H
H
H
C
C
C
H
+ H
H
H
CCl4
Essa reação ocorre entre o H2 e o alceno
na presença de catalisadores metálicos (Ni, Pt e Pd).
o produto formado é o propano
01) Com respeito à equação:
X + HBr C6H13Br
Pode-se afirmar que X é um:
a)
b)
c)
d)
e)
alcano e a reação é de adição.
alceno e a reação de substituição.
alceno e a reação é de adição eletrofílica.
alcano e a reação é de substituição eletrofílica.
alceno e a reação é de substituição.
ADIÇÃO DE HALETOS DE HIDROGÊNIO AOS ALCINOS
Ocorre a adição de 1 mol do haleto de hidrogênio
para, em seguida,
ocorrer a adição de outro mol do haleto de hidrogênio
H–C
C – CH3 + H – Cl
H–C
H
H
H–C
H
C – CH3
Cl
+ H – Cl
H–C
H
C – CH3
Cl
Cl
C – CH3
Cl
ADIÇÃO DE ÁGUA (HIDRATAÇÃO) AOS ALCINOS
A hidratação dos alcinos,
que é catalisada com H2SO4 e HgSO4, possui uma
seqüência parecida com a dos alcenos.
H–C
C – CH3 + H2O
H2SO4
H–C
C – CH3
HgSO4
H
OH
O enol obtido é instável se transforma em cetona
H–C
C – CH3
H–C
C – CH3
H
OH
H
O
Dependendo do enol formado poderemos obter no final um aldeído
ADIÇÃO DE REAGENTE DE GRIGNARD
A ALDEÍDOS E CETONAS
A adição de reagentes de Grignard (RMgX), seguida de hidrólise,
a aldeídos ou cetonas é um dos melhores processos
para a PREPARAÇÃO DE ALCOÓIS
O esquema geral do processo é:
metanal + RMgX
aldeído + RMgX
cetona + RMgX
H 2O
H 2O
H 2O
álcool primário
álcool secundário
álcool terciário
ADIÇÃO DE REAGENTE DE GRIGNARD AO METANAL
OMgBr
O
H
C
H
+ H3CMgBr
H
C
CH3
H
OMgBr
H
C
OH
CH3 + H2O
H
C
CH3 + MgOHBr
H
H
Podemos resumir estas reações da seguinte maneira:
O
H
C
H
OH
H3CMgBr
H
C
H 2O
H
CH3 + MgOHBr
O
H3C
C
H
OH
H3CMgBr
H2O
H3C
C
CH3
H
ETANAL
2 - PROPANOL
OH
O
H3C
C
CH3
PROPANONA
H3CMgBr
H2O
H3C
C
CH3
CH3
2 – METIL – 2 – PROPANOL
01) Dada à reação abaixo, podemos afirmar que o composto orgânico
obtido é o:
O
H 3C
C
+
H 2O
H3CCH2MgBr
H
a) ácido butanóico.
b) 1 – butanol.
OH
c) 2 – butanol.
d) etanol.
e) 2 – propanol.
H 3C
C
H
2 – BUTANOL
ou
BUTAN – 2 – OL
CH2
CH3
02) Um ALDEÍDO sofreu uma adição do cloreto de metil magnésio
seguido de uma hidrólise produzindo o 2 – PROPANOL. O aldeído
em questão chama-se:
a)
b)
c)
d)
e)
metanal.
etanal.
propanal.
2 – etanol.
propanóico.
O
O
H 3C
C
H
COMPOSTO
FORMADO
do reagente de Grignard
temos o CH3
H3CMgCl
H 2O
H
da água o “H”
ETANAL
a ligação livre
unirá,
também, da oxidrila
eliminando
estes
grupos
o carbono
e o oxigênio
temos
formando o ...
OH
H 3C
C
CH3
H
2 - PROPANOL
REAÇÕES DE ELIMINAÇÃO
As reações de eliminação são processos, em geral,
inversos aos descritos para as reações de adição e, constituem
métodos de obtenção de alcenos e alcinos
DESIDRATAÇÃO DE ALCOÓIS
A desidratação dos alcoóis segue
A desidratação (eliminação de água) de um álcool
a regra de SAYTZEFF, isto é, elimina-se
ocorre com aquecimento deste álcool
a oxidrila e o hidrogênio do carbono vizinho ao carbono da oxidrila
em presença de ácido sulfúrico
MENOS HIDROGENADO
H
H
H
H
C
C
C
H
OH H
CH3
H2SO4
H
H
H
H
C
C
C
H
menos hidrogenado
CH3 + H2O
Esta reação, normalmente, ocorre em
solução concentrada de KOH em álcool
O haleto eliminado
reage com o KOH produzindo sal e água
H
H
H
H
C
C
C
H
Cl
H
CH3
KOH(alc)
H
H
H
H
C
C
C
H
menos hidrogenado
CH3 + ...
Ocorre na presença do ZINCO
H
H
H
H
C
C
C
H
Br
Br
CH3
Zn
H
H
H
H
C
C
C
H
CH3 + ZnBr2
Na presença do KOH (alc) são eliminadas duas moléculas de HBr
que irão reagir com o KOH
H
H
H
H
C
C
C
H
Br
Br
H
CH3
KOH(alc)
H
C
H
C
C
CH3 + ...
As principais reações de
oxidação e redução com compostos orgânicos ocorrem
com os ALCOÓIS, ALDEÍDOS e ALCENOS
OXIDAÇÃO DE ALCOÓIS
O comportamento dos alcoóis primários, secundários e terciários,
com os oxidantes, são semelhantes
Os alcoóis primários, sofrem oxidação, produzindo aldeído
H
I
[O]
H3C – C – OH
I ETANOL – H2O
H
O aldeído,
ácido
se deixado em
O
H 3C – C
ETANAL
H
contato com o oxidante, produz
carboxílico.
O
H 3C – C
ETANAL
H
O
[O]
– H2O
H 3C – C
ÁCIDO ETANÓICO
OH
Os alcoóis secundários oxidam-se formando cetonas.
H
I
H3C – C – CH3
I
OH
[O]
– H2O
O
II
H3C – C – CH3
PROPANONA
2 – PROPANOL
Obs.: Os alcoóis terciários não sofrem oxidação
01) Quando um álcool primário sofre oxidação, o produto principal é:
a) ácido carboxílico.
b) álcool secundário.
c) éter.
d) álcool terciário.
e) cetona.
OXIDAÇÃO DE ALCENOS
Os alcenos sofrem oxidação branda originando dialcoóis vicinais
H H
I
I
H3C – C = C – CH3
[O]
branda
H H
I
I
H3C – C – C – CH3
I
I
OH OH
A oxidação a fundo, com quebra da ligação dupla, produz
ácido carboxílico e /ou cetona
H
H
I
I
H3C – C = C – CH3
[O]
a fundo
H
H
O I
I
H3C 2– H
+ O = C – CH3
C3=
C O– C
OH
01) Assinale a opção que corresponde aos produtos orgânicos da oxidação
energética do 2 – metil – 2 – penteno.
a) propanal e propanóico.
b) butanóico e etanol.
c) metóxi – metano e butanal.
d) propanona e propanóico.
e) etanoato de metila e butanóico.
H3C – C = C – CH2 – CH3
I
I
CH3 H
[O]
a fundo
O
H3C – IIC = O
H3C – CI – CH3 não sofre oxidação
CH3
PROPANONA
++
2 2––– C
3CC––CH
CH
CH3
OH=
I
ÁCIDO PROPANÓICO
OH
H
sofre oxidação produzindo
ácido carboxílico
O
OH
02) Um alceno “ X “ foi oxidado energeticamente pela mistura sulfomangânica
(KMnO4 + H2SO4). Os produtos da reação foram butanona e ácido metil
propanóico. Logo, o alceno X é:
a) 2 – metil – 3 – hexeno.
b) 3 – metil – 3 – hexeno.
c) 2, 4 – dimetil – 3 – hexeno.
d) 2, 5 – dimetil – 3 – hexeno.
e) 3, 5 – dimetil – 3 – hexeno.
1
H 3C
2
3
4
CH
C
O
CH3
H
OH
ÁCIDO METIL
2, 4PROPANÓICO
– dimetil –
5
6
O
C
CH2
CH3
3 – hexeno BUTANONA
CH3
OZONÓLISE DE ALCENOS
Um outro tipo de oxidação que os alcenos sofrem é a ozonólise
Nesta reação os alcenos reagem rapidamente com o ozônio (O3)
formando um composto intermediário chamado ozonídeo
A hidrólise do ozonídeo em presença de zinco rompe o ozonídeo,
produzindo dois novos fragmentos que contêm ligações duplas
carbono – oxigênio
O Zn forma óxido de zinco que impede a formação
de H2O2 que viria a reagir com o aldeído ou a
cetona
Quais os produtos da ozonólise seguida de hidrólise
na presença de zinco, do hidrocarboneto 2 – metil – 2 – buteno ?
H
H3C
C
O
C
OH3 + O3
C
ETANAL
CH3
PROPANONA
Zn
H2O
01) (Covest-2007) Observe as reações abaixo:
I
KOH (aq)
A)
H3C – CH2 – CH2 – CH – CH3
+
B)
H3C – CH2 – CH = CH2
HCl
OH
+
H2O
CH3
H2SO4 (com)
C)
H3C – CH2 – CH – CH – CH3
OH
H2SO4 / KMnO4
D)
H3C – CH2
1
B
reação
adição,
devendo
formar
como
substituição
devendo
O 3
2
O AA
2
reação
Areação
reação
CA
uma
éuma
uma
reação
reação
típica
eliminação,
deMarkovnikov.
oxidação,
emnucleofílica,
quedevendo
o 2-metil-2-penteno
gerarproduto
como
A
reação
BéDé
deve
seguir
adede
regra
de
3
4
41
principal
o
1-clorobutano.
formar
produto
principal
o 2-hidroxipentano.
deve
produto
ser como
oo
produto
ácido
acético.
formado
em maior
quantidade.
01) Considere o benzeno monossubstituído, em que “X” poderá ser:
X
O
CH3
I
NH 2
II
NO2
III
OH
IV
C
V
CH3
Assinale a alternativa que contém somente orientadores orto-para:
a)
b)
c)
d)
e)
I, III e V.
II, III e IV.
III, IV e V.
I, II e IV.
I, IV e V.
02) (PUC – PR) A monocloração do 2 – metil pentano pode fornecer vários
compostos, em proporções diferentes. Dos compostos monoclorados
isômeros planos, quantos apresentarão carbono quiral ou assimétricos?
a) 4.
b) 5.
c) 1.
d) 2.
e) 3.
03) Em relação aos grupos (– NO2) e (– Cl), quando ligados ao anel aromático,
sabe-se que:
O grupo cloro é orto – para – dirigente.
O grupo nitro é meta – dirigente.
Cl
NO 2
Assim no composto a seguir, possivelmente ocorreu:
a) nitração do cloro – benzeno.
b) redução de 1 – cloro – 3 – amino – benzeno.
c) cloração do nitrobenzeno.
d) halogenação do orto – nitrobenzeno.
e) nitração do cloreto de benzina.
04) Na reação do 2 – metil – 1 – propeno com hidreto de bromo, forma-se:
a) 2-bromo 2-metil propano.
b) 1-bromo 2-metil propano.
c) isobutano.
d) 1-bromo 2-metil propeno.
e) 2-buteno.
05) Uma reação típica dos alcenos é a adição de halogênios à ligação dupla,
formando compostos di-halogenados vicinais, conforme exemplificado a
seguir:
H 3C
CH
C
C H 3 + Br
2
CH 3
(I)
H 3C
H
Br
C
C
Br
CH3
CH 3
(II)
Em relação a essa equação, podemos afirmar que:
a) O composto II apresenta dois carbonos assimétricos.
b) O nome do produto formado é 2,3 – dibromo – 3 – metil – butano.
c) O nome do composto I é 2 – metil – 2 – buteno.
d) O alceno pode apresentar isomeria geométrica.
e) O nome do produto formado é 2, 3 – dibromo – 2 – metil – propano.
06) (Covest-2002) No ciclo de Krebs, o ácido cítrico é convertido no ácido
isocítrico tendo como intermediário o ácido Z-aconítico:
Sobre esta reação, podemos afirmar que:
a) O composto (1) é H2.
b) É uma reação de desidratação.
c) O ácido Z- aconítico apresenta isomeria óptica.
d) É uma reação de substituição.
e) O composto (1) é O2.
07) (UPE-2007 – Q2) Analise as equações químicas a seguir:
C3H4 + 2 HCl
A
C2H4O + KMnO4 (meio ácido)
C2H5OH + H2SO4(conc) (170ºC)
B
C
As substâncias orgânicas formadas A, B e C têm como nomenclatura IUPAC
respectivamente:
a) propan – 1 – ol, etanol e ácido etanóico.
b) 2, 3 – diclorobutano, eteno e etanal.
c) 2, 2 – dicloropropano, ácido etanóico e eteno.
d) cloroetano, etano e etanol.
e) clorometano, ácido etanóico e etino.
08) (Covest – 2007) Utilize as energias de ligação da Tabela abaixo para
calcular o valor absoluto do ΔH de formação (em kJ/mol) do
cloro – etano a partir de eteno e do HCl.
ligação
energia (kJ/mol)
ligação
energia (kJ/mol)
H–H
435
C – Cl
339
C–C
345
C–H
413
C=C
609
H – Cl
431