Antes
Depois
A pilha é uma fonte de tensão
elétrica capaz de garantir uma
corrente elétrica permanente num
circuito.
A primeira pilha foi construída por Luigi Aloísio Galvani no século XVIII, suas
pesquisas influenciaram Alessandro Volta, que após muitas pesquisas
desenvolveu um dispositivo formado por prata e zinco ou prata e chumbo ou
prata e estanho ou por cobre e estanho,”a pilha”.
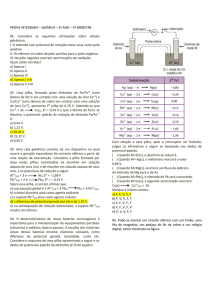
A pilha de Daniell é constituída de uma placa de Zinco (Zn) em uma
solução de ZnSO4, de concentração 1mol/L, e uma placa de Cobre (Cu) em
uma solução de CuSO4, de concentração 1mol/L. As duas soluções são
ligadas por uma ponte salina, ou por uma parede porosa, como mostra o
esquema.
Os elétrons circulam do eletrodo de maior potencial de oxidação para o de
menor potencial de oxidação. No caso da pilha de Daniell os elétrons vão
do zinco para o cobre.
Zn° → Zn 2+ + 2ē
Cu 2+ + 2ē → Cu°
Zn°(s) + Cu 2+(aq) → Cu°(s) + Zn 2+ (aq)
Pólo positivo – o de menor potencial de
oxidação – Cu.
Pólo negativo – o de maior potencial de
oxidação – Zn.
Cátodo – placa de menor potencial de oxidação Ag+. Onde ocorre
redução.
Ânodo – placa de maior potencial de oxidação NO3- . Onde ocorre
oxidação.
Em eletroquímica, o potencial padrão de eletrodo, denotado como
Eo, E0 ou EO é a medida do potencial individual de um eletrodo
reversível (em equilíbrio) no estado padrão, no qual as espécies
eletroativas estão a uma concentração de 1 mol/kg, e gases a uma
pressão de 1 bar. Os valores são mais freqüentemente tabulados a
25 °C.
A diferença está na composição, as pilhas comuns, são compostas de zinco
metálico em meio ácido separado por um papel poroso; já as pilhas
recarregáveis são na maioria das vezes compostas de uma liga de níquel
cádmio. As pilhas comuns produzem uma reação não reversível, já as pilhas
recarregáveis produzem uma reação reversível.
Para inibir a corrosão intergranular de superfícies metálicas. A
presente invenção é dirigida ao uso de um produto de reação entre
um alquinodiol e uma poliamina de polialquileno para inibir a corrosão
intergranular de superfícies metálicas em sistemas de processamento
industriais causada por névoa de água de pulverização ou por
condensação.
Qualquer metal utilizado em estruturas submetidas a ambientes
oxidantes, com o objetivo de ser oxidado em seu lugar. Esse metal deve
possuir menor poder de redução do que o material utilizado na estrutura,
para que possa ser "sacrificado" e protegê-la. O zinco e o magnésio são
metais comumente utilizados com esse objetivo.
O amálgama de prata utilizada pelo cirurgião-dentista, trata-se de uma liga
quem contém prata, mercúrio e estanho, podendo haver também o zinco e o
cobre. Ela visa selar (obturar) a cavidade causada pela doença cárie e pela
manobra operatória do dentista ao remover tecido. Ao encostarmos outro metal
ocorrerá uma reação entre esse matais ocorrendo uma sensação de “choque”.
Com o passar dos anos um objeto de prata por exemplo, começa a
oxidar, escurecendo sua superfície, com o uso de agentes redutores
essas superfícies escuras vão amolecendo facilitando a limpeza do
mesmo.
Pilhas secas são pilhas cujo os eletrodos, zinco e carvão, estão
mergulhados em uma massa de cloreto de zinco e sal amoníaco.
Pilhas úmidas são assim chamadas porque os eletrodos, cobre e
zinco, são colocados dentro de uma solução ácida, básica ou salina.
Todos nos sabemos que as pilhas são compostas por metais pesados, e que
esses metais são altamente prejudiciais ao meio ambiente e a nossa saúde. Por
conter esse metais, quando jogada no meio ambiente esses compostos são
liberados, causando sérios danos a saúde pois são altamente tóxicos.
Vítima de contaminação por pilhas
Pilhas e baterias inutilizáveis devem ser
depositadas em local apropriado como esta
lixeira, assim estaremos contribuindo com o
meio ambiente, conseqüentemente, com nós
mesmos.
http://br.answers.yahoo.com/question/index?qid=20081106145134AAx9
qUD
http://pt.wikipedia.org/wiki/Zinco
http://www.infoescola.com/quimica/pilha-de-daniell-pilhaeletroquimica/
http://www.ebah.com.br/relatorio-eletroquimica-pdf-a17647.html
http://educar.sc.usp.br/quimapoio/pilh.html
http://www.slideshare.net/Aikhaa/aula-show-eletroquimica-200714-11-presentation
http://images.google.com.br/images?hl=ptBR&source=hp&q=pilhas&gbv=2&aq=f&oq=
Marcilio N° 24
Cristian N°08
Thiago da Silva N° 31