Revisão da aula anterior
• Alcanos e Cicloalcanos
• Estereoquímica
• Estabilidade da conformação
• Isômeros
• Constitucionais
• Estereoisômeros: diasterômeros, enantiômeros
• Alcenos
• Haletos de Alquila
Álcoois
Álcoois
• Compostos com grupo hidroxila ligados a átomos de carbonos
saturados com hibridização sp3.
• São abundantes na natureza e muito importante para a industria.
• Diferem dos hidrocarbonetos por formar pontes de hidrogênio.
• Pode se comportar como ácido ou como base.
H
R
O
H
+
Álcool
R
O
H
Álcool
+
H
H X
R
O+
H
+
-
Base
Nucleófilo
X
Íon oxônio
O
H
R O
-
H
+
H
Íon Alcóxido
O+
H
Íon Hidrônio
Ácido
Eletrófilo
Reações Químicas
O
C
O
R
R´
Cetonas
C
R
ROH
Alcoóis
C
H
Alcenos
O
C
R
OR´
Ésteres
H
C
R
C
R
OH
Ác. carboxílicos
R
H
Aldeídos
RX
Haletos de
alquila
O
R O R´
Éter
Reações Químicas
• As reações dos álcoois dividem-se em dois grupos –
aquelas que ocorrem na ligação C-O e as que ocorrem na
ligação O-H.
• Reações de acidez: (O-H)
ROH + NaH RO-Na+ + H2
R
O
H
Álcool
+
H
O
H
R O
-
H
+
H
Íon Alcóxido
O+
H
Íon Hidrônio
Reações de formação de Fosfatos de alquila
O
ROH +
HO
P
O
OH
OH
Álcool
- H2O
Ác. Fosfórico
RO
P
OH
OH
Diidrogenofosfato
de alquila
O
RO
P
O
OH
OR
Hidrogenofosfato
de dialquila
ROH
- H2O
RO
P
OR
OR
Fosfato
de trialquila
ROH
- H2O
• Os ésteres dos ácidos fosfóricos são importantes nas reações
bioquímicas. Os trifosfatos de alquila são compostos relativamente
estáveis no meio aquoso.
• As enzimas, por outro lado, são capazes de catalisar as reações
desses trifosfatos e a energia que se torna disponível (trifosfato de
adenosina – ATP)
O
ROH
+
HO
P
Ligação éster
O
RO
P
OH
O
OH
O
O
O
P
OH
O
O
O
P
OH
OH
H2O
lenta
RO
P
OH
HO
OH
RO
P
OH
P
O
OH
O
O
P
O
O
O
P
OH
P
OH
OH
O
Ligação Anidrido
+
O
P
OH
OH
OH
O
OH
+
HO
P
OH
OH
O
RO
P
OH
O
O
P
OH
O
O
P
OH
OH
+
• Reações de Desidratação: (C-O)
H
OH
+
H3O
C C
CH3
H3C C CH2CH3
OH
H
R C
H3C
2-metil-1-buteno
minoritário
OH
OH
<
C CH2 CH3
+
H3C
2-metil-2-buteno
majoritário
OH
2-metil-2-butanol
H2O
H2C
C CH CH3
T HF, 50º C
H
+
H3C
+
H3O
R C
C C
H
R
Reatividade
<
R C
R
R
Reações de oxidação-redução
A redução de uma molécula orgânica corresponde,
normalmente, ao aumento de seu conteúdo de
hidrogênio ou à diminuição de seu conteúdo de
oxigênio.
Oxigênio diminui
O
R C OH
O
[H] Redução
R C H
[O] Oxidação
Ác. Carboxílico
Aldeído
Hidrogênio aumenta
O
R C H
Aldeído
[H] Redução
H
R C OH
[O] Oxidação
H
Álcool
O oposto da redução é a oxidação. Assim, a oxidação de uma
molécula orgânica é o aumento do seu conteúdo de oxigênio ou a
diminuição de seu conteúdo de hidrogênio.
O
O
[H] Redução
R C OH
R C H
[O] Oxidação
Ác. Carboxílico
Aldeído
Oxigênio Aumenta
A oxidação de um composto orgânico pode ser definida de maneira
mais generalizada como uma reação que aumenta seu conteúdo
através de qualquer elemento mais eletronegativo que o carbono.
[O]
[O]
Ar
CH3
Ar CH2Cl
[H]
[H]
[O]
Ar CHCl2
[H]
Ar CCl3
• Reações de oxidação-redução de álcoois: (C-O)
Álcool primário
OH
R
H
O
[O]
C
H
R
C
H
aldeído
álcool
O
[O]
R
C
OH
ácido carboxílico
Álcool secundário
OH
R
R'
O
[O]
C
H
R
C
R'
oxidação
cetona
álcool
Álcool terciário
OH
O
C
C
H
OH
R
R'
[O]
C
R''
álcool
NÃO OCORRE
redução
Quando um composto orgânico é reduzido, algo – o
agente redutor – deve ser oxidado.
E quando um composto orgânico é oxidado, algo – o
agente oxidante – é reduzido.
NAD
FAD
Ciclo de Krebs
Sistemas Insaturados
Conjugados
Sistema insaturado Conjugado
Sistemas que possuem um orbital p em um átomo
adjacente a uma ligação dupla – moléculas como ligações
deslocalizadas – são chamados sistemas insaturados
conjugados.
Esse fenômeno geral é chamado conjugação .
H
H
C
C
H
C
H
Propeno
H
H
Átomos de hidrogênio alílico
Etapa de iniciação da cadeia
Cl Cl
luz
2
Cl
Radical cloro
Primeira etapa de propagação da cadeia
H
H
H
C C
H
C C
H
C
H
H
H
Cl
H
C
H
+
HCl
H
Radical Alila
Segunda etapa de propagação da cadeia
H
H
H
C C
H
CH2
H
C C
Cl Cl
H
+
CH2 Cl
cloreto de alila
Cl
Estabilidade do Radical Alila
-
X
2
H C
H
H
C
X
H
3
1
2C
H C
1
H
C H
H
H
H
+
3C
H
H
Carbono hibridizado
em sp 3
2
H C
H
1
C
H
Carbono hibridizado
em sp 2
3
C H
H
H
2
1
3
H C C C H
1/2
1/2
H
H
Ordem relativa da estabilidade do carbocátion
C
C
+
+
> C C+ > CH2 CHCH
>
2
C
C C C C
Alílico substituido
>
3º >
Alila
H
+
C C + > C C + > CH2 CH
H
H
2º
>
>
1º
>
Ressonância
H
H
C
C
H
H
C+
H
D
H
H
+C
C
H
C
H
E
H
Vinila
Regras de Ressônancia
1. Estruturas de ressonância só existem no papel.
2. Ao escrever estruturas de ressonância, podemos mover apenas os
elétrons.
+
+
+
CH3 CH CH CH2
CH3 CH CH CH2
CH2 CH CH CH2
1
2
3
Estas são estruturas de ressonância para o
cátion alílico formado quando o 1,3-butadieno
aceita um próton
Esta não é uma estrutura de
ressonância apropriada para o
cátion alílico pois um átomo
de hidrogênio foi retirado.
3. Todas as estruturas de ressonância deve possuir o mesmo número
de elétrons não-emparelhados.
4. Todos os átomos que fazem parte do sistema deslocalizado devem
ficar em um plano ou quase plano.
Compostos Aromáticos
Compostos aromáticos
Ser classificado como aromático significava que o composto
possuía uma baixa relação hidrogênio/carbono e que era
“fragrante” (possuía aroma).
O
C
Benzeno
Benzaldeído
CH3
H
Tolueno
Hoje em dia usamos a palavra aromático para nos referir ao
benzeno e seus derivados estruturais.
Aromáticos sintéticos
CH3 O
CH3
HO
N
H
Cl
O
H
O
H
N
N CH3
HO
OH
Estrona
Morfina
Diazepam (valium)
Fontes: Carvão e petróleo
Estabilidade química: Embora o benzeno seja claramente um
composto insaturado, é muito mais estável que um alceno típico e não
sofre as mesmas reações químicas.
Benzeno
150 kJ/mol
(diferença)
1,3-cicloexadieno
-356 kJ/mol
(esperado)
Cicloexeno
-230 kJ/mol
-118 kJ/mol
-206 kJ/mol
(atual)
cicloexano
Estabilidade devido ao preenchimento completo dos orbitais moleculares,
obedecendo a regra do 4n + 2 de Hückel
Cátion
4 elétrons pi
não aromático
H
Radical
5 elétrons pi
Ânion
6 elétrons pi
N H
N
Piridina
Pirrol
aromático
Fenóis
• Grupo OH ligado a um anel benzênico
• Utilizado na fabricação de polímero, colas, explosivos, defensivos
agrícolas, conservante de alimentos, outros.
• Encontra-se em abundancia na natureza.
OH
OCH2CO2H
OH
Cl
Cl
Cl
Cl
Cl
Pentaclorofenol
(Conservador de madeira)
Cl
Cl
Ác. 2,4-diclorofenoxiacético
2,4-D (herbicida)
OH
Cl
Cl
Cl
Cl Cl
Cl
Hexaclorofeno
(anti-séptico)
Reações Químicas
• Reações de substituição Aromática Eletrofílica:
• Os fenóis são substratos muito reativos nas reações eletrofílicas
de halogenação, nitração, sulfonação.
• Oxidação de Fenóis: Quinonas
Os fenóis não sofrem oxidação da mesma maneira que os álcoois
porque não tem um átomo de hidrogênio ligado ao átomo de
carbono que contém o grupo OH.
O
OH
oxidante
H2O
Fenol
O
Benzoquinona
• As quinonas constituem uma classe de compostos muito interessante
e valiosa em razão de suas propriedades de oxidação-redução, ou
propriedades redox.
OH
O
SnCl2, H2O
Sal de Fremy
O
Benzoquinona
OH
Hidroquinona
• As quinonas podem ser reduzidas facilmente a hidroquinonas
• As quinonas são importantes no funcionamento dos organismos vivos,
em que os compostos conhecidos como Ubiquinonas agem como
agentes oxidantes bioquímicos na mediação de processos de
transferência de elétrons envolvidos na produção de energia.
O
CH3O
CH3
CH3
CH3O
Coenzima-Q
(CH2CH CCH2)nH
O
Ubiquinonas (n = 1-10)
• As ubiquinonas atuam dentro da mitocôndria das células para mediar
o processo respiratório no qual os elétrons são transportados a partir
de um agente redutor biológico, o NADH, para o oxigênio.
• Por meio de várias etapas complexas, o resultado final é um ciclo em
que o NADH é oxidado a NDA+, O2 é reduzido em água e energia é
liberada. A ubiquinona age apenas como intermediária e, portanto, não
sofre alteração.
Etapa 1
O
CH3O
NADH
+
+
H
CH3
CH3O
CH3
+
+
CH3O
R
O
Forma
reduzida
OH
CH3O
+
NAD
R
OH
Forma
Oxidada
Etapa 2
OH
CH3O
O
CH3
+
CH3O
CH3O
1/ 2
O2
+
R
CH3O
OH
Resultado final:
CH3
H2O
R
O
NADH
+ 1/ 2
O2
+
+
H
+
NAD
+
H2O
Compostos Carbonílicos
• Os compostos carbonílicos fazem parte da maioria das
moléculas biologicamente importantes (carboidratos,
aminoácidos, etc.)
• Muito importante na indústria farmacêutica e química.
O
H
N
O
CH3 C
OH
C
CH3
OH
C
O
O
O
C
O
n
Ácido acético
(ácido carboxílico)
Acetaminofen
(amida)
Dacron
(Poliester)
Grupos de Compostos Carbonílicos
O
R C
R C
R C
R C
H
OH
R
Aldeídos
Cetonas
O
O
O
C
C
C
R
R'
O
Éster
R
O
O
O
N
Amida
Ácidos carboxílicos
C
O
Lactona (éster cíclico)
X
Haleto ácido
O
O
C
C
R
O
R'
Anidrido ácido
Natureza dos Grupo Carbonílico
+
Comportamento
de um eletrófilo
(ácido de Lewis)
C O
Comportamento
de um nucleófilo
(base de Lewis)
-
Aldeídos e Cetonas
• São estruturalmente semelhantes, diferenciam-se porque os
aldeídos possui pelo menos um átomo de hidrogênio ligado a
carbonila.
• Aldeídos e cetonas são largamente encontrados na natureza,
aparecendo em fragrâncias, corantes, hormônios, açúcares, etc.
O
O
O
C
C
C
H
H
R
H
H
R
O
O
O
C
C
C
R
R
Aldeídos
Cetonas
O
O
C
O
H
C
H
O
OH
O
Vanilina
Aromatizante
Progesterona:
Hormônio Feminino
O
C
O
H
H
CH2OH
C
H
O
OH
Vanilina
Aromatizante
CH3
OH
O
OH
H
OH
H
H
OH
H
OH
H
OH
H
OH
CH2OH
D-Glicose
CH2OH
D-Frutose
CH3
OH
H
H
C
D-Gli
Reatividade dos Aldeídos e Cetonas
Nu:
Nu:
H
H
H C
C
H
H
Aldeído
O
H C
C O
H
H C
H
H
Cetona
Maior impedimento estérico
Reações dos Aldeídos e Cetonas
• A reação mais comum de aldeídos e cetonas é a
reação de adição nucleofílica
O
:Nu
C
O
-
C
Nu
Carbono sp2
Carbono carbonílico
Carbono sp3
Intermediário tetraédrico
HO
-
-
HOH
H
Nu:
Negativos
R3C
RO
-
ROH
Neutros
H3N
-
N C
RNH2
-
H O
-
O
H3C
C
H
O
C
CH3
cetona ou
aldeído
H3C
H3C
-
+
H
H
íon alcóxido
H
OH
C
H3C
H3C
álcool
H
+
H2O
Adição Nucleofílica de Água: Hidratação
O
OH
+
C
H3C
H2O
CH3
Acetona (99,9%)
Dióis geminais
Acetona hidratada (0,1%)
OH
O
+
C
H
H3C C
H3C OH
H2O
H
Formaldeído (0,1%)
H C
H OH
Formaldeído hidratado (99,9%)
Mecanismo da reação:
O H
O
BASE
O
C
H
-
OH
C
C
-
OH
OH
OH
-
+
OH
H
O
ÁCIDO
C
H O
+
H
+
O
H
C
OH
OH
C
C
O
O H
H
+
H
H
O H
H
+
OH
H3O
+
Adição Nucleofílica de Álcoois:
Hemiacetais e Acetais
+
O
H Cl
O
H
O
- H3O+
C
C
C
H
O
+
O
H Cl
H
C
R
O -R
H
HOR
álcool
Hemiacetal
O H
H
H
+
O
H
C O
C
O R
R O H
R
R
+
+
R
R
C O
C O
O
O
R
H
O H
H
Acetal
+ H3O
+
Hemiacetais Cíclicos
Frutose
Galactose
Glucose
6
1
H
H C O
2
C5
H C OH
3
C
HO C H
OH
C3
4
4
H C OH
CH2OH
6
C5
CH2OH
C
CH
O
1
4
C2
H
C3
O H
CH
O
1
C2
5
H C OH
H2
6
Rotação do carbono 5
C OH
D-Glicose
6
CH2OH
C5
C
O
C1
H
C3
4
CH2OH
H
O
=
Hidroxíla na posição axial
C2 OH
OH
alfa-D-glicopiranose
OU
6
CH2OH
C5
C
4
H
C3
O
H
C1
C2 OH
beta-D-glicopiranose
Hemiacetal cíclico
(Glicopiranose)
CH2OH
=
O
Hidroxila na posição equatorial
OH
Mecanismo da reação:
H
H O
H O
H
C O
+
H
R
C O
R
R'
O
H C O H
R
Hemiacetal
H O
H
H
+
H O
+
H
H
R'
+
H
O
H
R'
+
H C O H
R
Formação de Acetais
H
R'
H O
H O
H
C O
+
H
H
C O
H
R
H O
+
O
H
R
+
H C O H
R'
R
H
R'
R'
R'
O
O H
O
H C O H
+
H O
+
H C O
H
H
R
+
+
H C +
H
H2O
R
R
Hemiacetal
H
R'
R'
O
H C
R
+
O H
O
O H
H O R''
H C O
R
+
R'
R''
H C O R'' +
R
Acetal
H O
+
H
H
Glicosídeo
Carbono Anomérico
CH2OH
H O
O
+
CH2OH
H
CH2OH
O
O
H
H
OH
O
+
+
H
Hemiacetal
beta-D-glicopiranose
Ligação Glicosídica
H
CH2OH
CH2OH
O
+
O
H O R'
O H
H
O
+
R'
CH2OH
O
O
Acetal
beta-D-glicopiranosídeo
R'
Formação do Polissacarídeos
H C O
H C OH
HO C H
O
H C OH
CH2OH
OH
H2 C OH
Glicose
Ligação
glicosídica
C OH
HOH2C
CH2OH
H C OH
C OH
frutose
OH
O
C
H C OH
H2
O
O
CH2OH
C O
HO C H
Ligação alfa
Glicosídica
O
C
H C OH
H2
Carbono
anomérico
CH2OH
Carbono
anomérico
Ligação beta
glicosídica
Sacarose
HOH2C
Adição Nucleofílica de Aminas
• Adição nucleofílica de aminas primárias (RNH2)
• As aminas primárias reagem com os aldeídos ou cetonas
formando iminas (R2C=NR), um composto importante em muitos
caminhos metabólicos.
• Adição nucleofílica de aminas secundárias (R2NH)
• As aminas secundárias reagem com os aldeídos e cetonas
formando enamidas, também conhecidas como aminas insaturadas
(R2N-CR=CR2).
Adição nucleofílica de aminas primárias (RNH2)
+
O
O
C
R
R'
:NH2R
H
H
O H
O H
H
-
OH
H
R C +
N HR
R'
R C
NHR
R'
Carbinolamina
C N R
Imina
+
H3O
+
H
O
+
H
R C
NHR
R'
C N
+
H
R
íon imínio
Adição nucleofílica de aminas secundárias (R2NH)
H
+
O
O
C
C
+
N C
H
R R'
C
OH
-
R
+
H
C
N
H
O H
H
O
C
C
R
R'
N
C
R'
:NHR2
H
H
R
+
C C
N
R'
O H
C C
R N
R'
Enamina
+
H3O
+
• O aminoácido alanina, por exemplo, é metabolizado no
corpo pela reação com o aldeído fosfato pirodoxal, um
derivado da vitamina B6, para produzir uma imina que
será posteriormente degradada
-
O3POCH2
C
H
-
O3POCH2
H
-
O
CO2
C
N
OH
CH3
H2N H CH3
H
N
-
H
CO2
C
C
N
OH
CH3
H
CH3
+
H2O
Reação de Cannizzaro: Reduções biológicas
O
O
O
C
O
H
-
OH
C
-
H
H
C
C
OH
H3O
Intermediário alcóxido
+
OH
Ácido benzóico
(oxidado)
H
H
C
OH
álcool benzílico
(reduzido)
A reação de Cannizzaro ocorre pela adição nucleofílica de –OH no
aldeído para produzir um intermediário tetraédrico, o qual expele íon
hidreto como grupo de saída. Uma segunda molécula de aldeído aceita
o íon hidreto em outra etapa de adição nucleofílica, resultante em uma
simultânea oxidação e redução, ou desproporcionamento.
NH2
OH
OH
O
N
CH2 O
O
P
O
C
H H
O
O
-
N
P
O
O CH2
-
NH2
OH
O
N
N
NADH
N
OH
O
R''
R''
N
O
N
OH
+
+
C
C
H H
NADH
NH2
R
R'
C
NH2
C
R R' H
O
O
Aldeído ou
cetona
NAD+
Álcool
Ácidos Carboxílicos
• O grupo carboxila é um dos grupos funcionais mais
amplamente encontrados na química e na bioquímica.
•O grupo carboxila é o grupo gerador de uma família
enorme de compostos relacionados chamados de
compostos acíclicos ou derivados de ácidos
carboxílicos.
O
O
O
O
C
C
C
C
R
R
Cl
O
O
O
C
C
C
NH2
R
Anidrido de ácido
Cloreto de acila
R
O
R
NHR
Amida
R
NRR'
R
R'
R C N
O
Éster
Nitrila
O
O
H O
O
R
C
C
O
+
C
R
R
H2O
C
O
R
OH
-
O
H
+
Ka =
Dímero de ácido carboxílico
O
+ NaOH
C
R
+
OH
Ácido carboxílico
(insolúvel em água)
-
[H3O ] [RCO2 ]
[RCO2H]
O
H2O
C
R
+
-
+
O Na
Sal de ácido carboxílico
(solúvel em água)
H2O
H3O
+
Reações do Ácido Carboxílico e Derivados
O
H2O
SOCl2
PCl3
PCl5
O
R'COO
C
R'OH
R
Cl
-
C
R
OH
Ácido carboxílico
O
C
C
R
O
R'
Anidridos ácidos
O
NH3; R'NH2; R'R''NH
R
O
-
a) HO
b) COCl
O
C
C
R
O
R C
O
a) H3O
b) ROH
NaOH
R
C
OR'
Éster O
NHR'
R
C
O
O
NH2
+
C
+
O Na
R
Carboxilato de sódio
C
R
C
C
OR' + R
OH
Éster
Ácido carboxílico
-
O NH4
+
O
R'R''NH
R
C
NR'R''
Amida
O
H3O
O
Secagem
C
R
NHR'
Amida
+
C
+
R'
OH
Ácido carboxílico
+
NH4
O
C O
R
Carboxilato
-
OH
P4O 10
R C N
+
NR'R''
O
Amidas
OR'
Éster
C
C
Amidas
O
C
R
R
R
O
+
NH2
R'OH
NH3; R'NH2; R'R''NH
OH
C
O
Anidrido ácido
O
O
C
C
R
OH + R'
OH
Ácido carboxílico Ácido carboxílico
H2O
R'
O
R
Cloreto de acila
O
O
H3PO4
+
NH3
Reações dos Derivados de Ácido Carboxílico
• Apesar do grande número de reações que os derivados do ácido
carboxílicos podem fazer, todos seguem o mesmo mecanismo de
reação. Uma reação do tipo adição-eliminação nucleofílica.
H
R
Nu
C O
H
+
H
+
Nu
R C O
L
Nu
-
L= (
Nu
-
R
L
Adição nucleofílica
C
C
O
Eliminação nucleofílica
O
Cl
O C
R'
Nu
+
R C O
L
-
L
H
OR'
NRR' )
R
O
+ HL
Exemplo:
R
O
O
C
C
O
O
-
R C O C
R'
H O
+
R'
R''
H
O
R''
O
O
C
R
R''
O
Éster
C
HO
O
O
R'
Ácido carboxílico
R
C
+
O
H
R''
-
O
O C
R'
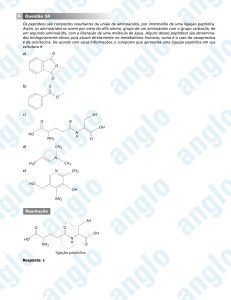
Exemplo: Ligação Peptídica
R
H O
H O
R C C OH +
R’
R C OH
R C C OH
NH2
NH2
O
+ R'
R C N H
H
HO
O
O
R'
N H
H
O
R C NH R'
-
R C OH
H
H O
N
+
H R'
H O
R C C NH C C OH
NH2
R
-
Ligação Peptídica
Aminas
• Aminas são compostos orgânicos que possuem um, dois
ou três grupos orgânicos (alquil ou aril) ligados a um átomo
de nitrogênio.
• Elas são classificadas como primárias (RNH2),
secundárias (R2NH) e terciárias (R3N).
H
H3C
N
CH3
H3C
N
H
CH3
Metilamina
amina primária
Trimetilamina
amina terciária
R'
N R
R'
N R
H
H
H
H
O
H
H
R
N R'
R''
N R
R'
N R
R'
Aminas terciárias
Aminas primárias ou secundárias
R'''
N
N
R R' R''
+
R R' R''
R'''
N
X YZ
Z
N
Y X
N
R'''
+
R R' R''
Aminas pode ter enantiômeros
R''
N
R'
+
R
CH2CH2NH2
CH3
HO
CH2 C H
NH2
CH2CH2NH2
HO
N
HO
H
Serotonina
Dopamina
Anfetaminas
CH2OH
HO
H3C
As aminas voláteis normalmente
tem odor bastante desagradável.
NH2
CH2OH
N
Anilina
Piridoxina
(vitamina B6)
OH
N
Nicotina
CH3
HO
Putrescina
H2NCH2(CH2)3CH2NH2
Cadaverina
Decomposição de proteínas por bactérias
CHCH2NHCH3
N
H2NCH2(CH2)2CH2NH2
CH3NH2
(CH3)2NH
(CH3)3N
Metilamina
Dimetilamina
trimetilamina
OH Adrenalina
odor de peixes
me
N
COOme
O
O
H
Cocaína
Reatividade das Aminas
N
+
+
+
N H
H A
-
A
As aminas são básicas (nucleófilos)
+
RNH2 + H2O
+
RNH3
+
-
OH
Kb =
-
[RNH3 ] [OH ]
[RNH2]
Nome
Estrutura
pKb
Alquilaminas primárias
CH3CH2NH2
3,19
CH3NH2
3,34
(CH3)2NH
3,27
(CH3CH2)2NH
3,51
(CH3CH2)3N
2,99
(CH3)3N
4,19
Alquilaminas secundárias
Alquilaminas terciárias
Arilaminas
Aminaheterocíclica
NH2
9,37
N
5,25
N H
0,14
Aminas x Amidas
O
H
H3C
N
Amina
H3C
H
C
O
N
H
H3C
C
H
+
N
H
H
Amidas
elétrons deslocalizados
Mais estável, menos reativas
Quando mais estável, menos reativo é o compostos
ou o grupo funcional.
Reações Químicas das Aminas
Reação ácido-base
N
+
H A
+
N H
+
-
A
Reação de alquilação
N
+
R CH2 Br
N CH2 R
-
Br
+
R
N
R X
N
+
H H H
H H H
Amônia
H2NR
+
H2O
-
OH
R
N
R X
R H H
Primária
N
+
R H H
+
HNR2
H2O
-
OH
R
N
N
R X
R R' H
Secundária
+
R R' H
R
N
R R' R''
Terciária
R X
N
+
R R' R''
NR3
-
OH
+
H2O
Reação de acilação
N
+
O
O
C
N C
R
Cl
R
Amida
Mecanismo de reação
O
N
O
C
R
Cl
N
+
-
C
H Cl
O
R
N
+
C
H
O
R
N C
Amida
-
Cl
R
Reação de acilação
O
O
O
H2N CH C OH
H2N CH C OH
R
-
H2N CH C OH
R
R
+
N H CH C OH
H
R'
O
O
H2N CH C
R
O
O
+
N H CH C OH
H
R'
-
OH
H2N CH C
R
O
NH CH C OH
R'
Ligação peptídica
Propriedade ácido-base
de Aminoácidos
O
O
C OH
C O
+
-
+ H
Ácido Carboxílico
H O
R C C OH
Amino
N
H
H
NH2
H
+
+
H
+
N H
H
Ácido
Base
H HO O
H O
CH
R 3 C CC COHO
R C C OH
+
H O
-
R C C O
+
N H3
NHN2 H3
pKa
Íon dipolar
(Zwitterions)
NH2
pKa
A forma não
dissociada não existe
-
Alanina
H O
CH3
H O
H O
C C OH
CH3
+
C C O
-
+
N H3
N H3
pKa = 2,3
Íon dipolar
CH3
C C O
NH2
pKa = 9,7
O ponto em que a concentração do íon dipolar será
máxima, ou seja o grupo catiônico e aniônico serão
iguais, é chamado de PONTO ISOELÉTRICO (pI)
pKa1 + pKa2
pI =
2
2,3 + 9,7
pI =
= 6,0
2
-
A equação de Henderson-Hasselbalch mostra que para
um ácido (HÁ) e sua base conjugada (A-):
pKa = pH + log
[HA]
[A-]
No ponto isoelétrico:
pKa = pH
Lisina
H
H
+
+
H3N (CH2)4 C COO
H3N (CH2)4 C COOH
+
N H3
+
N H3
pKa = 2,2
H
+
H3N (CH2)4 C COO
pKa = 9,0
NH2
-
H
-
H2N(CH2)4 C COO
pKa = 10,5
Íon dipolar
9,0 + 10,5
pI =
= 9,8
2
NH2
-
• Aplicado em técnicas de separação de
aminoácidos e proteínas
• Utilizado em medidas de eletroforese
• Comanda a solubilidade das proteínas.