Origem da palavra titrimetria: do inglês titration - titulação
VANTAGENS DA ANÁLISE TITRIMÉTRICA
Execução muito mais rápida que a análise gravimétrica
O método é fácil de ser instalado, economicamente viável
Apesar de serem técnicas relativamente antigas, elas representam ainda
economia e confiabilidade, podendo perfeitamente serem utilizadas na
identificação da grande maioria de agentes químicos em diversas
situações.
DESVANTAGENS DA ANÁLISE TITRIMÉTRICA
Método menos preciso que a gravimetria
A análise titrimétrica está baseada na operação de
titulação de uma solução por outra, cujas
características devem ser perfeitamente conhecidas.
Será necessário na titrimetria a padronização das
soluções envolvidas pois estaremos tratando com
concentrações as mais exatas possíveis.
1 Titrimetria ácido-base
O pH (potencial hidrogênio (H)) representa a quantidade de íons hidrogênio (H+)
presentes em uma solução. É um importante condicionador de reações químicas,
sendo de extrema importância sua precisa determinação e controle.
2. Titrimetria de Óxido-Redução
Este método envolve o uso de agentes oxidantes para a titulação de agentes redutores
(e vice-versa). Tendo como restrição básica a necessidade de grande diferença
entre os potenciais de oxidação e redução. O ponto final é detectado por meio de
indicadores químicos ou de vários métodos eletrométricos (indicadores físicos).
3. Titrimetria de Precipitação
O agente titulante forma um produto insolúvel com o analito. Apesar de ser efetuada
com técnicas semelhantes às da Gravimetria, não está limitada pela necessidade de
uma massa final mensurável, podendo lançar mão de outros parâmetros para a
quantificação de resultados.
4. Titrimetria de Complexação
Objetiva a formação de um complexo (solúvel em água) com o analito, um íon
metálico, este reagente muitas vezes é um agente quelante, as reações envolvidas
podem ser controladas pelo pH.
Tem como reação (que deve sempre ser considerada) a neutralização
dos íons H+ e OH- em soluções aquosas, gerando H2O.
Existem duas "variantes" cujos nomes derivam do tipo de soluçãopadrão utilizada:
• A acidimetria quando usamos soluções-padrão de pH menor que 7,0
• A alcalimetria, quando usamos soluções-padrão de pH maior que 7,0.
Objetivo:
• Determinação da quantidade de ácido que é quimicamente equivalente à
quantidade de base presente.
Ponto de equivalência, ponto estequiométrico ou ponto final teórico:
Onde ocorre o equilíbrio da reação:
Usam-se medidas de pH para determinar o ponto exato onde ocorre
o equilíbrio
1.Se o ácido e a base forem eletrólitos fortes o pH será igual a 7
2. Caso contrário o sal se hidrolisa em certa extensão e
consequentemente no ponto de equivalência (P.E.) a solução se
apresenta ligeiramente alcalina ou ligeiramente ácida. O Cálculo do
pH, neste caso, será partir da constante de ionização do ácido fraco
ou da base fraca e da concentração da solução
Indicadores Ácidos: possuem hidrogênio(s) ionizável(eis) na estrutura,
quando o meio está ácido (pH<7), a molécula de indicador é "forçada"
a manter seus hidrogênios devido ao efeito do íon comum, nesta
situação a molécula está neutra. Quando o meio está básico (pH 7), os
hidrogênios do indicador são fortemente atraídos pelos grupos OH(hidroxila) para formarem água, e neste processo são liberados os
ânions do indicador (que possuem coloração diferente da coloração da
molécula).
Indicadores Básicos: possuem o grupo ionizável OH- (hidroxila),
portanto, em meio alcalino (pH 7) as moléculas do indicador "são
mantidas" não-ionizadas, e em meio ácido (pH < 7) os grupos hidroxila
são retirados das moléculas do indicador para a formação de água,
neste processo são liberados os cátions (de coloração diferente da
coloração da molécula).
A diferença entre o ponto final (observado pela
mudança de cor) e o ponto de equivalência é o
inevitável erro de titulação. Quanto mais perto do pH
do ponto de equivalência for a da mudança de cor do
indicador, menor o erro do indicador ou erro de
titulação.
OBS: Nunca usar mais do que algumas gotas do
indicador para uma titulação, pois eles são preparados
em soluções ácidas ou básicas, e assim se for
utilizado um volume muito grande, ele poderá interferir
na análise.
Passos da análise dos sistemas titulométricos
para a escolha do indicador
Estes passos de análise teórica devem ser executados antes
da análise no laboratório, visto que, a não observância da
relação pH do ponto de equivalência/ pH do ponto final
poderá levar a um considerável erro.
Calcular o pH :
1. Antes de iniciar a titulação.
2. Entre o início da adição do titulante e o ponto de
equivalência.
3. No ponto de equivalência.
4. Entre o ponto de equivalência e o final da titulação.
PADRONIZAÇÃO DE SOLUÇÕES – PADRÃO PRIMÁRIO
Devem ser de fácil obtenção no mercado a preço razoável
Fácil de purificar, secar (110 oC a 120 oC), sem água na composição (de
hidratação,de cristalização).
Inalterável ao ar, o que implica em uma substância não higroscópica,
não-oxidável, estável ao CO2 atmosférico. Estas características são
especialmente importantes quando da pesagem e do armazenamento;
Deverá ter uma massa molecular elevada pois, deste modo, erros
referentes a manipulação e a aparelhagem serão minimizados (lembre
que muitas vezes trabalha-se com precisão de 10.10-4g);
Deve ser o mais solúvel possível em condições ambiente, um dos
grandes empecilhos ao uso de aquecimento são as vidrarias
volumétricas;
A reação de entre o padrão e a substância em teste deve ser a mais
rápida possível, ocorrer a temperatura ambiente, e ter estequiometria
definida;
Assim como existem quatro "tipos" de ácidos e bases, a saber
Ácidos fortes
Ácidos fracos
Bases fortes
Bases fracas
Existem quatro sistemas que podem ser genericamente representados
pelos gráficos pH x volume de titulante.
Como regra para a confecção das curvas, são colocados os valores do pH
da solução na vertical do gráfico em função da quantidade de reagente
titrimétrico adicionado (na horizontal do gráfico).
Observam-se os quatro sistemas titrimétricos, aqui representados por
gráficos das reações mais importantes de cada sistema.
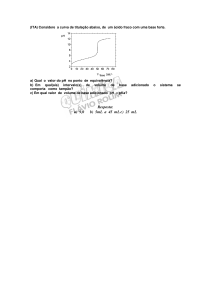
ÁCIDO FORTE/BASE FORTE
ÁCIDO FRACO/BASE FORTE
50 mL de ácido
clorídrico 0,1 M
50 mL de ácido
acético 0,1 M
ÁCIDO FRACO/BASE FRACA
BASE FRACA/ÁCIDO FORTE
100 mL de ácido
acético 0,1 M
50 mL de
hidróxido de
amônio 0,1 M