NAPARTICULAS POLIMERICAS
Sistemas Poliméricos
PREPARAÇÃO
E
APLICAÇÃO
Nanopartículas:
Diâmetro das partícula: 100 a1000nm
AULA 4 QF-933-2008
Introdução
Liberação Controlada de Fármacos
• Liberação de fármacos a uma velocidade
e/ou numa localização indicada para a
necessidade do corpo ou estado da
doença em um período especificado de
tempo:
– Liberação temporal: controle sobre a
velocidade da liberação do fármaco
– Liberação espacial: controle sobre a
localização do fármaco
Hamid Ghandehari in <[email protected] >
Introdução
Liberação espacial
= Molécula do fármaco
TUMOR
LIBERAÇÃO EXCLUSIVA DO FÁRMACO A TIPOS ESPECÍFICOS DE CÉLULAS
Hamid Ghandehari in <[email protected]>.
Introdução
Liberação temporal
P
L
s
m
a
Convencional
Liberação ordem zero
Efeitos adversos
Níveis tóxicos
Faixa terapéutica
Concentração
Min. efetiva
Sem efeito
l
e
v
e
l
Tempo/dosagem administrada
Sistema de Liberação Controlada
• O comportamento do fármaco in vivo pode ser mudado
drasticamente ao incorpora-lo num carregador. Os veículos de
liberação de fármacos coloidais podem prover:
– Liberação lenta de compostos as vezes tóxicos
– Habilidade de guiar uma distribuição sistêmica
– Habilidade de proteger fármacos de degradação ambiental
– Habilidade de direcionar a alvos específicos diretamente em
tecidos
• Sistemas coloidais em uso são:
–
–
–
–
Nanopartículas
Microesferas
Emulsões
Lipossomas
d<1mm
d>1mm
100nm<d<5mm
20nm<d<2mm
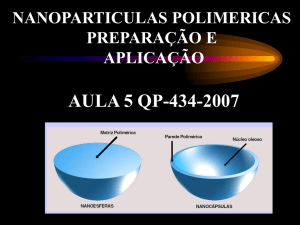
Micro/nanoesferas e capsulas
NANOESFERAS
Monoliticas
NANOPARTICULAS
NANOCAPSULAS
Adapted of Lambert,G. Oligonucleotide and Nanoparticles Page,
<http://perso.clubinternet.fr/ajetudes/nano/index. html> dez/ 2003.
Reservatorio
METODOS DE PREPARAÇÃO
• 1- Através de polimerização de monômeros
• Problemas:
obtidas
induzindo-se
a
polimerização. Difícil controle da extensão
da reação-massa molar não controlada.
Purificação posterior. Interação do polímero
com o ativo.
• 2- Diretamente da macromolécula
ou
polímero pré-formado.
Polímeros biodegradaveis
O
O
O
CH2
C
n
Poli(acido glicolico)
ou PGA
CH3
O
CH
O
C
n
C
(CH2)5
O
Poli (-caprolactona)
ou PCL
n
Poli(acido lactico)
ou PLA
Poly(3-hydroxybutyrate-co-valerate) or PHBV
CH3
O
CH2CH3
O
I
II
I
II
H–[ O– CH – CH2 – C –O– ]m –co – CH – CH2 – C ]n –OH
BIOPOLÍMEROS TÍPICOS
Polímeros biodegradáveis e bioabsorvíveis;
Degradação depende de: MM, estrutura, solubilidade,composição
da cadeia,grau de cristalinidade.
(PLGA)
EMULSIFICAÇÃO/EVAPORAÇÃO DE SOLVENTE
• Trata-se de um método simples, de fácil
transposição de escala e cuja realização em
condições assépticas garante a esterilidade
final do produto.
• Em linhas gerais o polímero é dissolvido
em solvente volátil em água, como CHCl3
ou CH2Cl2. Se dispersa em água por
emulsificação com temnsoativo apropriado.
Algumas revisões: Couvreur et al. Eur. J. Pharm. 41, 2 (1995); Alonso. Nanoparticulate drug
carrier technology. In Cohgen (Ed). Microparticuate Systems for the delivery of proteins and
Vaccines. M. Dekkrt, N.Y. 2996, p. 203; Soppomath et al., J. Control. Rel. 70, 1 (2001).
MÉTODOS MAIS IMPORTANTES DE
PREPARAÇÃO DE NANOPARTÍCULAS
Maria I. Rê e M.F.A. Rodrigues-IPT-2004
1-MÉTODO DE EMULSIFICAÇÃO/EVAPORAÇÃO
DE SOLVENTE
Sanchez et al. Int. J. Pharm. 99, 263
(1993); Zambaux et al. J. Control.
Rel. 50, 31 (1998); Verrechia et al.,
J. Biom. Mater. Res. 27, 1019 (1993)
FASE AQUOSA
Água destilada
Tensoativo
FASE ORGÂNICA
Solvente orgânico
Polímero
Agente ativo
Homogenizaçào
Sonicação
Após a formação da nanoemulsão, o solvente
EMULSÃO
se difunde para a fase externa (extração para
a fase aquosa) até saturação da mesma. Com a
Óleo em água
evaporação das moléculas do solvente que
atingem a interfase fase aquosa-ar, reestabelece-se
o gradiente de concentração, ou seja, a força motriz
para a difusão do solvente orgânico das nanogotas para
a fase aquosa. Ao ser eliminado o solvente, o polímero
precipita levando a formação das nanoesferas.
Extração do solvente
Evaporação do solvente
SUSPENSÃO DE NANOPARTÍCULAS
PREPARAÇÃO
Evaporação de solvente modificado
(nanoesferas).
2 solventes
solúveis
entre si
(um é nãosolvente
para o
polímero)
SEI, 22.000x, 20 kV, topografia
Laboratório -
Preparação: 10% (surfatante), 0,8%
SEI, 2.300 x, 20 kV, topografia
(polímero), 40%etanol/acetona
APLICAÇÃO
1- Formação de nanoesferas para substâncias lipofílicas. Este método
tem sido modificado para uma emulsão múltipla do tipo água/óleo/água.
2- Limitações: a) Emulsão óleo/água deve ter uma fase dispersa (óleo)
bastante fina e homogênea (requer bastante tensoativo e técnicas de
agitação elevada). b) Solventes orgânicos (clorados) e tensoativos usados
(álcool polivinílico, p.ex.) não são compatíveis com aplicações biológicas.
3- Alternativas: Uso de tensoativos como albumina de soro humano .
4- Propriedades otimizadas: diâmetro médio e distribuição de tamanho;
re-suspensão num veículo aquoso sem agregação; teor de fármaco; taxa
de liberação, taxa de degradação; esterilidade; apirogenecidade; e teor de
solvente residual.
5- Variáveis: Volume da fase aquosa para a fase orgânica; concentração
do polímero na fase orgânica; concentração do fármaco na fase orgânica;
presença de tensoativo em ambas fases (orgânica e aquosa); solubilidade
do fármaco na fase aquosa (nível de saturação); método e velocidade de
agitação.
-2-MÉTODO
DE
EMULSIFICAÇÃO
ESPONTÂNEA/DIFUSÃO DE SOLVENTE
(Niwa et al. J. Pharm. Biopharm. 25, 89 91993).
Um solvente miscível em água (acetona, etanol ou
metanol) é misturado ao solvente immiscível (CHCl3,
ou CH2Cl2). A difusão espontânea do solvente miscívil
no meio aquoso cria uma turbulência interfacial entre
as duas fases levando a formação de partículas menores.
Fase aquosa
Fase
orgânica
Difusão rápida do
solvente miscível
com água
Quanto maior a proporção do solvente miscívil na mistura
menores as partículas formadas.
Nanopartículas
3-MÉTODO DE NANOPRECIPITAÇÃO
Envolve o uso de um solvente orgânico que é completamente solúvel na fase
aquosa externa consequentemente a extração e a evaporação do solvente
não são nescesárias para a precipitação do polímero.
FASE AQUOSA
Água destilada
Tensoativo
FASE ORGÂNICA
Solvente orgânico
Óleo
Polímero
Agente ativo
p.ex. acetona
FASE ORGÂNICA
Solvente orgânico
Polímero
Agente ativo
Agitação
nanoesferas
nanocapsulas
SUSPENSÃO DE NANOPARTÍCULAS
Fessi et al. Eur Pat. 0275796 B1 (1987).
Metodo – Encapsulação de agente
ativo
“Nanoprecipitação” – método de deslocação de
solvente
CH 3
HO
CH 2 CH 2 O
CH CH 2 O
m/2
CH 2 CH 2O H
n
m/2
1,2% PLURONIC (1)
3% (PLGA / acetona) + 4 mg de agente ativo (2)
(2) colocado em (1)
PLGA nanoesferas – Encapsulamento de violaceina
PLGA-PLURONIC-PVA system
4-MÉTODO DE SALTING-0UT
Esta é baseada na formação de uma emulsão pela incorporação, sob agitação, de uma
solução aquosa saturada de alcool polivinílico (PVA) em uma solução de polímero dissolvido
em acetona. O PVA tem o papel de estabilizar a dispersão. Aqui a miscibilidade das duas
fases é impossibilitada pela saturação da fase aquosa com PVA. A precipitação do polímero
ocorre quando uma quantidade
FASE ORGÂNICA
adicional de água é adicionada
Solvente orgânico
permitindo então a difusão
Polímero
da acetona para a fase aquosa.
Agente ativo
Este método é adequado quando
ativo e polímeros são solúveis em solventes
FASE AQUOSA
polares como acetona ou etanol.
(sal)
Água destilada
Tensoativo (PVA)
Agitação
Ibrahim et al. Int. J. Pharm.
87, 239 (1992); Allemann et
al., Int. J. Pharm. 87, 247 (1992).
EMULSÃO
Água em óleo
Água destilada
SUSPENSÃO DE NANOPARTÍCULAS
5-MÉTODO DE EMULSIFICAÇÃO/DIFUSÃO DE
SOLVENTE
Envolve o uso de um solvente parcialmente miscível em água, que é previamente saturado
em água para garantir o equilíbrio termodinâmico inicial de ambas as fases. A precipitação
Ocorre quando uma quantidade adicional de água é adicionado ao sistema, permitindo
então a difusão do solvente para a fase aquosa.
Leroux et al. Eur. J. Pharm.
Biopharm. 41, 14 (1995).
Quintanar-Guerreo et al.
Pharm Res. 15, 1056 (1998).
Formada a emulsão do tipo
óleo/água e o tensoativo é
adsorvido na superfície das
gotas da fase orgânica
dispersas na fase aquosa
FASE AQUOSA
(saturada em solvente orgânico)
Água destilada
Tensoativo
Agitação
FASE ORGÂNICA
(saturada em água)
Solvente orgânico
Polímero
Agente ativo
EMULSÃO
A adição de água ao sistema
Óleo em água
desestabiliza o estado de equilíbrio
e promove a difusão do solvente
Água destilada
na fase aquosa levando à formação
das nanopartículas
SUSPENSÃO DE NANOPARTÍCULAS
VANTAGENS
Este método apresenta algumas vantagens sobre
o método de nanoprecipitação como a possibilidade
de controle do tamanho das nanopartículas. Estas
apresentam tamanhos superiores àquelas
preparadas por nanoprecipitação, normalmente
entre 250-600 nm, dependendo de vários
parâmetros como tipo e concentração do
tensoativo e do polímero, tempo e velocidade
de agitação.
Métodos para a preparação de nanopartículas carregadas
com fármacos convencionais
-------------------------------------------------------------Método
Polímero Fármaco Tamanho(nm)
o/w
o/w
o/w
o/w
solv-disp
solv-disp
solv-disp
solv-disp
solv-disp
o/w
o/w
PLA, PLA-b-PEG
PLA-PEG-PLA
PLGA
PEO-b-PBLA
PMLAiPr
PMLAnHe
PLGA
PLGA
PCL, PLA,
PCL-co-PLA
PEO-b-PCL
PLA
Lidocaine
Progesterone
Dexamethasone
Doxorubicin
Halofantrin
Halofantrin
Vancomycin
Procaine Hydr.
Nimodipine
Enalapril maleate
Lidocaine
247-817
193-335
109-155
37
150-160
90-190
160-170
<210
81-132
50
115-123b
PBLG = poly(g-benzyl L-glutamate); PBLA = poly(b-benzyl L-aspartate); PMLAiPr =
poly(b-malic acid isopropil ester); PMLAnHe = poly(b-malic acid neohexil ester).
b Dimension of unloaded particles.
a
PREPARAÇÃO DE MICRO E NANOPARTICULAS CARREGADAS COM
FÁRMACOS PROTEÍCOS.a
Método
Polímero
Proteina
Tamanho (nm)
w/o/w
w/o/w
w/o/w
w/o/w
w/o/w
w/o/w
w/o/w
w/o/w
w/o/w
w/o/w
w/o/w
PLGA
PLGA
PLGA
PLGA, PLA
PLGA/PLA blend
PLGA, PCL
PLA
PLGA
FITC-HRP
PLGA
PLGA
PLGA
Biod. polym.
PLGA
PLGA
PEG-PLGA
PEG-co-PBT
w/o/w
PLGA-b-PEO
w/o/w
w/o/w
o/w
o/w
L-asparaginase
BSA
BSA
BSA
BSA
BSA
Protein C
FITC-BSA
196-226
ms
100-200
ms
ms
20-1000
230-340
ms
TRH
IL-1a+BSA
Rism. porcine ms
Peptides
BSA
rhBMP
BSA
BSA
250-800
ms
BSA
300-600
ms
ms
ms
ms = microsize; CP = coprecipitation; FITC-BSA = fluorescein isothiocyanate-labeled BSA; FITC-HRP = fluorescein
isothiocyanate-labeled horseradish peroxidase; IL-1a = recombinant human interleukin-1a; rhBMP = recombinant
human bone morphogenetic protein-2
a
Spontaneous emulsification solvent diffusion (SESD) method
METODOLOGIA
No método original SESD, PLGA é dissolvido na mistura
de solventes orgânicos consistindo em diclorometano e
acetona, que são os solventes orgânicos menos miscíveis em
água e um solúvel livremente em água, respectivamente. A
solução polimérica obtida acima é lentamente vertida no
emulsificante contida na fase aquosa com agitação
mecânica. As nanopartículas são formadas via dos
seguintes passos: quando a solução polimérica é agregada,
gotículas do emulsificante são formadas na fase aquosa;
acetona rapidamente difunde para fora de cada gotícula de
emulsificante, reduzindo drasticamente seu tamanho a
ordem-nano e consequentemente processo de evaporação
do solvente, no qual o diclorometano remanescente é
removido do sistema, fazendo que as gotículas solidifiquem
para finalmente formar as nanopartículas poliméricas.
COMENTÁRIOS
Este processo parece bastante razoável, baseado num
fenômeno físico-químico interessante. Entretanto,
devido a quantidade considerável de diclorometano
residual, as partículas tendem a se agregar durante o
processo de evaporação do solvente.
Logo, quando uma grande quantidade de solução
polimérica é usada, a agregação não pode ser
prevenida devido a que a probabilidade de colisão
entre partículas na fase aquosa poderia aumentar.
Alem disto, o processo de recuperação e purificação
no método SESD original deverá ser melhorado, já
que a ultra-centrifugação ( 156200 x g, 1 h) é
inaceitável para processos industriais em grande
escala de produção. Também que se evitar o uso de
solventes clorados tais como diclorometano devido a
sua toxicidade.
No processo modificado-SESD, a mistura de dois
solventes orgânicos miscíveis em água, tais como
etano:acetona
ou
metanol:acetona
foram
empregados em vez de usar a mistura de
diclorometano e acetona. Esta alteração previne a
agregação de partículas ainda em condições de
alta quantidade de solução do polímero,
resultando na melhora do rendimento aceitável
para propósitos industriais. Esta alteração
também permite alguma vantagens adicionais;
por exemplo o uso de solventes tóxicos como o
diclorometano o processo de purificação e
recuperação podem ser simplificados usando
ultrafiltração para omitir processos de
evaporação do solvente; e nanopartículas
uniformes podem ser obtidas sempre por agitação
suave.
Figura 2. Efeito de quantidade adicionada de PLGA sobre o
rendimento de nanopartículas. (●) método modificado SESD
(Etanol:acetonas 4:6); (O)SESD original (DCM:acetona 4:96)
Figura 3. Efeito da concentração de PLGA no rendimento
de nanopartículas preparadas por etanol:acetona 4:6.
Tabela 1. Diametro e polidispersidade de nanopartículas de PLGA preparadas
pelo método modificado-SESD.
Tabela 2. Diâmetro médio e PVA residual nas
nanopartículas de PLGA após lavagem e
ultrafiltração
Figura 3. Efeito da concentração de PVA
no rendimento da nanopatícula preparada
por etanol:acetona 4:6. PLGA 8%.
Preparação de nanopartículas
Salting-out. Tipicamente, 50 g de solução aquosa de cloreto de
magnésio hexahidratado (30,4%, p/p) e PVAL (5- 21%, p/p) são
agregados sob agitação mecânica a 30 g de fase orgânica contendo
9,0% (p/p) de E L100-55 (polímero eudragit) em acetona. A agitação
foi mantida a 2000 rpm por 15 min. Após emulsificação, 50 g de água
pura foram adicionados para induzir a difusão do solvente orgânico
na água e a formação das nanopartículas.
Emulsificação-Difusão. Para este método, 30 g de uma solução aquosa
de PVAL (7–21%, p/p) foi adicionado sob agitação a 21 g de uma
solução orgânica de polímero em álcool benzílico (14.3%, p/p). A
emulsificação resultante o/w foi agitada continuamente a 2000 rpm
por 15 min, e logo, 660 g de água foram introduzidos para permitir a
difusão do solvente orgânico para a água. levando a formação das
nanopartículas.
Nanoprecipitação. A fase orgânica foi preparada por dissolver E L10055 (360–810 mg) em 25 ml de solvente orgânico (acetona, dimetil
sulfoxido, álcool isopropílico, etanol, ou lactato de etila). A solução
orgânica foi adicionada na fase aquosa (50 ml) contendo PVAL
(0.4%, p/p) e agitada magneticamente.
Tabela 1. Influencia da
concentração de PVA na
fase aquosa no tamanho
da nanoparticula
preparada por saltingout e emulsificaçãodifussão
Para copolímero como PVA na interfase da gotícula, além da
redução da tensão interfacial outro citério de estabilização
inclui: (1) coberta total da gota, (2) uma forte fixação na
interfase, (3) formação de um filme grosso e (4) uma
conformação ótima das cadeias do polímero na fase externa.
Estes fenômenos tem sido pesquisados para o PVA na interfase
solvente orgânico/água. De fato, dois importantes conclusões
foram concluídos destes estudos: (i) interpenetração é o
mecanismo proposto para explicar a ligação do PVA na
interfase da gotícula da emulsão, e(ii) a forte interação do PVA
na interfase leva a uma adsorção irreversível do PVA na
superfície da nanopartícula. Dados dp PVA residual na
nanopartícula, que estão presente, demonstram a presença de
PVA não- removivel na nanopartícula. Isto sugere que PVA-E
L100-55 interpenetração deveria ocorrer na interfase da
gotícula durante a emulsificação (Figura 2). Logo, é assumido
que o pacote de cadeias compactada resultam desde uma
interpenetração levando a formação de filmes rígidos na
interfase da gotícula que resiste cortes e confere estabilidade
mecânica para as gotículas da emulsão durante a emulsificação.
Tabela II mostra os valores solvente-água que aumentam na seguinte ordem: etanol <
dimetil sulfoxido < álcool isopropilico < etillactato < acetona. Comparando a mesma
concentração de polímero (p.ex. 14.4 mg/ml), o tamanho médio da NP preparado usando
estes solventes aumenta quase na mesma ordem: etanol < dimetil sulfoxido <álcool
isopropil < acetona < etillactato. Etanol, mostrando o valor menor (27.0 MPa1/2), produz a
menor NP. Inversamente, acetona, com o valor mais alto (34.4 MPa1/2), deu a NP com o
tamanho médio maior. Em geral, esta primeira aproximação sugere que a afininidade
solvente-água, correspondendo ao menor valor solvente-água, poderia melhorar a difusão
do solvente na fase aquosa externa e logo permitir obter a menor NP.
CONCLUSIONS
Os tamanhos por salting-out (123–710 nm) e emulsificação-difusão
(108–715 nm) foram maiores que os de nanoprecipitação (147–245
nm). Para os método o tamanho das naniopartículas foram associados
as propriedades físico-químicas do solvente e da fase aquosa usadas
para suas preparações. Tanto para salting-out como para
emulsificação-difusão a nanoemulsão formada foi analisada por MEV
e o papel do PVA como emulsificante durante o processo de
emulsificação foi amplamente descrito (teoria de emulsificação).
Vários mecanismos de estabilização fora, envolvidos: (i) na interfase
da gotícula na cadeia polimérica pode não somente reduzir a tensão
superficial mas também induzir uma estabilização mecânica como
estérica, e (ii) na centro da solução as cadeias de PVA podem
aumentar a viscosidade da fase externa induzindo uma estabilização
hidrodinâmica. As características do solvente como solubilidade e
parâmetros de interação foram considerados para relacionar as
propriedades do solvente na formação das nanopartículas (fenômeno
de difusão dirigida)(diffusion-stranding phenomenon). Em geral,
estas foram encontrada proporcionais a o tamanho das nanopartículas.
de outra maneira, usando E L100-55 como polímero, solventes com
um (interação de solvente-água) ≈ 11 (ou Δ (solubilidade
solvente-água) ≈ 27 MPa1/2) permitem nanopartículas com um faixa
larga para obter tamanhos médios.
Isto demonstra que interação de água com solvente e
assim movimento de difusão do solvente, joga um papel
importante na explicação da variação do tamanho das
nanopartículas pelo método de nanoprecipitação.
Finalmente, estes experimentos mostram não somente o
papel de cada componente básico (solventes, polímeros, e
sais) nas propriedades físico-químicas das fases aquosa e
orgânica (viscosidade, tensão superficial e solubilidade),
mas também o efeito de tais propriedades na formação
das nanopartículas. Isto é importante já que este
conhecimento é importante no controle racional de
parâmetros ou variáveis que influenciam a formação das
nanopartículas permitindo o desenho de nanopartículas
com determinados tamanho, características especificas
para alvos dirigidos para atingir células ou órgãos.
APLICAÇÕES
E ALVOS DIRIGIDOS
MOLECULAR PHARMACEUTICS. 2, 373-383 (2005)
A função mais importante da transferina (Tf), uma
glicoproteína encontrada abundantemente na sangue, é
transportar ferro através da sangue a células através de
receptores (TfR). Como os receptores TfR são sobreexpressados em tecidos malignos comparados com os normais,
Tf é também pesquisado intensamente como ligante para
fármacos com alvos dirigido.
Formulação de NPs:
NPs contendo Tx foi preparada pelo método de emulsãoevaporação. Em breve: PLGA e Tx em cloroformio e logo
emulsificado em 5% de PVA. A emulsificação foi feita na
presença de um sonicador. Após agitação por 12 h e
evaporação do solvente as NPs foram lavadas com água
para eliminar o PVA e logo liofilizadas.
Figure 3. Internação celular de nanopartículas com Tf-conjugado e não-conjugado
em células MCF-7. Uma suspenssão de NPs (100 ug/mL) foi incubado com MCF-7 (5
x 104 células) por 1 h, as células foram lavadas e o nível de NPs na célula foi
determinado por HPLC. Para determinar a competitividade na inibição de
internalização das NPs-Tf conjugadas, um excesso de Tf livre (50 ug) foi adicionado
ao médio antes de incubar as células com NPs de Tf-conjugado.
Atividade anti-proliferativa do Tx ( ▄ ), Tx-NPs(●) e Tx-Tf-NPs (▲)
RETENÇÃO INTRACELULAR
POR
FLUORESCENCIA CONFOCAL
MICROSCOPIA DE LASER
CONFOCAL
PCL/ microesferas de violaceina– Confocal Laser
Scanning Microscopy (CLSM)
Violaceina dispersa
em matriz polimérica
Barra = 10 mm
Microscopia Confocal: gel e nanopartículas
Matriz do gel
Nanoparticulas +
violaceina
Gel +
nanoparticulas
(multitracking)
Retenção intracelular do Taxol (Tx) por flurescência confocal
fluoroforo: 6-cumarina
Conclusões
Foi demonstrado que a conjugação a Tf nas
nanopartículas resulta em maior internação do fármaco na
célula, sustentando uma retenção intracelular do fármaco
e assim melhorar o efeito anti-proliferativo do agente
antineoplásico encapsulado nas células cancerosas. Os
dados com Tf-conjugado a NPs numa cultura celular
resistente ao fármaco sugere que a resistência pode ser
sobre passado por retenção intracelular do fármaco. É
possível que a liberação do fármaco das NPs poderia
influenciar ainda mais o efeito anti-proliferativo da
formulação e isto poderia ser otimizado. Seria de interesse
determinar como outros ligantes, tais como ácido fólico ou
fator de crescimento epidermal, para os quais os
receptores são sobre expressados na maioria das células
cancerosas, seguindo sua conjugação a NPs influenciariam
a retenção celular do fármaco e sua eficácia terapêutica.
AGRADECIMENTOS
REDE NANOTUB0S
DE CARBONO
CNPq/MCT
CNPq/MCT