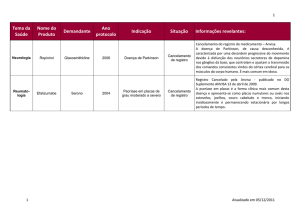
Registro na ANVISA
Protocolos e Diretrizes Terapêuticas do
SUS
Senado Federal
Brasília, 07/maio/2009
Jorge T. Samaha, MD, MBA.
Agência Nacional
de Vigilância Sanitária
Gerente de Avaliação de Segurança e
Eficácia de Medicamentos / ANVISA
www.anvisa.gov.br
Registro de Medicamentos/ANVISA
Base Legal
Lei nº. 6.360/1976
Estabelece os critérios técnicos para o registro de
medicamentos
• Segurança
• Eficácia
• Qualidade farmacotécnica
www.anvisa.gov.br
Inovação no Setor Saúde
✓ Incrível velocidade da inovação em
saúde
✓ OMS: estima que cerca de 50% de
todos os avanços terapêuticos
disponíveis hoje em dia não existiam
há dez anos
✓ Necessidade de avaliação técnica
tanto para o registro, como para a
incorporação de medicamentos aos
protocolos e diretrizes terapêuticas
do SUS
www.anvisa.gov.br
Tipos de Estudos e
Fases de Desenvolvimento
Fonte: ICH, E9,
1996.
www.anvisa.gov.br
Acompanhamento e Diretrizes
Regulatórias
Developer’s activities
Research phase of product
development
ANVISA
Non-clinical Testing
Phase I and II
Clinical trials
Pre-submission
meeting
Phase III Clinical
Trials
PHASE I AND II RESULTS
REVIEW. PHASE III CLINICAL
TRIALS DESIGN DISCUSSION
Clinical trials meeting
www.anvisa.gov.br
Registro de Medicamentos na
ANVISA
Avaliação Farmacotécnica
• Caracterização físico-química do princípio
ativo e das propriedades farmacêuticas
• Boas Práticas de Fabrico Correntes
(cBPF)
• Rota de síntese
• Testes de avaliações farmacotécnicas
• Estudos de estabilidade
• Testes de Controle de Qualidade
www.anvisa.gov.br
Registro de Medicamentos na ANVISA
Avaliação de Segurança e Eficácia(1)
•Estudos Pré-Clínicos
✓Atividade farmacológica em modelos animais da patologia
✓Farmacocinética, farmacodinâmica e metabolismo do fármaco
✓Toxicologia: toxicidade de dose única e múltiplas
✓Genotoxidade
✓Farmacologia da segurança (cardiovascular, respiratório, sistema
nervoso central)
✓Toxicidade reprodutiva
✓Imunotoxicidade
✓Tolerância local
•Tendência atual: substituição de estudos em animais por testes in
vivo devidamente validados, p.ex., toxicidade em cultura de células,
mas a completa avaliação técnica ainda não pode prescindir
totalemente dos testes em animais
www.anvisa.gov.br
Registro de Medicamentos na ANVISA
Avaliação de Segurança e Eficácia(2)
✓ Pesquisa clínica como primeiro passo para o registro
de novos medicamentos
✓ Qualidade dos dados (Boas Práticas Clínicas)
✓ Segurança e bem-estar do sujeito de pesquisa
✓ Saúde Pública construida com bases em sólidas
evidências científicas
✓ Ensaios Clínicos: Ferramenta regulátoria com
limitações, mas a melhor até o presente para a
avaliação da eficácia e registro de novos medicamentos
www.anvisa.gov.br
Características - Avaliação Crítica dos
Estudos Clínicos
Eficácia
Desfecho
Clínico
Avaliação Crítica da Pesquisa Clínica
Desenho Estudo: Coorte,
Ensaio Clínico,
Transversal, Ecológico,
Caso-Controle, Revisão
Sistemática
Enfoque:
Diagnóstico
Prognóstico
Terapêutico
Dano/Etiologia
Pesquisa Básica ou de apoio à pesquisa clínica
Pesquisas de Fase I e II
Estudos de Eficiência/Custos
Marcadores Biológicos Intermediários
Estudos Farmacológicos, Fisiológicos e Genéticos
www.anvisa.gov.br
Registro de Medicamentos na ANVISA
Avaliação de Segurança e Eficácia(3)
Relatório de Experimentação Terapêutica (Resultados
dos Ensaios Clínicos)
✓ Justificativas técnicas (clínicas e fisio patológicas entre outras)
para a requisição
✓ Doença Órfã/Negligenciadas
✓ Importância em Saúde Pública
✓ Ausência de alternativas terapêuticas eficázez e seguras
✓ Comodidade posológica/maior adesão ao tratamento
✓ Apresentação dos riscos potenciais e da relação riscobenefício
✓ Metodologia/Protocolo de estudo aceitável
www.anvisa.gov.br
Registro de Medicamentos
ANVISA - Comparação Internacional
Fonte: Center for Medicines Research,
2004.
www.anvisa.gov.br
Registro de Medicamentos na ANVISA
Avaliação de Segurança e Eficácia(4)
Avaliação: Resultados dos Ensaios Clínicos
✓End-points de eficácia, se não-clínico, justificar
✓Parâmetros de segurança utilizados
✓Comportamento favorável dos parâmetros de segurança entre o
produto em teste e o comparador
✓Aspectos estatísticos
✓Adequação do teste utilizado
✓Adequação do nível de significância/poder do teste
✓Controle de qualidade dos dados/monitoramento do estudo
✓Achados de eficácia, incluíndo sigificância estatística
✓Achados de segurança, incluíndo sigificância estatística
✓Avaliação da Relação risco-benefício
www.anvisa.gov.br
Números de Registros de Medicamentos Novo
Série Histórica
Fonte: Datavisa, até 31/03/09*
www.anvisa.gov.br
Razão para diminuição recente do número de
Registros de Medicamentos Novos - FDA
Case
1995
2008
Compostos em
Desenvolvimentos
8.772
5.492
Pre-clinico
1/100
Registros :
72
Desenv.
Clínico
1/300
18
Source: World-wide data, IMS HEALTH, 2003-2008, Strategic Management Review
www.anvisa.gov.br
Razão para Diminuição Recente do Número de
Registros Maior atividade Regulatória
Fonte: Center for Medicines Research,
2005
www.anvisa.gov.br
Registro Medicamentos
Tempo para Aprovação - Comp. Intl.
Fonte: Center for Medicines
Research
www.anvisa.gov.br
Tempo de Aprovação de Registro
“Benchmark” Agencies
Hirako et. al. Drug Development, 2007.
www.anvisa.gov.br
Incorporação de Medicamentos no
SUS
Regulação Sanitária - Anvisa
Regulação Econômica CMED
Avaliação de Tecnologia em
Saúde
Incorporação de Tecnologia
MS (CITEC)
Considera, além dos critérios
de eficácia e segurança
(registro):
‣Necessidades de saúde
‣Grau de Desenvolvimento e
Estrutura dos serviços de
saúde local
‣Custos
www.anvisa.gov.br
Diferença Técnica entre Registro na ANVISA e
Incorporação aos Protocolos e Diretrizes
Terapêuticas do SUS (1)
• Registro na ANVISA: avalia a eficácia e a segurança dos
medicamentos
• Eficácia: procura avaliar se o medicamento funciona e sob quais
condições (critérios de seleção ) dos pacientes (sujeitos de pesquisas)
nos estudos clínicos
• Refere-se à capacidade de um medicamento, na dose recomendada,
em produzir efeitos benéficos em circunstâncias ideais, como nos
ensaios clínicos randomizados. A eficácia é então medida pela avaliação
dos resultados clínicos e estatísticos do ensaio clínico
• Os critérios de seleção (inclusão e exclusão) são necessários para se
garantir a validade interna dos ensaios clínicos
Marley, J. Efficacy, effectiveness, efficiency. Aust. Prescr. 23:114-115, 2000.
www.anvisa.gov.br
Diferença Técnica entre Registro na
ANVISA e Incorporação aos Protocolos e
Diretrizes Terapêuticas do SUS (2)
• Incorporação de medicamentos à protocolos e diretrizes
terapêuticas do SUS: avalia e efetividade/eficiência
• Efetividade: relacionada com as condições reais de uso dos
medicamentos na prática clínica, p.ex., menor observância dos
critérios de seleção que em uma condição de estudo clínico
• Eficiência: avaliações das condições reias de uso dos
medicamentos na pratica clínica e os aspectos econômicos
Marley, J. Efficacy, effectiveness, efficiency. Aust. Prescr. 23:114-115, 2000.
www.anvisa.gov.br
Diferença Técnica entre Registro na ANVISA e
Incorporação aos Protocolos e Diretrizes
Terapêuticas do SUS (3)
Efetividade: utilizado para medir o efeito de um medicamento na terapêutica, ou
seja em condições "reais" da população como um todo, ao contrário do que é
avaliado durante os ensaios clínicos controlados, quando os pacientes envolvidos
foram rigorosamente selecionados. Desta forma, a baixa adesão do paciente a um
tratamento (em função de efeitos adversos ou complicações do esquema
terapêutico), pode influenciar sua efetividade, assim como a presença de comorbidades ausentes nos pacientes incluídos nos ensaios clínicos controlados. A
efetividade pode ser avaliada em estudos observacionais, na prática usual da
medicina
Eficiência: utilizado quando se avalia a relação custo-efetividade de um
tratamento para o paciente ou a sociedade.
Marley, J. Efficacy, effectiveness, efficiency. Aust. Prescr. 23:114-115, 2000.
www.anvisa.gov.br
Mercado Farmacêutico
Global & Local
www.anvisa.gov.br
Uso Estimado de Medicamentos nos
Países Emergentes
Fonte: Decision Resources, Inc., 2003.
www.anvisa.gov.br
Registro de Medicamentos
ANVISA
QUALIDADE
SEGURANÇA
EFICACIA
USO RACIONAL
www.anvisa.gov.br
Boas Práticas Regulatórias
• Transparência e boa “governance”
•
•
•
•
•
•
•
•
– Eficiência e efetividade administrativa
Recursos sustentáveis
Estrutura
Cooperação intra e extra-agência
Capacidade cientifica
Independência
Resposta em tempo razoável
Compartilhamento de informação
Confidencialidade dos dados
www.anvisa.gov.br
Obrigado
pela atenção!!!
[email protected]
www.anvisa.gov.br