II- Gênese, Evolução, Química e
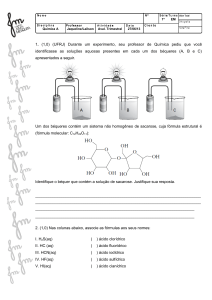
Mineralogia dos Solos
1- Formação dos solos e evolução
2- Noções de mineralogia dos solos
3- Noções de química dos solos
Principais colóides dos Solos
• Substâncias que formam as suspensões: de
tamanho entre as partículas de dimensão
molecular, e que formam as soluções verdadeiras,
e as partículas suficientemente grandes para
sedimentarem sobre o efeito da gravidade.
• O domínio coloidal tem as dimensões: de 0,001 a
1,0 µm (1 a 1000nm): engloba os minerais de
argila, as substâncias húmicas, os óxidos e
hidróxidos e mais raramente os quartzos.
Propriedades Coloidais
• Propriedades derivadas da presença de cargas elétricas.
Estas condicionam um estado de dispersão ou de
floculação.
• Dispersão: situação na qual as cargas se repelem.
• Floculação: situação na qual as cargas são neutralizadas.
• Segundo a carga classificam-se :
a. Eletropositivos ou basóides
b. Eletronegativos ou acidóides
• Segundo a afinidade com a água são:
a. Hidrófobos ou suspensóides
b. Hidrófilos ou liófilos (emulsóides)
• São conhecidos como o complexo adsorção
Propriedades Coloidais
• Os colóides são, na verdade, anfóteros,
mudam o sinal da carga de acordo com um
dado pH, que é chamado de ponto
isoelétrico.
Ex: Caolinita: pH 7 é eletronegativa (anodo), a
pH 4, muda de sinal (dirigi-se ao catodo)
• Dispersão versus floculação
Propriedades Coloidais
• Floculação dos colóides eletronegativos pelos cátions (K+, Na+,
Ca++, Mg++):
• Cátions hidratados como K+, Na+ permitem a dispersão.
Quando em excesso na suspensão podem levar à floculação.
• Cátions pouco hidratáveis e grandes como Ca++,
Mg++permitem maior floculação Na+
Colóide eletronegativo:
Estado floculado
H2O
Mg++
H2O
Ca++
Mg++
Mg++
H2O
Ca++
Mg++
Ca++
Mg++
H2O
K+ K+
K+
Ca++
Mg++
Mg++
H2O
Ca++
Mg++
H2O
Ca++
Na+
Na+
H2O
Estado disperso
H2O
Na+
Complexo de adsorção
• É o conjunto de superfícies que podem adsorver
íons e moléculas. O resultado disso são
propriedades ligadas a troca de cátions.
Fenômeno de troca Catiônica da Fração Mineral
Poder de adsorção: a adsorção ocorre entre o
complexo sortivo e a solução do solo. É um
fenômeno físico-químico de interface.
H+
+++
ArgilaAl
Ca++
Ca++
H+
Argila
H+
Al+++
+
H2O
Leis da troca de cation
• Adsorção segundo os cátions:
H+; Ca++; Mg++; K+; Na+
• Diluição da solução do solo favorece a fixação
de cátions bivalente
• Papel do pH , na troca
Argila-H+ + KCl Argila-K + HCl acarreta acidez
de troca. Em pH baixo tem pouca fixação de
cátion.
Argila-Ca++ + 2KCl Argila-K + CaCl acarreta
aumento de pH. Em pH alto tem alta fixação de
cátion.
Estado do complexo de troca
• Capacidade de Troca (CTC ou T): quantidade máxima de
cátions adsorvíveis e trocáveis que o complexo pode reter.
• É função:
Quantidade e tipos de argila
Quantidade e tipos de matéria orgânica.
• Soma de bases (S): Soma dos cátions básicos efetivamente
fixados sobre o complexo sortivo em dado momento.
• Grau de saturação(V): É a taxa de saturação do complexo. É
dada por S/T x 100.
• Interpretações:
Se T é fraca: o horizonte retém poucos cátions.
Se V é fraca: o horizonte tem poucas reservas mas pode ser enriquecido até a saturação de T.
Argilas migram mais sob um V fraco.