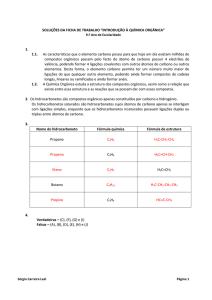
Introdução a Química
Orgânica
e-mail: [email protected]
Gratiane Velleda Brito
O que é Química ?
Ciência que estuda a matéria, substância
( constitui a matéria) e suas transformações.
Um exemplo prático é um tênis pois o mesmo é
constituído de Borracha,tecido e metal.
Qual é a diferença entre a
Química Inorgânica da Orgânica?
Química Inorgânica: estuda os compostos
extraídos dos minerais.
Química Orgânica: Estuda compostos
extraídos dos elementos vivos, ou seja, da
natureza.
Química Orgânica:
Parte da química que estuda
praticamente todos os
compostos
do elemento carbono.
Representações
Carbônicas
Ocorre para que haja o compartilhamento
de elétrons entre os átomos da molécula,
havendo então a estabilização da mesma.
Essas representações podem ocorrer pela:
Fórmula Molecular (F.M.)
Mostra apenas a quantidade existente de
cada átomo na molécula.
Exemplo:
CH4
C2H6O
Fórmula Eletrônica
Aparece o número de elétrons de valência de
cada átomo da molécula.
Exemplo:
OBs.: Cada par de
elétron compartilhado
da origem a uma
ligação.
Fórmula Estrutural
Mostra as ligações formadas pelos pares
de elétrons.Podem ser elas planas ou
condensadas:
Exemplos:
Condensada: só não aparece as
ligações dos átomos de
Hidrogênio,as demais aparecem.
Plana: aparece todas as
ligações da molécula.
Fórmula de Linhas ou Bastão.
Aparece somente as ligações entre os átomos
de carbono.
Exemplo:
H
H
H
C
C
C
H
H
C
H
H
H
H
C
C
C
C
C
H
H
C
H
H
C HH
H
C
C
H
H
H
C
C
H
H
H
HC H
OH
C
H
C H
H
O
H
C H
C
H C
H
H
H
C H
H
Tipos de Ligações
Sigma (σ) e Pi (π)
Ligações Sigma (σ)
São ligações extremamente fortes.São as
primeiras a ocorrer.
Só ocorre uma vez em cada dois átomos.
São conhecidas como ligações simples.
Ligações Pi (π)
São ligações fracas. Facilmente são
rompidas .
Elas são conhecidas como duplas ou
triplas ligações.
Exemplo:
σ
π
σ
σ
σ
10 ligações sigma
4 ligações pi
σ
σ
π
π
σ
σ
π
σ
σ
Postulados de Kekulé
Entre 1858 e 1861 lançou três postulados
fundamentais da Química Orgânica.
1° Postulado: O carbono é tetravalente
2° Postulado: as ligações simples do
carbono são todas iguais.
3° Postulado: o carbono é capaz de formar
cadeias longas com outros átomos de
carbono.
TEORIA DA LIGAÇÃO COVALENTE
De acordo com a teoria da ligação covalente, as ligações
químicas só são efetuadas por orbitais atômicos semi
preenchidos .
Vamos analisar o Carbono, em seu estado fundamental:
2
2
2
6C : 1s 2s 2p
NA CAMADA DE VALÊNCIA
HÁ DOIS ORBITAIS
SEMIPREENCHIDOS: ASSIM ,O
CARBONO SERIA BIVALENTE
TETRAVALÊNCIA DO CARBONO
C ATIVADO
Ligações
C
C
Hibridização
Geometria
Ângulo
sp3
Tetraédrica
109°28’
Trigonal
Plana
120°
Linear
180°
sp2
C
C
sp
Classificação dos
Átomos de Carbono
Carbono Primário: se liga somente a um ou a nenhum
átomo de carbono
Carbono Secundário: se liga a dois outros átomos de
carbono.
Carbono Terciário: se liga a três outros átomos de
carbono.
Carbono Quaternário: se liga a mais quatro átomos de
carbono.
1°
1°
3°
2°
1°
3°
1°
2°
4°
2°
1°
3°
3°
1°
1°
1°
Classificação das
Cadeias Carbônicas
Cadeia aberta, Acíclica ou alifática
Possui duas ou mais extremidades com
carbonos primários.
Exemplos:
CH3-CH2-CH2-CH3
Cadeia Fechada, Cíclica ou alicíclica
Não possui extremidades distintas.
Exemplos:
Cadeia Aromática
Cadeia fechada com 6 átomos de carbono
onde ocorre ligações duplas e simples se
alternando. Esse fenômeno é chamado de
ressonância.
Exemplos:
=
=
Cadeia Mista
Possui uma parte aberta e outra fechada (não
aromática).
Exemplos:
CH2-CH3
Cadeia Normal
Possui na sua estrutura somente carbonos
primários e secundários
Exemplos:
Cadeia Ramificada
Possui na sua estrutura carbonos terciários
e/ou quaternários.
Exemplos:
Cadeia Saturada
Possui somente ligações simples, entre os
átomos de carbono.
Exemplos:
O
OH
Cadeia Insaturada
Possui ligações do tipo pi (duplas e/ou triplas)
entre átomos de carbono.
Exemplos:
Cadeia Homogênea
Não Possui Heteroátomo entre os átomos de
carbono.
Exemplos:
O
Heteroátomo: átomo diferente de carbono e
hidrogênio.
Cadeia Heterogênea
Possui heteroátomo entre átomos de carbono.
Exemplos:
O
S