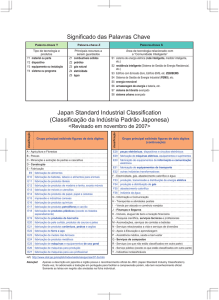
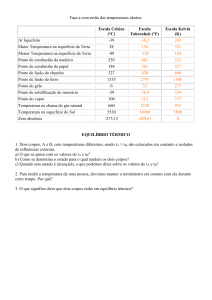
Química dos Biocombustíveis
CET: ESTTEB-TMR3
Poder calorífico dos Combustíveis
Valentim M B Nunes
Unidade Departamental de Engenharias
Instituto Politécnico de Tomar, Abril, 2012
Combustão
A combustão é uma reação química com o oxigénio (comburente), com a conversão
de energia química em energia térmica, onde o combustível é, geralmente, o
carbono ou um composto de carbono, tais como hidrocarbonetos e compostos
orgânicos oxigenados. As reações de combustão completa destes são as seguintes:
Carvão: C + O2 → CO2
Hidrocarbonetos: CxHy + (2x+y/2) O2 → x CO2 + y/2 H2O
Compostos Oxigenados - Monoálcoois: CxHyOz + (3x/2) O2 → x CO2 + y/2 H2O
Exercício 1
Escrever a equação química para a reacção de combustão completa do octano.
Exercício 2
Escrever a equação química para a reacção de combustão completa do etanol
Exercício 3
Escrever a equação química para a reacção de combustão completa do biodiesel
(RCOOCH3).
Poder calorífico
Podemos considerar duas formas de definir o poder calorífico: Poder Calorífico Superior
(P.C.S) e Poder Calorífico Inferior (P.C.I).
Poder Calorífico Superior (P.C.S): O P.C.S é dado pela soma da energia libertada na forma
de calor e a energia gasta na vaporização da água que se forma numa reacção de
combustão.
Poder Calorífico Inferior (P.C.I): O P.C.I é apenas a energia libertada na forma de calor.
Para combustíveis que não contenham hidrogénio na sua composição, o valor de P.C.S é
igual ao do P.C.I, porque não há a formação de água e não se gasta energia na sua
vaporização.
O valor de aquecimento ou poder calorífico de uma substância, geralmente um
combustível ou alimentos, é a quantidade de calor libertado durante a combustão de
um determinado montante do mesmo. O valor calórico é uma característica para cada
substância. É medido em unidades de energia por unidade de substância, geralmente
massa ou volume, tais como: kcal/kg, kJ/g, kJ/mol ou Btu/m³.
Poder calorífico de diferentes combustíveis
Combustível
Poder Calorífico
Superior (a 25ºC e 1 atm)
Poder Calorífico
Inferior (a 25ºC e 1 atm)
Hidrogénio
141,86 kJ/g
119,93 kJ/g
Metano
55,53 kJ/g
50,02 kJ/g
Propano
50,36 kJ/g
45,6 kJ/g
Gasolina
47,5 kJ/g
44,5 kJ/g
Gasóleo
44,8 kJ/g
42,5 kJ/g
Metanol
19,96 kJ/g
18,05 kJ/g
Biocombustíveis
O poder calorífico é também uma propriedade físico-química muito importante para os
biocombustíveis. O valor calorífico do diesel é 46 MJ/kg, do biodiesel é 33–40 MJ/kg e
de óleo vegetal (de colza) é 36.9 MJ/kg.
Exercício 4
Sabendo que o Hcomb (CH4) = - 890 kJ.mol-1, calcular o P.C.S e o P.C.I do metano.
Exercício 5
Sabendo que o Hcomb (etanol) = - 458 kcal.mol-1, calcular o P.C.S e o P.C.I do etanol.
Exercício 6
Qual o volume de etano (C2H6) medido a 23 °C e 752 mmHg que é necessário para
aquecer 8.55 kg de água de 25 °C a 98 °C?
Exercício 7
O gás natural é essencialmente constituído por metano. Qual o volume de gás
natural, fornecido a uma pressão de 20 mbar, necessário para aquecer um volume
de 3 m3 de água desde a temperatura ambiente de 25 °C até cerca de 37 °C?