EQUAÇÃO DE HENDERSON-HASSELBACH
pH = pKa + log [A-] / [HA]
“Muito utilizada para prever as propriedades de
soluções-tampão utilizadas para controlar o pH
de misturas de reações”.
Situações na qual [A-] = [HA], o pH é igual ao
pKa.
EQUAÇÃO DE HENDERSON-HASSELBACH
- Ao adicionarmos uma base a uma solução ácida,
o pH da solução é alterado;
- Quando determinada quantidade de base é
adicionada a uma determinada quantidade de
ácido, chamamos de titulação;
- Quando o ácido está exatamente neutralizado
temos o ponto de equivalência;
EQUAÇÃO DE HENDERSON-HASSELBACH
- Ponto de equivalência
- Quanto pH = pKa – mistura com concentrações
iguais do ácido fraco e sua base conjugada (ácido
acético e íon acetato);
EQUAÇÃO DE HENDERSON-HASSELBACH
- Perto do ponto de inflexão, o pH muda muito
pouco com a adição de mais base;
- O valor do pKa de cada ácido individual é que vai
determinar os valores de pH no ponto de inflexão
e no ponto de equivalência;
- Tem-se ácidos monopróticos (liberam apenas um
íon hidrogênio), dipróticos (liberam até dois íons
hidrogênio) e ácidos polipróticos (liberam mais de
dois íons de hidrogênio);
EQUAÇÃO DE HENDERSON-HASSELBACH
- Nos ácidos polipróticos tem-se a seguinte
relação:
pH > pKa – predomina a forma
desprotonada
pH < pKa – predomina a forma
protonada
EQUAÇÃO DE HENDERSON-HASSELBACH
Exercícios:
Calcule as quantias relativas de ácido acético e
íon acetato presentes nos pontos a seguir quando
1 mol de ácido acético é titulado com hidróxido de
sódio. Utilize também a equação de Henderson-
Hasselbach para calcular os valores de pH nesses
pontos.
a) 0,1 mol de NaOH é adicionado;
b) 0,3 mol de NaOH é adicionado;
c) 0,5 mol de NaOH é adicionado
d) 0,7 mol de NaOH é adicionado
e) 0,9 mol de NaOH é adicionado
EQUAÇÃO DE HENDERSON-HASSELBACH
Solução:
a) pH = pKa + log 0,1 / 0,9
pH = 3,81
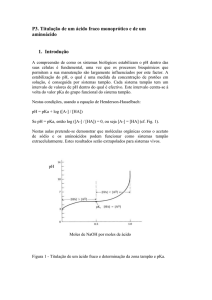
pH
6
5
4
3
pH
2
1
0
0
0.2
0.4
0.6
0.8
1
SOLUÇÕES TAMPÃO
- Consiste em uma mistura de ácido fraco e sua
base conjugada;
- Apresentam resistência as variações de pH
decorrentes da adição de pequenas quantias de
ácido forte ou base forte;
- Se
OH-
for
adicionado,
uma
quantidade
considerável da forma ácida no tampão reagirá
com a base adicionada;
- Se H+ for adicionado, também haverá uma
quantia considerável da base conjugada do
tampão que reagirá com o ácido adicionado.
SOLUÇÕES TAMPÃO
Exercício:
Fungos ectomicorrízicos quando cultivados em
meio líquido afetam drasticamente o valor de pH,
o qual chega a decair de 5,8 (ideal) para 2,5, o
que inviabiliza o cultivo. Sendo assim, calcule a
proporção adequada para se obter o pH 5,8
utilizando a equação de Henderson-Hasselbach
para o preparo de um tampão de ácido succínico.
Dado: pKa = 5,63
SOLUÇÕES TAMPÃO
- Para a obtenção de soluções tampão, na prática
fizemos pela adição de quantias predeterminadas
da base conjugada ao ácido conjugado ou
podemos iniciar com um e criar o outro;
- Inicia-se com ácido e adiciona-se NaOH até o pH
correto ou vice-versa.
SOLUÇÕES TAMPÃO
Sistemas
de
tamponamento
de
importância
fisiológica:
• pH fisiológico na maioria dos seres vivos
fica em torno de 7,0;
• O tampão fosfato (H2PO4-/HPO42-) é o
principal tampão nas células;
• No sangue os níveis de íon fosfato são
insuficientes para uma ação tamponante;
• Tamponamento sanguíneo baseia-se na
dissociação do ácido carbônico.