Leis Ponderais
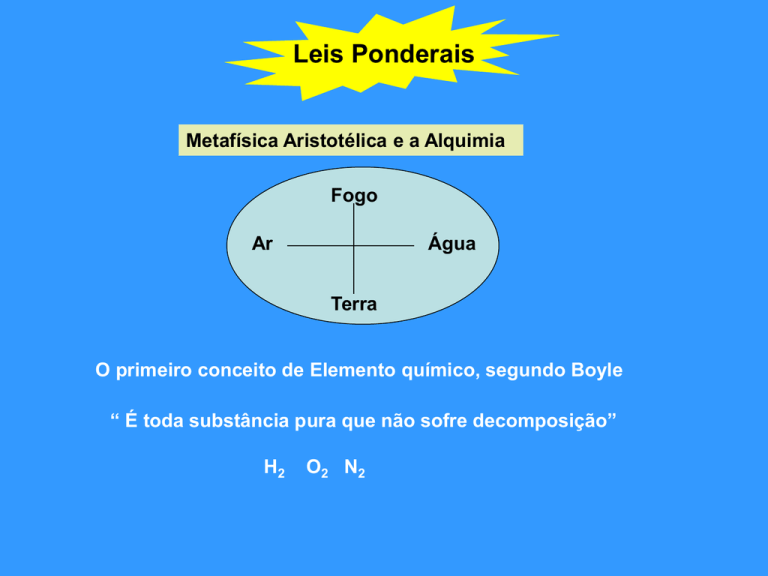
Metafísica Aristotélica e a Alquimia
Fogo
Ar
Água
Terra
O primeiro conceito de Elemento químico, segundo Boyle
“ É toda substância pura que não sofre decomposição”
H2
O2 N2
A Lei da conservação da massa, de Lavoisier
Alquimia
Química
“ A massa de um recipiente fechado,
após ocorrer dentro dele uma reação
química, é sempre igual à massa inicial.”
Água
18 g
Reagentes
Gás hidrogênio
+
2g
Gás Oxigênio
16 g
Produtos
Antoine Laurent
Lavoisier (1743
– 1794).
Leis da Proporções Constantes, De Proust
“ A composição química das substâncias compostas
é sempre constante, não importando a sua origem”
Decomposição de água:
Água
Gás hidrogênio + gás oxigênio
9g
1g
8g
18 g
2g
16 g
27 g
3g
24 g
100 g
11,11 g
88,89 g
Dividindo a massa de hidrogênio pela massa de oxigênio:
Massa de Hidrogênio =
1g
Massa de oxigênio
8g
= 2g = 3g
16 g
24 g
= 11,11 g = 0,125
88,89 g
Decomposição do gás carbônico:
gás carbônico
carbono
+
gás oxigênio
11 g
3g
8g
22 g
6g
16 g
44 g
12 g
32 g
27,27 g
72,73 g
100 g
Dividindo a massa de carbono pela massa de oxigênio:
Massa de Carbono = 3 g = 6 g = 12 g = 27,27 g = 0,375
Massa de Oxigênio = 8 g
16 g
32 g
72,73 g
Como explicar este comportamento da matéria??
Teoria atômica de Dalton
Toda matéria é composta de partículas fundamentais, os átomos;
Os átomos são permanentes, indivisíveis, não podem ser criados
nem destruídos
Os elementos são caracterizados por seus átomos. Todos os
átomos de um certo elemento são idênticos em
todos
os
aspectos. Átomos de diferentes elementos tem diferentes
propriedades
As transformações químicas consistem em uma combinação,
separação ou rearranjo de átomos
Compostos químicos são formados por átomos de dois ou mais
elementos em uma razão fixa.
Qual a importância desta teoria ???
Explicou com sucesso porque a massa é conservada nas
reações químicas
“ Se cada átomo tem sua própria característica e se os átomos
são rearranjados, permanecendo inalterados durante uma reação
química, então a massa total dos reagentes deve ser a mesma
que a dos átomos dos produtos”
Explicou a lei da proporções constantes
“ Se cada composto é caracterizado por proporções fixas entre os
números de átomos dos seus elementos componentes e se cada
átomo de um dado elemento tem, a mesma massa, então, a
composição de cada composto deve ser sempre a mesma”
Compreensão muito maior de como é a matéria
Símbolos representando elementos
Elemento
Símbolo
Alumínio
Al
Bromo
Br
Cálcio
Ca
Ferro
Fe
Fósforo
P
Nitrogênio
N
Ouro
Au
Sódio
Na
Zinco
Zn
Fórmulas representando substâncias
Todas as substâncias são formadas por átomos. As substâncias
simples são formadas por átomos do mesmo elemento e as
substâncias compostas , por átomos de dois ou mais elementos
diferentes.
CO2 - gás carbônico
C6H6O – Etanol
O3 - Ozônio
H, C, O, Ca, F. Mg,
Fe, Al, Au, Zn, Pb, K,
Na
NH3 - Amônia
CH4 – gás metano
Símbolo
Elemento químico
O2
Fórmula
Substância Pura
C2H6O
NH3
Equação Química
É a representação de uma reação química
Exemplo: Decomposição da água
Hidrogênio + Oxigênio
Água
H2O
+
2 H2
+
O2
Balanceamento de uma reação química
Uma equação química balanceada é aquela em que um certo elemento
químico é igual nos reagentes e produtos.
N2 + H2
NH3
C2H6O + O2
2CO2 + H2O
Natureza elétrica da matéria
Tubos de Crookes
Diminuindo a pressão podem ser observados uma série de eventos:
• com a saída do gás, o gás residual começa a emitir uma leve
incandescência.
• diminuindo a pressão ainda mais, o interior incandescente desaparece
gradualmente e o vidro da extremidade do tubo com o eletrodo de carga
positiva (o ânodo) começa a emitir uma incandescência
• se for adicionado ao interior do tubo uma amostra de sulfeto de zinco, o
lado da amostra voltado para o eletrodo carregado negativamente
(cátodo) emite uma incandescência e uma sombra pode ser vista no
ânodo
Conclusão
A baixas pressões algo deixa o cátodo e migra para o ânodo o raio catódico
O raio é composto de um fluxo de pequenas partículas,que
quando batem na superfície do sulfeto de zinco provoca a
emissão de um flash de luz.
A incandescência emitida pelo gás no interior do tubo a
pressões intermediárias resulta das colisões das partículas em
movimento com moléculas do gás .
Natureza elétrica dos raios catódicos
Os raios catódicos são
negativamente carregados
Thomson constatou que as partículas
carregadas tinham as mesmas
propriedades independentemente do
material utilizado como cátodo,
podendo concluir desta forma que
elas fazem parte de todos os átomos,
e as chamou de “ELÉTRONS”
Robert Millikan – 1908
- Desenvolvimento de um experimento que determinou a
magnitude da carga negativa no elétron
-Uma gotícula pôde captar apenas um número inteiro de elétrons e
como cada gotícula era carregada por múltiplos de -1,6 . 10-19, ele
concluiu que cada elétron carregava a carga de
- 1,6 . 10-19 C.
Experimento de Goldsteim
Tubo de raio canal de Goldstein
Ao fluxo incandescente foi dado o nome de Raio
canal e pela sua direção ficou provado que o raio
consiste de partículas carregadas positivamente
O átomo de Thomson
Uma esfera carregada positivamente na qual
os elétrons estão incrustados.
“ Pudim de passas”
Modelo atômico de Rutherford
O que causou os desvios e por que
algumas partículas foram espalhadas?
“Um átomo poderia ser composto de um
pequeníssimo núcleo carregado positivamente
rodeado por uma região muito maior contendo os
elétrons”
(1) Núcleo compreendendo toda a carga positiva;
(2) Região extranuclear, que é principalmente um
espaço vazio,onde estão distribuídos os elétrons.
Rutherford demonstrou em 1914 a existência de uma
partícula que tem uma massa muito maior do que o
elétron com carga em igual grandeza de sinal oposto.
PRÓTONS
Em 1932, J. Chadwick descobriu uma partícula que
tinha aproximadamente a mesma massa de um
próton,mas,não possuía carga
Nêutron
Assim (exceto no hidrogênio) o núcleo encerra prótons
e nêutrons
Os núcleons
Todos os átomos são constituídos
por um ou mais próton (carga
positiva) e geralmente por igual
número de nêutrons (sem carga)
agrupados
num
núcleo
extremamente pequeno. Os elétrons
(carga negativa) estão dispostos no
espaço como uma “nuvem” em torno
do núcleo. Num átomo eletricamente
neutro, o número total de elétrons é
igual ao de prótons.
Resumindo, em termos de carga temos:
Partícula
Carga
Elétron
-1
Próton
+1
Nêutron
0
Número atômico = Z ( número de prótons no núcleo)
Número de massa = A (prótons + nêutrons)
A = Z + N
A partir dessas definições tem-se que:
N = A - Z
Conceito moderno de elemento químico
Elemento químico é um conjunto de átomos que
possuem o mesmo número de prótons, isto é, o mesmo
número atômico (Z)
Isótopos
São dois ou mais átomos que possuem mesmo número
atômico (Z) e diferentes números de massa (A)
Isótopos do hidrogênio:
1
1H
HIDROGÊNIO
2
1H
DEUTÉRIO
3
1H
TRÍTIO










