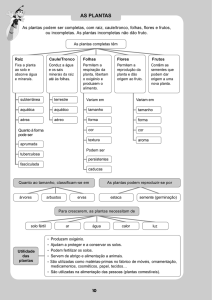
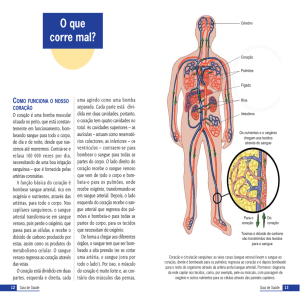
Engenharia Biomédica – 3º ano, 1º semestre
Mecanismos Gerais da Doença (2006/2007)
Aula 4 – 11 de Outubro de 2006
Tema: Patologia Celular
Professor Afonso Fernandes
Aula desgravada por Jorge Beira e Marisa Oliveira
A medicina durantes muitos séculos não passou de uma arte. Só se tornou ciência
quando foi definida a sua unidade, o que foi feito por um alemão, Rodolph Virchow, em
pleno século XIX com a publicação de um tratado sobre patologia celular em 1858.
Neste tratado podemos encontrar como conclusão fundamental o que está traduzido no
slide (“Todas as doenças se resumem a perturbações geradas ou sofridas por
grandes grupos de unidades vivas, cuja capacidade funcional depende do estado da
sua composição molecular e portanto das alterações químicas e físicas dos seus
constituintes”).
Como sabem, a teoria atómica e molecular de Dalton e Avogrado já tinham sido
anunciadas no início do século XIX, 1804 e 1811 respectivamente e portanto Virchow
já se pode socorrer desses conceitos, que foram de alguma forma inaugurais nas ciências
da Química e da Física para fazer esta extrapolação e levantar esta hipótese. De facto,
nesta altura, isto não passava de uma hipótese porque Virchow, em meados do século
XIX, ainda estava muito longe de poder afirmar baseado no método experimental que
todas as doenças eram resultantes deste tipo de alterações.
Com isto nasce a patologia celular. No entanto a patologia molecular, que é a
explicação directa das doenças pela alterações das moléculas, só vem a nascer muito
tempo depois em 1949, com Pauling. Pauling deu um contributo muito importante para
a Química e foi prémio Nobel da Química e mais tarde prémio Nobel da Paz.
Nós podemos estudar as doenças a vários níveis e hoje vamos preocupar-nos com
a doença da célula que, pelos vistos, pode explicar a doença do organismo como um
todo.
O primeiro aspecto que vamos focar é o que é que pode causar lesão celular.Com
certeza que não se admiram que as causas da lesão celular se sobreponham às causas de
doenças que falámos na primeira aula.
As causas da lesão celular podem ser:
- Agentes físicos;
- Agentes químicos;
- Agentes biológicos;
- Alterações das células;
- Desiquilíbrios nutricionais;
- Alterações genéticas;
- Envelhecimento;
- Reacções Imunológicas;
- Radicais Livres;
- Isquémia e Hipóxia.
1
A isquémia e a hipóxia são das principais causas de lesão celular do mundo
ocidental em que vivemos. A mortalidade ocidental ocorre predominantemente devido
às doenças cardiovasculares entre as quais se inclui a doença coronária.
Por outro lado, mesmo outros agentes, quando actuam sobre os tecidos acabam
directa ou indirectamente, com frequência, por determinar lesões de isquémia e hipóxia
porque o mecanismo pode não ser directo mas muitos destes agentes podem lesar as
paredes dos vasos, podem lesar os endotélios comprometendo o fluxo circulatório
causando isquémia e hipóxia.
Importará ter uma ideia deste conjunto face a um estímulo que actua sobre uma
célula com uma determinada susceptibilidade, é possível uma resposta funcional, a
célula passa a funcionar de uma forma diferente, adaptada perante a esta situação de um
estímulo ter actuado sobre ela própria - falamos então numa adaptação funcional – ou
pode acontecer a lesão mas essa lesão ser reversível e portanto possibilitar à celula uma
adaptação. Mas a célula pode sofrer perturbações de tal maneira que a lesão celular seja
irreversível. Isso conduz à morte da célula.(Ver slide 4)
A célula pode morrer por vários processos:
- Necrose;
- Apoptose.
Quais são os alvos, na célula, dos estímulos (dos agentes, das causas) da patologia
celular?
1 - membrana (que contribui até para a própria definição de célula);
2 - formação de ATP (produção de energia);
3 - síntese proteica;
4 - genoma.
Quais são os mecanismos envolvidos na lesão?
I - privação de oxigénio (mecanismo básico fundamental, não é entregue oxigénio
às células);
II - produção de espécies reactivas de oxigénio (algumas são radicais livres* - que
são representados por R. – nem todas as ERO*2 são radicalares (têm o tal electrão
desemparelhado));
III - mecanismo relacionado com a mitocôndria e formação de energia;
IV - concentração intracelular de cálcio;
V - mecanismos relacionados com a disrupção ou disfunção da membrana, com a
perda de função das ATPases, a alteração dos lípidos, dos ácidos gordos polinsaturados
que são susceptíveis de sofrerem peroxidação pelas espécies radicalares, antes a
chamada lipoperoxidação.
Neste ramo, que contempla a adaptação celular, podemos então falar de uma
adaptação funcional, sem alterações morfológicas (não reconhecível morfologicamente
quando submetido ao microscópio), condicionamento, hipertrofia, hiperplasia, atrofia e
metaplasia (que são tudo formas morfologicamente reconhecíveis de adaptação celular).
Como estamos no domínio da adaptação, todas estas formas são reversíveis ao contrário
da morte, da necrose e da apotose.
Dedicamos agora especial atenção à isquémia.
Isquémia: desiquilíbrio entre o fornecimento de oxigénio e o consumo de
oxigénio.
*Radical Livre é qualquer espécie molecular que tem um electrão livre desemparelhado numa orbital externa.
*2 ERO - Espécies Reactivas de Oxigénio
2
O desequilíbrio pode acontecer devido a uma diminuição do fornecimento ou
aumento do consumo. Isto pode conduzir a uma lesão reversível, mas pode também,
ultrapassando determinados limites quer de intensidade quer no tempo, conduzir a uma
morte celular (exemplo:enfarte do miocárdio).
A isquémia não pode de ser entendida como sinónimo de hipóxia (sendo hipóxia
como um insuficiente fornecimento de oxigénio aos tecidos). A isquémia não é só o
fornecimento de menos oxigénio mas também carência de outros substratos importantes
para o metabolismo da célula. Quando é interrompida a circulação (que é o que
acontece na isquémia) há acumulação de produtos do metabolismo e alguns deles são
lesivos para as próprias células como o peróxido de hidrogénio e o dióxido de carbono.
Em relação à hipóxia vamos tentar com a ajuda do significado destes vários tipos
dar exemplos de causas de hipóxia que se possam enquadrar dentro destes grandes
grupos:
Hipóxia Hipoxémica. Hipoxémica significa que há menos oxigénio no
sangue (está relacionado com a concentração de oxigénio no sangue). Pode
ser causada por:
- insuficiência respiratória. Se o pulmão não é capaz de fazer as trocas
gasosas, logo não é capaz de meter oxigénio no sangue.
- ambientes naturais de montanha (alta altitude) em que há rarefacção do
oxigénio inspirado.
- shunt direito-esquerdo, que é uma mistura de sangue venoso com
sangue arterial por uma anomalia anatómica. Direito/esquerdo pois as
cavidades direitas do coração têm sangue venoso e as cavidades
esquerdas têm sangue arterial. Se houver mistura do sangue venoso com
o sangue arterial então o sangue arterial vai ter menos oxigénio.
Hipóxia Anémica. Alterações quantitativas ou qualitativas da
hemoglobina. Agora trata-se de problemas não na oxigenação mas sim no
transportador de oxigénio, a hemoglobina. Pode ser causada por:
- Intoxicação por CO. O monóxido de carbono tem uma afinidade 240
vezes superior que o oxigénio para a hemoglobina. Logo provoca uma
capacidade inferior de transporte de oxigénio pois a hemoglobina está
ligada ao CO.
- Anemia. Que é uma menor concentração de hemoglobina, logo uma
menor concentração de transporte de oxigénio.
- Drepanocitose - doença em que há alteração da hemoglobina, e esta
precipita nos glóbulos vermelhos devido à diferente composição em aa.
Há uma mutação pontual que leva à substituição de 1 aa ácido glutâmico
por valina na posição 6 da cadeia β. Trata-se de uma alteração genética.
Revisão: Nem todas as doenças genéticas são hereditárias: por exemplo o cancro(que é
uma doença genética adquirida).
A drepanocitose tem outro nome: anemia das células falciformes. É por
isso mesmo uma anemia que leva à hipóxia anémica devido à diminuição
da concentração da hemoglobina. Os doentes com anemia das células
falciformes têm anemia devido a um rearranjo da estrutura da molécula
nomeadamente da estrutura terciária e quaternária, que leva a que
determinados aa passem a estar próximos, que não estavam na molécula
normal, e a que se estabeleçam ligações hidrofóbicas havendo
precipitação da hemoglobina. No entanto só precipita a hemoglobina
3
desoxigenada, formando fibras longas de polímeros de moléculas de
hemoglobina alterada, fibras rígidas que distorcem a forma do glóbulo
levando à destruição dos glóbulos pelos macrófagos. Pode ocorrer
também o entupimento da microcirculação provocando dores agudas nos
doentes devido a episódios de isquémia em vários orgãos causados pelo
entupimento. Um glóbulo vermelho tem cerca de 8 μm e os vasos mais
finos têm cerca de 3 μm por isso o glóbulo tem de ser muito maleável.
Estes doentes só começam a ter sintomas a partir dos 6 meses de idade
devido à hemoglobina F (fetal) que inibe a polimerização da
hemoglobina anormal (hemoglobina S). A hemoglobina normal do
adulto chama-se hemoglobina A.
- Hemoglobina com demasiada afinidade para o oxigénio que não liberta
o oxigénio para os vasos.
Hipóxia Isquémica. Pode ser causada por:
- Enfarte do miocárdio. Obstrução de uma coronária por uma trombose
que provoca isquémia, interrupção da circulação que provoca hipóxia.
Hipóxia Histotóxica. Incapacidade da célula de aproveitar o oxigénio
disponível. Há uma acção tóxica do tecido (“histo”-tóxica). O oxigénio
está lá mas se a célula não tem capacidade para o aproveitar então é como
se não existisse oxigénio disponível. Pode ser causada por:
- Intoxicação por cianeto. Leva à hipóxia histotóxica devido à inibição da
citocromoxidase pelo cianeto. Esta é uma enzima da cadeia respiratória
logo a cadeira respiratória não funciona.
- Choque térmico. O estado de choque circulatório relacionado com uma
infecção generalizada, as células ficam incapazes de utilizar o oxigénio
disponível levando a uma mortalidade muito elevada.
Hipóxia por aumento da necessidade de oxigénio.
- Claudicação intermitente. Claudicar é a falha por coxear e acontece a
que tem aterosclerose nas artérias dos membros inferiores, estreitamento
do lúmen das artérias logo incapacidade de receber tanto sangue como
numa situação normal aos músculos da perna. Portanto se ando, e ando
mais os músculos precisam de mais oxigénio para continuarem a contrair.
Se não tenho maneira de fornecer mais oxigénio o músculo entra em
sofrimento, entra em isquémia e liberta certas substâncias que vão
estimular as terminações nervosas e há dor.
Face a uma situação de hipoxia há maneira de compensar esta situação com
mecanismos de compensação:
Ventilação pulmonar. Ventilar mais vai colocar mais oxigénio no sangue
compensando a situação.
Débito cardíaco. Aumentando a quantidade de sangue que é enviada para
os tecidos por unidade de tempo, aumenta a quantidade de oxigénio que
chega aos mesmos.
Redistribuição circulatória. Se houver forma de conduzir mais sangue
para os tecidos que mais precisam dele, estamos a compensar a hipóxia.
Produção de eritrócitos. Produzindo mais glóbulos vermelhos, temos
mais hemoglobina e consequentemente mais oxigénio. Habitualmente a
4
medula óssea tem essa capacidade, responde a um estímulo para a
produção de eritrócitos que depende da produção de uma hormona, a
eritropoetina.
Dissociação da hemoglobina. Se pudermos deslocar a curva de
dissociação da hemoglobina para a direita no sentido de haver menor
afinidade da hemoglobina para o oxigénio, logo vai haver maior libertação
de oxigénio. Há certas variáveis que alteram esta curva, que a deslocam
para a direita como o aumento da temperatura, aumento da pressão parcial
de CO2, 2,3-difosfoglicerato, e o pH – quanto baixa o pH aumenta a
dissociação. Quando o pH baixa aumenta a concentração de H+, isto
acontece como consequência da glicólise anaeróbia em que o produto final
é o ácido láctico. Este desloca a curva de dissociação da hemoglobina no
sentido de dar mais oxigénio para que a glicólise seja aeróbia.
Muitos destes mecanismos de compensação têm eles próprios efeitos secundários,
efeitos que contrariam a compensação.
Por exemplo a produção de eritrócitos pode ter como desvantagem o aumento da
viscosidade sanguínea dificultando a microcirculação.
Consequências para a célula da isquémia:
Se não há oxigénio vai haver inibição da cadeia respiratória e inibição da
fosforilação oxidativa da produção de ATP. Portanto diminui o ATP. Vai haver também
aumento do cálcio intracelular. E sabe-se hoje bem que estes dois factores são decisivos
para conduzir a célula para a morte por necrose, o aumento do cálcio intracelular e a
diminuição do ATP. A necrose acontece sobretudo por lesão irreversível da
membrana sendo o mecanismo mais significativo da morte da célula.
Consequências da perda de ATP:
Glicogenólise - degradação do glicogénio (molécula de reserva de glisose)
– aumentando assim a glicose. Como a eficácia energética da glicose
anaeróbia é inferior à da glicólise aeróbia, temos de ir buscar glicose ao
glicogénio. Aumenta assim o ácido láctico e diminui o pH. Isto provoca
uma destabilização das membranas lisossómicas – os lisossomas são sacos
de enzimas que hidrolizam as moléculas - e isso leva à digestão celular.
Inibição da síntese proteíca.
Inibição da síntese de fosfolípidos.
Inibição das ATPases – as ATPases são fundamentais para garantir um
gradiente de concentração de iões entre o meio intracelular e o meio
extracelular. Se inibirmos as ATPases vamos ter problemas na manutenção
deste gradiente. Uma situação que acontece às celulas nesta situação é
incharem porque entra água, dá-se um edema celular, e vê-se ao
microscópio as células mais claras devido à diluição. Há também aumento
do cálcio intracelular. Este aumento do cálcio no interior da célula veio a
revelar-se muito importante para a causa da lesão isquémia. A
concentração de Ca2+ extracelular é cerca de 10-3 molar e no interior da
célula é de cerca de 10-7 molar. Isto representa uma diferença bastante
significativa. Esta é a situação normal. Devido à inibição das ATPases e
doutros mecanismos que não vamos falar, e porque a sequestração de
5
cálcio no retículo endoplasmático e na mitocôndrica fica inibida, aumenta
muito o cálcio no citosol. Acontece então a activação de muitas proteínas
na célula que vão ter um efeito muito negativo na mesma principalmente
na hidrolização das macromoléculas. Aumentam as proteínas cinases,
proteases que hidrolizam as proteínas, fosfolipases que hidrolizam os
fosfolípidos, ATPases, endonucleases, etc. Acontecem também outras
alterações que agravam ainda mais a lesão:
. Inibição da síntese proteíca;
. Alterações da expressão dos genes;
. Libertação de neurotransmissores;
. Vasoconstrição – a lesão é já por falta de sangue e o Ca2+ provoca a
contracção muscular e os vasos ainda apertam mais.
Mecanismos da irreversibilidade da lesão isquémica
Os últimos estudos feitos indicam a lesão da membrana como o factor
determinante na morte celular. Por métodos bioquímicos demonstrou-se que há uma
perda de fosfolípidos na membrana celular. Ocorre pois há menos síntese, porque há
menos energia. Há aumento da degradação enzimática porque há activação pelo
cálcio de fosfolipases. E há aumento da degradação não enzimática pelas espécies
reactivas do oxigénio, que fazem a chamada peroxidação - oxidação dos lípidos dos
ácido gordos polinsaturados que constituem os fosfolípidos da membrana. Tudo isto
leva a perda de fosfolípidos e acumulação de produtos tóxicos que são derivados da
degradação dos mesmos; alguns têm uma função detergente da membrana como os
lisofosfolípidos, outros são aldeídos que estabelecem ligações cruzadas. O próprio
citoesqueleto sofre alterações. Se a célula incha, as proteínas do citoesqueleto são
como que arrancadas dos locais onde têm a sua ancoragem e portanto há também lesão
da membrana devido a esses aspectos mêcanicos. É portanto a lesão da membrana que
leva à morte celular, à lesão irreversível.
No sistema nervoso central verificou-se que havia ainda um outro mecanismo que
ajudava à lesão dos neurónios – a excitotoxicidade. Existem neurotransmissores
estimuladores e inibidores. O ácido glutâmico é um neuro-transmissor estimulador que
tem a propriedade de provocar a abertura de canais (quando se liga a determinados
receptores de membrana), através dos quais entra cálcio (é um dos mecanismos de lesão
celular). Definiu-se então a excitotoxicidade: a toxicidade devida à libertação de
neurotransmissores estimulantes – isto acontece na isquéma, embora ainda não se
saiba muito bem porquê.
As mitocôndrias também têm uma acção renovante neste contexto; Têm-na devido
a poderem sofrer este tipo de alteração, que se chama transição da permeabilidade
mitocondrial; isto significa que, face a determinados estímulos e agentes tóxicos
(espécies radicalares, espécies reactivas de oxigénio, cálcio, fosfolipases, ceramidas que
resultam da degradação de esfingolípidos), há uma degradação da membrana
mitocondrial que provocam saída de cálcio das mitocôndrias que perturba s gradientes
fundamentais para manter a cadeia respiratória em funcionamento; o citocrómio C
também sai da mitocôndria por este processo, o que leva à menor formação de ATP, e
que pode levar à lesão celular por necrose. A saída de citocrómio C pode conduzir a
outro tipo de morte celular (a apoptose), que iremos falar mais à frente.
A viabilidade das células depende também da sua susceptibilidade – nem todas as
células são igualmente susceptíveis à falta de oxigénio (como sabemos, as células
6
nervosas sofrem com a falta de oxigénio num intervalo de tempo muito curto). As
células do miocárdio resistem mais à isquémia (felizmente). Diferentes células têm
diferentes susceptibilidades à lesão isquémica.
O conceito de zona de penumbra é também importante: quando há um foco
isquémico, há uma zona central que sofre muito e há uma zona à volta que sofre um
bocadinho menos. Um dos objectivos da intervenção médica é tentar salvas as células
da zona de penumbra, porque as células do foco isquémico estão geralmente
“condenadas”.
Vamos agora ser um pouco mais concisos na apresentação de alguns conceitos.
Reperfusão – voltar a fazer chegar sangue a uma zona que esteve em
isquémia. Depois deste período de isquémia (quando há reperfusão) pode haver
agravamento da lesão celular. Aparentemente, é contraditório. Ainda assim, devemos
tentar reperfundir a zona que sofreu lesão isquémica. Por exemplo, quando há um
ataque de coração, deve fazer-se a reperfusão através de cuidados coronários; deve
desobstruir-se a coronária para haver de novo fluxo de sangue nessa zona. Resumindo, a
reperfusão também se acompanha de lesão celular. Temos então de desenvolver
estratégias para evitar a lesão de reperfusão. Esta lesão está muito ligada à produção de
espécies reactivas de oxigénio.
Concretamente, em relação ao miocárdio, a reperfusão pode levar à recuperação (é
o ideal), mas também pode levar ao atordoamento do miocárdio (isto é, ele funciona
pior durante algum tempo), a arritmias (que podem ser mortais), lesão vascular e morte
celular na zona de penumbra.
Há então lesão de isquémia e lesão de reperfusão.
Outro conceito importante está relacionado com a destruição das membranas das
células quando estas morrem; nesse caso, o meio intracelular passa para o meio
extracelular, e daí para o sangue. Portanto, podemos ter como marcador de necrose o
doseamento de determinadas substâncias no sangue periférico – saem para o sangue
enzimas que podemos dosear. Se por exemplo existem enzimas que existem no
miocárdio, e se a sua concentração no sangue aumenta, significa que teve uma necrose
do miocárdio. O mesmo acontece para outros tecidos; por exemplo, no caso do pâncreas
(que produz uma enzima, a amilase), pode medir-se a amilacémia e se esta for elevada
traduz uma necrose no pâncreas.
Outro dos conceitos que vale a pena referir é o de condicionamento celular. Se
imaginarmos uma célula no estado basal, e se a célula sofrer um primeiro ataque (pode
ser um tóxico, ou um período de isquémia), ela fica num estado condicionado que vai
fazer com que (durante um certo tempo), ela responda de forma diferente a um segundo
ataque. Este condicionamento pode ser defensivo (há uma resisténcia melhor ao
segundo ataque, havendo um período de protecção) ou destrutivo (em que a célula se
torna mais vulnerável). No caso o coração, só se conhece um condicionamento
protectivo. Este conceito é importante porque após o primeiro ataque (que não tem
intensidade suficiente para matar a célula, ou então a história acaba), se esta estiver num
período de protecção, ela pode não morrer se estiver em condicionamento mesmo que a
intensidade do segundo ataque pudesse ser letal. O condicionamento permite uma maior
viabilidade, uma melhor contracção, etc. Pode haver uma adaptação rápida ou lenta. Os
ataques podem ser de natureza diferente. Pode haver uma isquémia ou pode submeter-se
a célula a uma endotoxina (produzidas por bactérias gram negativas). Um determinado
tipo de agente agressor deixa a célula condicionada para esse tipo.
7
Há proteínas (produzidas em resposta a um choque térmico) que são constitutivas
(existem normalmente na célula em concentrações baixas), e outras cuja síntese é
induzida, que aumentam muito quando a célula é agredida. Por exemplo a ubiquitina é
uma proteína que marca as proteínas para a destruição (nos proteossomas). Isto é muito
importante depois de uma lesão, pois a célula tem de se ver livre das proteínas
desnaturadas para poder sobreviver. As chaperoninas são muito importantes no
enrolamento (durante a síntese das proteínas). Estas também refazem as estrutura
terciária e quaternária de proteínas que sofreram uma lesão (por choque térmico ou por
outros factores). Outro grupo importante é o das enzimas anti-oxidantes. Há uma
sobrecarga oxidante quando há formação de muitos radicais de oxigénio; estas enzimas
degradam espécies reactivas de oxigénio. Exemplos: superóxido dismutase, catalase (é a
enzima mais rápida do nosso organismo, que degrada o peróxido de hidrogénio em
água).
Mais um conceito: a morte celular. Esta pode ser acidental (necrose) ou
programada (apoptose). Pode acontecer por acidente (se deixarem de receber oxigénio
ou nutrientes), e dá-se a necrose – pode acontecer devido a tóxicos, a efeitos de energia
cinética que esmaga a célula, a variações de temperatura, etc. As células também podem
ser programadas para morrer (apoptose) ou podem ser eliminadas por células
imunitárias do corpo (o que acontece também por apoptose). Por exemplo, no embrião
formam-se membranas entre os dedos, que desaparecem porque as células sofrem
apoptose. No caso do coração embrionário, as cavidades cardíacas estão cheias de
células que sofrem apoptose e abrem a cavidade. A apoptose é então fundamental para a
morfogénese.
A apoptose pode ser induzida pelas células do sistema imune ou por estímulos
como temperatura, radiação, etc. Assim se prova que há factores comuns à apoptose e à
necrose, sendo que efeitos mais fracos provocam geralmente apoptose.
Duas diferenças fundamentais entre necrose e apoptose: na necrose, a membrana
rompe-se e o conteúdo da célula sai para o meio extracelular. Na apoptose, as células
ficam engelhadas e formam-se corpos apoptóticos que têm membrana e que no seu
interior contêm o que fazia parte da célula; estes corpos apoptóticos são depois
fagocitados; assim, não se gera resposta imune em relação à apoptose, mas já há
resposta à necrose. Para além disto, a necrose ocorre quando a célula não tem energia, a
apoptose requer energia, e depende de enzimas proteolíticas (as caspases, enzimas
específicas deste processo), de ligações cruzadas, da degradação do DNA e do
reconhecimento para a fagocitose (o macrófago é responsável pelo reconhecimento de
determinadas proteínas da membrana). O processo apoptótico é muito complexo.
A apoptose também está implicada em vias patogénicas: a inibição da apoptose
explica parcialmente determinadas doenças, como as doenças auto-imunes (há células
do sistema imune que atacam as nossas próprias células, porque não conseguimos fazer
com que haja apoptose destas células), e do cancro (há proliferação celular, mas se
houvesse apoptose, não havia formação de uma grande massa celular – se a apoptose
estiver inibida, há descompensação e grande proliferação). O excesso de apoptose
também pode ser mau: no caso da SIDA, os linfócitos TD4 são destruídos; doenças
neurodegenerativas (Alzheimer, Parkinson) também podem ser devidas à morte celular
em excesso, por apoptose descontrolada.
Vários mecanismos que levam à produção de espécies reactivas de oxigénio
(hipóxia, radiações ionizantes, xenobióticos) levam à lesão do DNA, das proteínas, dos
lípidos, e à perda de ATP. Outros factores (como o sistema do complemento, o trauma)
podem levar ao aumento da permeabilidade, que leva ao aumento do cálcio, que activa
8
proteases, que inibem bombas iónicas (tal como a perda de ATP), que levam de novo ao
aumento da permeabilidade – processos cíclicos interligados que contribuem no seu
conjunto para a produção de radicais livres.
Resumo de conceitos/terminologia:
Quando as células são submetidas a uma sobrecarga de trabalho (ou estimulações
hormonais), podem adaptar-se a esta nova situação (temporariamente), sofrendo
hipertrofia – aumento do volume das células em resposta aos estímulos. Estes podem,
em determinadas condições, levar à proliferação celular – hiperplasia (pode ou não ser
patológico). O oposto é a atrofia , por exemplo os músculos de uma pessoa acamada vão
atrofiar (também muito comum no envelhecimento). A involução é a diminuição do
número de células.
A metaplasia é a mudança do tipo de célula (aspecto), que é determinada por
alterações do ambiente em torno da célula, ou por uma irritação crónica. Por exemplo, a
porção terminal do esófago é revestido por um epitélio pavimentoso estratificado
(parecido com o da epiderme), e em consequência do contacto com o refluxo gastroesofágico (azia), há tendência para uma alteração do epitélio. Este muda (porque é
pouco resistente ao ácido) e passa a ser parecido ao epitélio que reveste o estômago e o
intestino – epitélio colunar. Há uma adaptação ao ácido. Há metaplasias que levam à
formação de cancros; no entanto, metaplasia apenas significa alteração do tipo celular.
Agenésia e hiperplasia aplicam-se a alterações do desenvolvimento (quem nasce
sem um rim tem agenésia ou aplasia do rim; não tem uma hipoplasia – nasceu logo sem
ele, não é uma adaptação. Quando há uma adaptação, devido por exemplo a uma doença,
diz-se que há uma atrofia do rim. Se já nasce com o rim mal formado, diz-se que tem
uma hipoplasia do rim).
9