QUÍMICA DESCRITIVA
A descrição da preparação, propriedades
aplicações dos elementos e seus compostos.
e
• Algumas definições:
• Mineral – é toda substância sólida natural de origem não
orgânica.
• Minério- é todo mineral que apresenta interesse
econômico.
• Ganga – Impurezas contidas no minério.
• Metalurgia – é a extração do metal a partir do minério.
• Siderurgia – é a metalurgia do ferro( e do aço)
Processos metalúrgicos
• Ustulação – é a metalurgia a partir dos sulfetos
metálicos, que são aquecidos na presença de oxigênio.
MS + O2→ M + SO2 ( onde M+2)
• Redução com carvão coque – utilizada com a maioria
dos óxidos metálicos.
MO + C → M + CO
• Redução com alumínio – utilizada para óxidos metálicos
que apresentam metais de alto valor comercial.(Cr e Mn)
Cr2O3 + 2Al → 2Cr + Al2O3
• Redução eletrolítica (eletrólise) – utilizada para obter
metais de baixo potencial de redução(alto potencial de
oxidação)
• CÁLCIO
• O cálcio é um sólido leve, maleável, brancoprateado, brilhante e muito reativo. Ele é
produzido por eletrólise ígnea do CaCl2 (CaCl2
→ Ca + Cl2). É encontrado em abundância na
natureza e tem grande importância comercial
pois está presente no calcário, mármore, gesso,
etc.
• FLÚOR
• O flúor é um gás amarelo-esverdeado,
extremamente venenoso, corrosivo e é o
elemento mais eletronegativo (ganha elétrons
com muita facilidade). É produzido através da
eletrólise do ácido fluorídrico (2HF → H2 + F2). É
utiliza
principalmente
na
produção
de
compostos orgânicos (teflon, CFC, etc) , de
ácido fluorídrico e no enriquecimento do urânio.
• CLORO: É um gás venenoso(Cl2), amareloesverdeado que ocorre abundantemente na
natureza na forma de cloreto de sódio na água do
mar. Tem muitas aplicações, como na cloração de
água para beber, como branqueador e na
produção de um elevado número de produtos
químicos orgânicos.
• Eletrólise ígnea ou aquosa do NaCl
• Reação de deslocamento de sais de cloreto por
flúor
• Reação de MnO2 + HCl→ MnCl2 + Cl2 + 2 H2O
Cl2 + H2O→ HClO + HCl
• Bromo (Br2) d = 3,13 g.cm-3, PF = -7,2°C, PE =
58,78°C. É um líquido volátil vermelho à
temperatura ambiente, com vapor marrom
avermelhado. O bromo é obtido de água salgada
nos
Estados
Unidos
da
América,
por
deslocamento com cloreto. Grandes quantidades
são usadas para preparar o 1,2-dibromoetano, um
aditivo de combustíveis. Também é usado na
produção
de
muitos
outros
compostos.
Quimicamente sua reatividade é intermediária
entre o cloro e o iodo. O líquido é perigoso para o
tecido humano e o vapor irrita os olhos e a
garganta.
• Iodo (I2 ) d = 4,94g.cm-3; PF = 113,5ºC; PE =
183,45ºC. O elemento é insolúvel em água, mas
é solúvel em etanol e em outros solventes
orgânicos. O iodo é necessário como elemento
em nível de traço nos organismos vivos; em
animais está concentrado na glândula tireóide
como constituinte dos hormônios que ela
produz. O elemento está presente na água do
mar e antigamente era extraído de algas
marinhas.
Atualmente
é
obtido
por
deslocamento por cloro de água salgada
encontrada em perfurações de petróleo. É
usado em medicina como anti-séptico suave
(dissolvido em etanol, como "tintura de iodo") e
na indústria de compostos de iodo.
• Hidrogênio (H2) Gás, incolor e inodoro, d =
0,0899 g.L-1, PF = - 259,14 °C, PE = -252,87 °C.
Na forma elementar ele ocorre como o gás H2,
que é produzido industrialmente por eletrólise
da água ou por reforma de gás natural. Ele é
muito usado na produção de amônia (processo
Haber)
e
como
agente
redutor
na
industrialização de minérios, no refinamento de
petróleo, na produção de hidrocarbonetos a
partir de carvão e na hidrogenação de óleos
vegetais. Também há grande interesse no uso
de H2 como combustível pois a sua combustão
com
oxigênio
produz
água.
• MAGNÉSIO
• O magnésio é um sólido leve, prateado,
maleável e muito reativo. É produzido por
eletrólise ígnea do MgCl2 (MgCl2 → Mg + Cl2).
Ele reage violentamente com o oxigênio (flash
descartavés de câmeras fotográficas é utilizado
entre outras coisas como "metal de sacrifício"
(protege da oxidação um outro metal).
• OXIGÊNIO
• O oxigênio é um gás incolor, inodoro, não
inflamável, comburente e muito reativo. É
produzido através da destilação do ar líquido,
onde ocupa 21% de seu volume, ou pela
eletrólise da água (2H2O → 2H2 + O2). É o
elemento mais abundante da Terra, sendo muito
importante pois ele é necessário para a
respiração de todos os seres aeróbicos.
• Pode ser obtido em laboratório pela
decomposição
térmica
do
clorato
de
potássio(KClO3)
2KClO3 → 2KCl + 3O2
• Nitrogênio (N2) Gás incolor, inodoro e inerte,d
= 1,2506 g.L-1, PF = -209,86°C, PE = -195,8°C.
Ocorre no ar (cerca de 78% em volume) e é
constituinte essencial de proteínas e ácidos
nucleicos dos organismos vivos. O nitrogênio é
obtido por destilação fracionada do ar líquido
para finalidades industriais. O nitrogênio puro
pode ser obtido em laboratório por aquecimento
de azida de metal ou decomposição térmica do
nitrito de amônio. Ele é usado no processo de
Harber para produção de amônia e também na
criação de atmosfera inerte em processos de
soldagem e metalurgia. Reage com hidrogênio a
altas temperaturas e com oxigênio durante
descargas elétricas. Também forma nitretos
com certos metais.
• SÓDIO
• O sódio é sólido, leve, muito maleável e muito
reativo. É produzido através da eletrólise ígnea
do NaCl (2NaCl → 2Na + Cl2). Deve ser
guardado em um recipiente com querosene pois
em contato com o ar ele queima e em contato
com a água ele explode.
• Enxofre d = 2,07 g.cm-3, (forma rômbica), PF =
112,8°C (forma rômbica), PE = 444,674°C
(forma rômbica). O elemento ocorre na natureza
em muitos minerais à base de sulfetos e
sulfatos. O enxofre nativo é encontrado na
Sicília (Itália) e nos Estados Unidos da América
(obtido pelo processo Frasch). É elemento
essencial para os organismos vivos. O enxofre
tem várias formas alotrópicas. Ambas as formas
cristalinas contêm moléculas S8. As flores de
enxofre são um pó amarelo obtido por
sublimação do vapor. É usado como fungicida
vegetal. O elemento é usado para produzir
ácido sulfúrico, pólvora, na vulcanização da
borracha e outros compostos.
• Amostra de minério de
enxofre nativo.Ocorre
como produto de
sublimação vulcânica e
em depósitos
sedimentares.
Utilizado na produção
de
ácido sulfúrico,
pesticidas,
etc.
• Amostra
de pirrotita,
minério de FeS, encontrado
principalmente em rochas
vulcânicas básicas. É usado
na
produção
de
ácido sulfúrico.
• Amostras de pirita, FeS2,
o principal minério de
enxofre,
também
conhecido como "ouro
dos
tolos".
Brilho
metálico, opaco, amarelo.
É usado na produção de
ácido sulfúrico.
• Fósforo O elemento é muito reativo.
Forma fosfetos com metais e se liga
covalentemente formando compostos de
fósforo (III) e fósforo (IV). O fósforo é um
elemento essencial dos organismos vivos.
Ocorre em várias rochas de fosfato e é
extraído por aquecimento de carvão
(coque) e óxido de silício (IV) em forno
elétrico (1500° C). Junto com ele são
produzidos silicato de cálcio e monóxido
de carbono.
Apatita, minério de composi
ção Ca5(F, Cl, OH) (PO4)3,
fosfato
de
cálcio. Tem brilho vítreo,
traço branco a amarelado,
varia
de transparente a opaco.
Ocorre em várias cores. A
apatita
e
o
fosforito são os minérios
usados na fabricação
de
ácido
fosfórico,
fosfatos
e
fertilizantes.
• Carbono PF ~ 3550°C, PE = 4289°C.
Quimicamente, é o único elemento capaz de
formar muitos compostos contendo cadeias e
anéis apenas de átomos de carbono.
Apresenta três formas alotrópicas:
diamante, grafite e fulereno.
• Diamante: d = 3,52 g.cm-3. Ocorre
naturalmente e pequenas quantidades podem
ser produzidas sinteticamente. É extremamente
duro e forma cristais altamente refrativos. A
dureza do diamante resulta da sua estrutura
cristalina covalente, na qual, cada átomo de
carbono está ligado covalentemente a quatro
outros, situados nos vértices de um tetraedro
O quilate é uma unidade de massa usada no
comércio, o valor de 200 mg ou 0,2 g para o
quilate.
• grafite: C, d = 2,25 g.cm-3. Substância lamelar,
preta e mole. Ocorre naturalmente e também
pode ser obtida pelo processo de Acheson, que
envolve o aquecimento de coque com argila
para formar carbeto de silício, SiC, que perde o
silício a 4150°C, ficando o grafite. Tem várias
aplicações
incluindo
contatos
elétricos,
equipamentos para altas temperaturas e
lubrificantes sólidos. Grafite misturado com
argilas
constitui
a
mina
dos
lápis.
Também há várias outras formas de carbono
amorfo
como
o
carvão.
• Carvão mineral:
– Turfa(65% de C), linhito(75% de C),
hulha(85% de C) e antracito( acima de 90%
de C)
O carvão de maior importância é a hulha, que a
partir de sua destilação seca pode-se obter 3
frações: gasosa – gás de rua (metano,
monóxido de carbono e hidrogênio), líquidaalcatrão (mistura de compostos aromáticos) e
sólido – carvão coque
• Ferro Fe. Sólido prateado, maleável e dúctil d =
7,87 g.cm-3, PF = 1535ºC, PE = 2750ºC. As
principais fontes são os minérios hematita
(Fe2O3),
magnetita
(Fe3O4),
limonita
(FeO(OH)nH2O), ilmenita (FeTiO3), siderita
(FeCO3) e pirita (FeS2). O metal é fundido em
ambiente redutor em forno e depois é
processado para obtenção de ferro e de vários
tipos de aço.
• Nos vertebrados existe íon de ferro na
molécula de hemoglobina do sangue que faz o
transporte de oxigênio dos pulmões para o
tecido e do dióxido de carbono das células para
os pulmões.
• O corpo de uma pessoa adulta normal
contem cerca de 3 gramas de ferro,
a maior parte dele na hemoglobina.
O ferro é muito reativo sendo oxidado pelo
ar úmido, deslocando o hidrogênio de
ácidos diluídos e se combinando com
elementos não metálicos.
Amostra de hematita
vermelha, Fe2O3, usada
como corante (ocre).
Abundante no Brasil.
Amostra de limonita ou
ferro pardo, Fe2O3.nH2O.
Fotografia de cristais de
magnetita, Fe3O4, sobre
clorita. A magnetita é o
minério com o maior teor
de ferro.
Siderita, FeCO3, minério
abundante no Brasil.
• Alguns tipo materiais a base de ferro:
•
•
•
•
•
•
Ferro-gusa –contém de 2-5% de carbono
Aço: 0,5-2% de carbono.
Ferro galvanizado – ferro protegido por zinco.
Lata – mistura de ferro e estanho.
Aço inoxidável: liga de ferro ( Fe+C+Cr+Ni)
Ferrugem: mistura complexa de óxidos e
hidróxidos de Fe+2 e Fe+3.
• Cobre - Metal marrom avermelhado. d = 8,93
g.cm-3, PF = 1083,4ºC, PE = 2582ºC. O metal é
maleável, dúctil e um excelente condutor de
calor e eletricidade. Os minerais que contêm
cobre
são
cuprita
(Cu2O),
azurita
(2 CuCO3 . Cu(OH)2)), calcopirita (CuFeS2) e
malaquita (CuCO3 . Cu(OH)2).
• Os minérios são tratados por fusão, lixiviação e
eletrólise. Suas ligas de cobre-zinco (latão) e
cobre-estanho (bronze) também são muito
usadas. A água não ataca o cobre, mas nas
atmosferas úmidas forma lentamente película
superficial verde (zinabre). O metal não reage
com os ácidos clorídrico e sulfúrico diluído, mas
com ácido nítrico forma óxidos de nitrogênio.
Minério de cobre
nativo, Cu.
Azurita, 2
CuCO3.Cu(OH)2.
Cuprita, Cu2O.
Malaquita,
CuCO3.Cu(OH)2.
• Chumbo Pb. Elemento metálico, denso, mole,
dúctil, cinzento.d = 11,35g.cm-3; PF = 327,5°C;
PE = 1740°C. O principal minério de chumbo é a
galena, PbS. Outras fontes deste elemento são
os minerais anglesita (PbSO4), cerusita (PbCO3)
e litarge (PbCO3). O metal é extraído por
aquecimento do minério para obtenção do
óxido, seguida da redução por carvão. A prata
também é encontrada nestes minérios. O
chumbo tem várias aplicações incluindo material
para construção civil, baterias de chumbo, balas
para armas de fogo, ligas fusíveis e algumas
outras ligas especiais.
Amostra de galena, PbS, com
calcita, de uma mina da região de
Westfália, Alemanha
Amostra de cerussita,
PbCO3, outro importante
minério de chumbo.
• Estanho Sn. É maleável e prateado; d =
7,29g.cm-3; PF = 231,97ºC; PE = 2270ºC. É
encontrado como óxido de estanho (IV) nos
minérios como a cassiterita (SnO2) e é extraído
por redução com carbono. O metal é usado em
camadas de proteção em chapas de aço e
constitui importante elemento de ligas (por
exemplo: bronze fosforado (liga à base de cobre
e estanho contendo até 1% de fósforo), liga
metálica para armas de fogo, solda, metal de
Babbitt e latas que são ligas geralmente com
63% de estanho, para embalagens de
alimentos. Quimicamente é reativo. Combina
diretamente com cloro e oxigênio e desloca o
hidrogênio de ácidos diluídos.
Amostra de cassiterita, SnO2,
o principal minério de estanho e
uma das riquezas minerais da
Amazônia.
• Zinco Zn. Elemento metálico branco-azulado, d
= 7,1 g.cm-3, PF = 419,57ºC, PE = 907ºC.
Ocorre na esfarelita (ou blenda de zinco, ZnS)
que é encontrada associada ao sulfeto de
chumbo e à smithsonita (ZnCO3). Os minérios
são aquecidos ao ar para dar o óxido que é
reduzido com carvão (coque) a alta
temperatura. O vapor do zinco é condensado.
Outro modo é dissolver o óxido em ácido
sulfúrico e obter o zinco por eletrólise.O metal é
usado na galvanização e em várias ligas.
Quimicamente é um metal reativo que combina
com oxigênio e com outros não metais. Reage
com ácidos diluídos liberando hidrogênio.
Amostra de smithsonita,
ZnCO3.
Esfarelita ou blenda de zinco,
ZnS, o mais importante minério
de zinco
• Mercúrio- Um elemento metálico, prateado,
líquido e pesado. Seu principal minério é o
sulfeto de mercúrio, HgS, que pode ser
decomposto nos seus elementos. O mercúrio é
usado em termômetros, barômetros, em outros
equipamentos científicos e em amálgama
dentário. O elemento é menos reativo que zinco
e cádmio e não desloca o hidrogênio de ácidos
fracos.
Amostra de
cinábrio, HgS
• Ouro Au. Elemento metálico de transição
amarelo, mole e maleável. d = 19,32g.cm-3; PF
= 1064,43°C; PE = 2807°C. É encontrado na
natureza como metal livre no cascalho e em
veios no quartzo. Ocorre nos minérios de
sulfetos de chumbo e cobre e também
combinado com prata em minério de telúrio (Ag,
Au) Te2. É usado na joalheria, como material
dentário e em dispositivos eletrônicos.
Quimicamente não é reativo, não sendo afetado
pelo oxigênio.
• Pepita de ouro de 170
gramas, encontrada em 1980
na região de Carajás, no
Estado do Pará, Brasil.
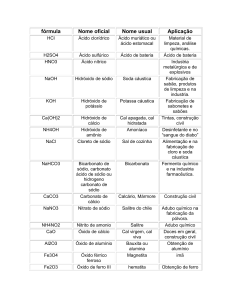
ÁCIDOS
• ÁCIDO CLORÍDRICO ( HCl ): o ácido clorídrico é
uma solução aquosa de cloreto de hidrogênio.
Apresenta-se como um líquido fumegante claro e
ligeiramente amarelado, com odor pungente e
irritante.
Pode ser preparado no laboratório por aquecimento
de cloreto de sódio com ácido sulfúrico
concentrado.
Industrialmente é obtido diretamente a partir da
reação entre gás hidrogênio e gás cloro a
temperaturas elevadas.
É utilizado principalmente para limpeza e
tratamento de metais ferrosos, flotação e
processamento de minérios, acidificação de poços
de petróleo, regeneração de resinas de troca
iônica, na construção civil, neutralização de
efluentes, fabricação de produtos para a indústria
de alimentos e farmacêutica, entre muitos outros.
• ÁCIDO SULFÚRICO: um líquido oleoso e
incolor de fórmula, H2SO4
É raro usar-se o ácido puro, está geralmente
disponível em solução de 96 a 98%. É usado
em grande extensão na indústria, sendo as
principais aplicações em fertilizantes, químicos,
tintas e pigmentos, detergentes e fibras. É
também um agente de desidratação poderoso,
capaz de remover água de muitos compostos
orgânicos.
• ÁCIDO FOSFÓRICO(H3PO4): É muito
solúvel em água e solúvel em etanol. O
ácido fosfórico é muito deliquescente e é
geralmente fornecido com uma solução
aquosa
concentrada
a
85%.
É o derivado de fósforo mais importante
comercialmente, respondendo por mais de
90% da rocha fosfato que é extraída.
Muito usado como fertilizante, aditivo
alimentar, na indústria de açúcares e de
detergentes.
• ÁCIDO
NÍTRICO(HNO3):
líquido
incolor,
corrosivo e venenoso.
O ácido nítrico pode ser preparado em
laboratório por destilação de uma mistura de um
nitrato de um metal alcalino e ácido sulfúrico
concentrado.
O ácido nitrico é um ácido forte, altamente
dissociável em solução aquosa, e as soluções
diluídas comportam-se de forma idêntica às dos
outros ácidos minerais. O ácido nítrico
concentrado é um agente de oxidação
poderoso.
A maioria dos metais dissolvem-se formando
nitratos e originando também óxidos de
nitrogênio.
•
nome oficial, ácido etanóico.
De fórmula molecular, CH3COOH.
É um líquido claro, viscoso, de cheiro picante e
solúvel em água.
Quando resfriado abaixo de 16,7 oC, sofre
solidificação formando cristais brilhantes, incolores
e
transparentes
com
aspecto
de
gelo.
Devido a este fato, o ácido acético, quando puro,
recebe o nome de ácido acético glacial.
O ácido acético um líquido incolor com odor
acentuado, é o componente ácido do vinagre e é
responsável pelo seu cheiro característico.
Como forma oxidada do etanol, é produzido quando
o vinho permanece exposto ao ar e o etanol sofre
oxidação aeróbica pela bactéria Acetobacter.
É ele ainda que dá aos vinhos de baixa qualidade o
gosto característico de vinagre.
O ácido acético é utilizado na preparação de
perfumes, corantes, acetona e seda artificial.
ÁCIDO
ACÉTICO:
BASES
• HIDRÓXIDO DE SÓDIO (NaOH) : um sólido
deliqüescente, translúcido branco, solúvel em
água e etanol, mas insolúvel em éter. É
fortemente
alcalino
e
encontra
muitas
aplicações na indústria química, particularmente
na produção de sabões e de papel.
É também usado para adsorver gases ácidos,
como o dióxido de carbono e o dióxido de
enxofre e é usado no tratamento de despejos
para a remoção de metais pesados e de acidez.
As soluções de hidróxido de sódio são
extremamente corrosivas para os tecidos do
corpo e são particularmente perigosas para os
olhos.
• HIDRÓXIDO DE CÁLCIO : hidróxido de cálcio
ou cal apagada, hidratada ou extinta é um sólido
branco, Ca(OH)2, que se dissolve parcialmente
na água (água de cal). É produzido pela adição
de água a óxido de cálcio, um processo que
desenvolve gradualmente muito calor e é
conhecido como caldeamento. É usado como
base barata para neutralizar a acidez de certos
tipos de solo e na produção de argamassa, leite
de cal, cloreto de cal e vidro.
• HIDRÓXIDO DE MAGNÉSIO: um composto
sólido branco, Mg(OH)2. Ocorre naturalmente
como mineral brucita e pode ser preparado
fazendo reagir sulfato de magnésio com solução
de hidróxido de sódio. É usado na refinação do
açúcar e no processamento de urânio.
Medicinalmente é importante como antiácido e
laxante, uma suspensão com aproximadamente
8% de hidróxido de magnésio em água.
• HIDRÓXIDO DE ALUMÍNIO : [Al(OH)3]
precipitado branco gelatinoso, de propriedades
variáveis de acordo com o método de
precipitação. Pode ser obtido pelo tratamento de
uma solução de sal de alumínio, como sulfato
ou o cloreto, com hidróxido de sódio, carbonato
de sódio ou amônia. Ao se formar o precipitado
de hidróxido de alumínio, ele tem a propriedade
de adsorver moléculas orgânicas que por
ventura estejam em solução. Por isto muito
usado em tingimentos e também para a
preparação de lacas para a pintura artística.
Usado também em purificação industrial da
água, em produtos químicos e composições
lubrificantes.
• HIDRÓXIDO DE ALUMÍNIO HIDRATADO
: [Al(OH)3.3H2O] pó cristalino branco,
insolúvel em água. Obtido por precipitação
com CO2 ou autoprecipitação de soluções
de aluminato de sódio feita pelo
tratamento de bauxita com solução de
hidróxido de sódio. Usado na fabricação
de vidro, cerâmica, tingimento, fabricação
de produtos químicos, zeólitos.
• HIDRÓXIDO DE POTÁSSIO : potassa cáustica ou
líxivia, é um sólido branco deliquescente, KOH,
muitas vezes vendido como bolinhas, lâminas ou
barras, solúvel em água e em etanol e muito
levemente solúvel em éter.
É preparado industrialmente pela eletrólise de
solução de cloreto de potássio concentrada, mas
também pode ser obtido por aquecimento de
carbonato ou sulfato de potássio com cal apagada,
Ca(OH)2.
Usado como adsorvente para dióxido de carbono e
de dióxido de enxofre, na produção de sabão macio,
de outros sais de potássio, em pilhas Ni-Fe e em
pilhas alcalinas.
O hidróxido de potássio é extremamente corrosivo
para os tecidos do corpo e especialmente prejudicial
para os olhos.
• HIDRÓXIDO DE AMÔNIO : um composto de
fórmula: NH4OH, formado mediante a adição de
amônia (NH3) à água, segundo a reação:
NH3+H2O→ NH4OH
É uma base fraca, pois tem preferência a se
decompor, sobrando poucas partículas para se
dissociar, usada na preparação de sais de
amônio.
SAIS
• CLORETO DE SÓDIO : sal comum ( NaCl), um
sólido cristalino incolor, solúvel em água e muito
ligeiramente
solúvel
em
etanol.
Ocorre como o mineral halita(sal rochoso), em
salmouras naturais e na água do mar. Tem a
interessante propriedade da solubilidade na
água variar muito pouco com a temperatura. É
usado industrialmente para uma variedade de
produtos que têm por base o sódio e é
conhecido universalmente como preservante e
tempero alimentar. O cloreto de sódio tem um
papel chave nos sistemas biológicos na
manutenção de balanços eletróliticos.
• CARBONATO DE SÓDIO : é um pó
branco, de fórmula: Na2CO3, que
endurece e se agrega quando exposto ao
ar devido à formação de hidratos. O
carbonato de sódio pode ser produzido
por cristalização adequada de seus
depósitos naturais ( trona; natro; ranksita;
pirsonita e gailussita ). O carbonato de
sódio é usado em fotografia, em limpezas,
no controle do pH da água, no tratamento
têxtil, vidros e como aditivo alimentar.
• BICARBONATO DE SÓDIO (NaHCO3): ou
hidrogeno carbonato de sódio, pó branco que
por aquecimento perde gás carbônico. Muito
usado em bebidas e sais efervescentes, como
fermento
químico,
como
reagente
de
laboratório, na eletrodeposição de ouro e
platina, em curtumes; no tratamento de lã e da
seda; em extintores de incêndio; como antiácido
em Medicina ( por ingestão ); na cerâmica; para
preservação da manteiga e de madeiras.
Pode ser produzido por reação de dióxido de
carbono com hidróxido de sódio líquido.
• FLUORETO DE SÓDIO : um sólido cristalino,
NaF, solúvel em água e muito ligeiramente
solúvel
em
etanol:
geometria
cúbica.
Ocorre naturalmente como viliaumita e pode ser
preparado por reação de hidróxido de sódio ou
de carbonato de sódio com fluoreto de
hidrogênio. O composto é usado em
esmaltagem de cerâmica e como um agente de
preservação para fermentação. É altamente
tóxico, mas em soluções muito diluídas é usado
na fluoretação de água para a prevenção da
cárie dos dentes devido à sua habilidade para
substituir grupos hidroxilas com grupos fluoretos
no material do esmalte dos dentes.
• NITRATO DE SÓDIO : nitrato de sódio ou
salitre do Chile um sólido branco, de fórmula,
NaNO3, solúvel em água e em etanol.
É obtido de depósito de caliche, ou pode ser
preparado por reação de ácido nítrico com
hidróxido de sódio ou carbonato de sódio. Era
antes usado na produção de ácido nítrico por
aquecimento com ácido sulfúrico concentrado.
O seu principal uso é como adubo nitrogenado
• NITRATO DE POTÁSSIO: KNO3, solúvel
em
água,
insolúvel
em
álcool.
Ocorre naturalmente como nitro e pode ser
preparado pela reação de nitrato de sódio com
cloreto de potássio seguido de cristalização
fracionada. É um poderoso agente de oxidação
e é usado na pólvora e em fertilizantes
• CARBONATO DE CÁLCIO : um sólido branco, de
fórmula CaCO3, que é pouco solúvel na água. O
carbonato
de
cálcio
decompõe-se
por
aquecimento formando-se óxido de cálcio ( cal
viva) e dióxido de carbono.
Ocorre na natureza como os minerais calcita e
aragonita. As rochas contendo carbonato de
cálcio dissolvem-se lentamente sob a ação de
chuvas ácidas (contendo CO2 dissolvido)
provocando dureza temporária.
No laboratório, o carbonato de cálcio é
precipitado borbulhando dióxido de carbono na
solução aquosa de cal viva.
O carbonato de cálcio é usado na produção de
cal (óxido de cálcio) por aquecimento
(decomposição térmica ), segundo a reação:
CaCO3 → CaO + CO2
• FOSFATO DE CÁLCIO : um pó branco
insolúvel, Ca3(PO4)2.
Encontra-se na natureza no mineral apatita e
também em rochas fosfato. É também o
principal constituinte dos ossos dos animais. O
fosfato de cálcio pode também ser preparado
pela mistura de soluções contendo íons de
cálcio na presença de uma base. É usado
extensivamente como fertilizante. O composto
foi primeiramente chamado de ortofosfato de
cálcio.
• SULFATO DE BÁRIO (BaSO4): substância densa, é
um agente radiopaco,ou seja, é capaz de barrar
os raios X. Apesar da grande toxicidade do íon
bário (Ba2+), aquele composto - por ser muito
insolúvel - pode ser ingerido sem risco de ser
absorvido pelo tubo digestivo. Devido a essas
propriedades, o sulfato de bário é usado como
contraste em exames radiológicos do tubo
digestivo. A sua produção pode ser feita a partir
da reação de carbonato de bário com ácido
sulfúrico. Entretanto, o produto obtido pode
conter carbonato de bário que não reagiu,
composto este solúvel em pH ácido, como o do
tubo digestivo e pode causar a morte de
pacientes submetidos a exames radiológicos,
logo deve passar por um processo posterior de
purificação.
• SULFATO DE CÁLCIO (CaSO4) : um composto
sólido branco. Ocorre na natureza como mineral
anidrita, que tem uma estrutura rômbica,
mudando para monoclínica a 200oC. Mais
vulgarmente é encontrado como composto
dihidratado, gesso, CaSO4.2H2O.
O sulfato de cálcio é parcialmente solúvel na
água e é uma causa da dureza permanente da
água. É usado na produção de certos tipos de
tintas, cerâmicas e papel. As formas que
ocorrem na natureza são usadas na produção
de ácido sulfúrico.
ÓXIDOS
• ÓXIDO DE CÁLCIO : óxido de cálcio ou cal viva
ou virgem, um composto sólido branco, CaO
que se forma pela decomposição térmica de
carbonato
de
cálcio,
CaCO3.
O óxido de cálcio é usado para produzir
hidróxido de cálcio, como base barata para o
tratamento de solos ácidos, e na metalurgia
extrativa para produzir escória contendo as
impurezas (especialmente areia) presentes nos
minérios de metais.
• ÓXIDO DE ALUMÍNIO : também chamado
alumina, ou coríndon quando cristalizado. É um
importante material refratário e tem emprego
como abrasivo (dureza 9). Cristalizado, constitui
pedras preciosas como a safira (com cromo) e o
rubi ( com titânio e ferro). O Al2O3.2H2O constitui
a bauxita principal minério do alumínio.