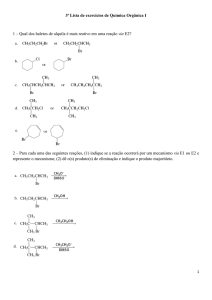
FUNÇÕES
QUÍMICAS
Definição: substâncias com propriedades
químicas semelhantes.
Classificação Geral:
Funções Inorgânicas
Funções Orgânicas
Jura/06
INTRODUÇÃO
Condutibilidade das Soluções:
As experiências do Químico Arrhenius.
NaCl +
H 2O
Solução eletrolítica
açucar + H2O
Solução não eletrolítica
Jura/06
FUNÇÕES
INORGÂNICAS
CLASSIFICAÇÃO:
ÁCIDOS
ÓXIDOS
HIDRETOS
SAIS
BASES
Jura/06
Conceitos de Arrhenius:
Ácidos, Hidretos e Bases
Ácidos: substâncias que em meio aquoso se
ionizam originando apenas cátions H+ (H3O+).
Ex.: HCl
aq
H+ + Cl-
• Bases: Compostos iônicos que em meio aquoso se
dissociam liberando exclusivamente ânions OH-.
Ex.: NaOH aq
Na+ + OHJura/06
IONIZAÇÃO E DISSOCIAÇÃO
HClO4
H2O
H2O
H2SO3
H3PO4
H2O
Ca(OH)2
AgOH
NH4OH
H2O
H2O
H2O
EXCEÇÕES:
H3PO3
H3PO2
H+ + ClO4-1
2H+ + SO3-2
3H+ + PO4-3
Ca2+ + 2OHAg+ + OHNH4+ + OHH2O
H2O
2H+ + HPO3-2
H+ + H2PO2-1
Jura/06
Jura/06
CLASSIFICAÇÃO DOS ÁCIDOS
1) Nº DE ELEMENTOS
Binários: H2S, HCl, HF ...
Ternários: HCN, HNO3, H3PO4 ...
Quaternários: H4Fe(CN)6, HOCN ...
2) PRESENÇA DE OXIGÊNIO
Oxiácidos: HNO2, H3PO4, H2SO4 ...
Hidrácidos: HBr, HCN, H2S ...
3) Nº DE HIDROGÊNIOS IONIZÁVEIS (H+)
Monoácidos: HF, HNO3, HCN, ... *H3PO2
Diácidos: H2S, H2CO3, ... *H3PO3
Triácidos: H3PO4, H3BO3, H3BO3 ...
Tetrácidos: H4Fe(CN)6, H4SiO4 ...
* Exceções
4) GRAU DE IONIZAÇÃO (FORÇA) - α
a) hidrácidos
Fortes: HCl, HBr e HI (somente)
Moderado: HF apenas
Fracos: Os demais
b) oxiácidos
Faz-se nº de Oxig – nº de H+, se diferença for:
0 ácido fraco
1 ácido moderado
2 ou + ácido forte
Exemplos:
H3BO3
H2SO3
H2SO4
HClO4
3 – 3 =0
3 – 2 =1
4 – 2 =2
4 – 1 =3
ácido fraco
ácido moderado
ácido forte
ácido forte
*H3PO3 3 – 2 =1 ácido moderado
*H3PO2 2 – 1 =1 ácido moderado
Jura/06
CLASSIFICAÇÃO DAS BASES
1) Nº DE HIDROXILAS (OH-)
Monobases: NaOH, AgOH, NH4OH ...
Dibases: Ca(OH)2, Zn(OH)2, Fe(OH)2 ...
Tribases: Al(OH)3, Fe(OH)3, Ni(OH)3 ...
Tetrabases: Pb(OH)4, Mn(OH)4, Sn(OH)4 ...
2) SOLUBILIDADE EM ÁGUA
Solúveis: dos metais alcalinos (NaOH, LiOH ...) e amônio (NH4OH).
Pouco solúveis: dos metais alc-terrosos – Ca(OH)2, Sr(OH)2 ...
Insolúveis: Todas as demais.
Jura/06
3) GRAU DE DISSOCIAÇÃO (FORÇA) - α
Fortes: Formadas de por metais alcalinos e alc.terrosos.
KOH, LiOH, Ca(OH)2, Mg(OH)2 ...
Fracas: Todas as demais.
AgOH, NH4OH, Fe(OH)2, Al(OH)3 ...
4) VOLATILIDADE (facilidade em evaporar = PE baixo)
Volátil: Somente NH4OH.
Fixas:
Todas as demais.
AgOH, NaOH, Fe(OH)2, Al(OH)3 ...
Jura/06
APLICAÇÕES DE ÁCIDOS E BASES
HF
H2S
HCl
Corroer e gravar vidros.
Putrefação (decomposição) de matéria orgânica.
Comercialmente conhecido como ácido muriático;
Componente do suco gástrico;
Limpeza de pisos e chapas metálicas.
HCN
Gás letal;
Em condenados à morte.
CH3COOH
Principal componente do vinagre ( tempero).
H2CO3
Gás de refrigerantes e água mineral.
H2SO4
Presente em bateria de automóveis;
Fabricação de fertilizantes.
Jura/06
Estabilizante de refrigerantes do tipo cola;
H3PO4
Fabricação de fertilizantes (superfosfatos).
HNO3
Fabricação de salitre para explosivos como o TNT;
Fabricação de fertilizantes.
Ca(OH)2
Mg(OH)2
Conhecido como “cal apagada ” ou “cal extinta”;
Em pinturas de meios-fios, paredes e muros (caiação).
Princípio ativo do leite de magnésia;
Usado como laxante e antiácido estomacal.
NaOH
NH4OH
Conhecido como soda cáustica;
Usado na fabricação de sabão e desentupimentos de tubulações.
Conhecido como amoníaco;
Em alguns produtos de limpeza e tintura de cabelos;
Jura/06