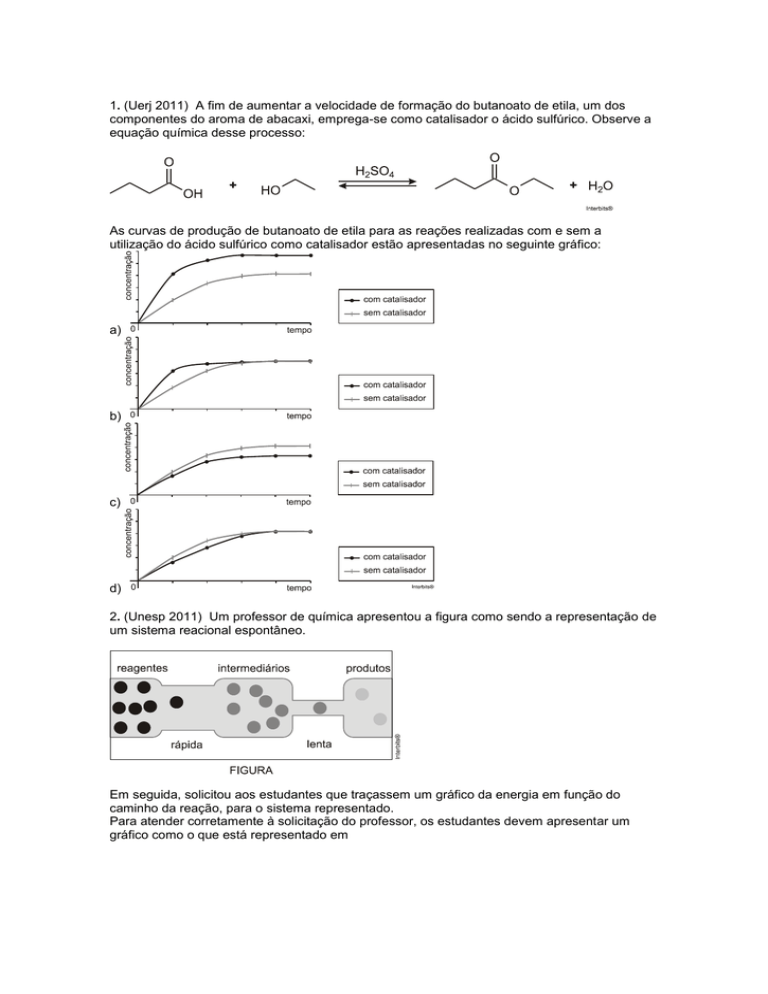
1. (Uerj 2011) A fim de aumentar a velocidade de formação do butanoato de etila, um dos
componentes do aroma de abacaxi, emprega-se como catalisador o ácido sulfúrico. Observe a
equação química desse processo:
As curvas de produção de butanoato de etila para as reações realizadas com e sem a
utilização do ácido sulfúrico como catalisador estão apresentadas no seguinte gráfico:
a)
b)
c)
d)
2. (Unesp 2011) Um professor de química apresentou a figura como sendo a representação de
um sistema reacional espontâneo.
Em seguida, solicitou aos estudantes que traçassem um gráfico da energia em função do
caminho da reação, para o sistema representado.
Para atender corretamente à solicitação do professor, os estudantes devem apresentar um
gráfico como o que está representado em
a)
b)
c)
d)
e)
3. (Ita 2011) A figura mostra o perfil reacional da decomposição de um composto X por dois
caminhos reacionais diferentes, I e II. Baseado nas informações apresentadas nessa figura,
assinale a opção errada.
a) O caminho reacional II envolve duas etapas.
b) A quantidade de energia liberada pelo caminho reacional I é igual a do caminho reacional II.
c) O composto K é um intermediário no processo reacional pelo caminho II.
d) O caminho reacional I mostra que a decomposição de X é de primeira ordem.
e) O caminho reacional II refere-se à reação catalisada.
4. (Uesc 2011) Um palito de fósforo pode se acender, ao ser atritado ligeiramente sobre uma
superfície áspera, como uma lixa das caixas de fósforos, e entrar em combustão com emissão
de luz e de calor.
Uma análise dessas observações permite afirmar corretamente:
a) A reação de combustão do palito de fósforo é espontânea porque possui energia de ativação
igual a zero.
b) A reação química mais rápida, entre duas reações, é aquela que apresenta menor energia
de ativação.
c) A reação de combustão do palito de fósforo é endotérmica.
d) A energia de ativação deve ser muito grande para que a combustão do palito de fósforo
ocorra.
e) O palito de fósforo só acende se a energia fornecida pelo atrito for menor quer a energia de
ativação.
5. (Aman 2011) Considere a equação balanceada:
4 NH3 5 O2 4 NO 6 H2O
Admita a variação de concentração em mol por litro mol L1 do monóxido de nitrogênio (NO)
em função do tempo em segundos (s), conforme os dados, da tabela abaixo:
[NO] mol L1
Tempo (s)
0
0,15
0,25
0,31
0,34
0
180
360
540
720
A velocidade média, em função do monóxido de nitrogênio (NO), e a velocidade média da
reação acima representada, no intervalo de tempo de 6 a 9 minutos (min), são,
respectivamente, em mol L1 min1 :
a) 2 102 e 5 103
b) 5 102 e 2 102
c) 3 102 e 2 102
d) 2 102 e 2 103
e) 2 103 e 8 102
6. (Pucpr 2010) Compostos naturais são muito utilizados na denominada Medicina Naturalista.
Povos indígenas amazônicos há muito fazem uso da casca da Quina (Coutarea hexandra) para
extrair quinina, princípio ativo no tratamento da malária. Antigos relatos chineses também
fazem menção a uma substância, a artemisina, encontrada no arbusto Losna (Artemisia
absinthium), que também está relacionada ao tratamento da malária.
Em estudos sobre a cinética de degradação da quinina por ácido, foram verificadas as
seguintes velocidades em unidades arbitrárias:
Quinina
(mol L-1)
Ácido
(mol L-1)
Velocidade
(u.a.)
1,0 x 10-4
1,0 x 10-4
0,5 x 10-4
2,0 x 10-4
5,0 x 10-3
1,0 x 10-2
1,0 x 10-2
2,5 x 10-3
2,4 x 10-3
9,6 x 10-3
4,8 x 10-3
1,2 x 10-3
A partir desses dados, pode-se concluir que a lei de velocidade assume a forma
a) V = K [quinina]2
b) V = K
quinina2
ácido
c) V = K2 [quinina]2
d) V = K [quinina] [ácido]2
e) V = K
ácido2
quinina
7. (Ufrgs 2010) Considere a reação a seguir, que está ocorrendo a 556 K.
2HI (g) H2 (g) + I2 (g)
Essa reação tem a sua velocidade monitorada em função da concentração, resultando na
seguinte tabela.
[HI] (mol L-1)
0,01
0,02
Veloc. (mol L-1 s-1)
3,5 x 10-11
14 x 10-11
Nessas condições, o valor da constante cinética da reação, em L mol-1 s-1, é
a) 3,5 x 10-11.
b) 7,0 x 10-11.
c) 3,5 x 10-9.
d) 3,5 x 10-7.
e) 7,0 x 10-7.
8. (Ita 2010) Considere o seguinte mecanismo de reação genérica:
A4+ + B2+ → A3+ + B3+ (etapa lenta)
A4+ + B3+ → A3+ + B4+ (etapa rápida)
C+ + B4+ → C3+ + B2+ (etapa rápida)
Com relação a este mecanismo, assinale a opção ERRADA.
a) A reação global é representada pela equação C+ + 2 A4+ → C3+ + 2 A 3+.
b) B2+ é catalisador.
c) B3+ e B4+ são intermediários da reação.
d) A lei de velocidade é descrita pela equação v = k[C+][A4+].
e) A reação é de segunda ordem.
9. (Ita 2010) Um recipiente contendo gás hidrogênio (H2) é mantido à temperatura constante
de 0°C. Assumindo que, nessa condição, o H2 é um gás ideal e sabendo-se que a velocidade
média das moléculas desse gás, nessa temperatura, é de 1,85 x 103 m s–1, assinale a
alternativa CORRETA que apresenta o valor calculado da energia cinética média, em J, de
uma única molécula de H2.
a) 3,1 x 10–24
b) 5,7 x 10–24
c) 3,1 x 10–21
d) 5,7 x 10–21
e) 2,8 x 10–18
10. (Ita 2010) Assinale a opção que apresenta a afirmação CORRETA sobre uma reação
genérica de ordem zero em relação ao reagente X.
a) A velocidade inicial de X é maior que sua velocidade média.
b) A velocidade inicial de X varia com a concentração inicial de X.
c) A velocidade de consumo de X permanece constante durante a reação.
d) O gráfico do logaritmo natural de X versus o inverso do tempo é representado por uma reta.
e) O gráfico da concentração de X versus tempo é representado por uma curva exponencial
decrescente.
Gabarito:
Resposta da questão 1:
[B]
Com catalisador a velocidade da reação direta aumenta, consequentemente, a concentração
de butanoato de etila também, até atingir um valor constante.
Resposta da questão 2:
[D]
De acordo com a figura temos duas etapas de reação, uma rápida (energia de ativação menor)
e uma lenta (energia de ativação maior). O gráfico que melhor explica o processo é:
Resposta da questão 3:
[D]
De acordo com a figura o caminho reacional I ocorre em uma única etapa e o caminho
reacional II ocorre em duas etapas. Ambos são exotérmicos, pois a entalpia dos produtos é
menor do que a dos reagentes.
Como o caminho reacional I envolve uma única etapa, podemos concluir que:
2X 2T + Z
Então,
v = k[X]2 (reação de segunda ordem)
Resposta da questão 4:
[B]
Análise das alternativas:
a) Incorreta: a reação de combustão do palito de fósforo não é espontânea, pois o palito
acende ao ser atritado sobre uma superfície áspera.
b) Correta: a reação química mais rápida, entre duas reações, é aquela que apresenta menor
energia de ativação.
c) Incorreta: a reação de combustão do palito de fósforo é exotérmica.
d) Incorreta: a energia de ativação não deve ser muito grande para que a combustão do palito
de fósforo ocorra.
e) Incorreta: o palito de fósforo só acende se a energia fornecida pelo atrito for igual ou maior
do que a energia de ativação.
Resposta da questão 5:
[A]
Teremos:
[NO] mol L1
Tempo (min)
vNO
0
0,15
0,25
0,31
0,34
0
3
6
9
12
(0,31 0,25) mol.L1 0,06 mol.L1
0,02 mol.L1.min1
(9 6) min
3 min
vNO 2,0 102 mol.L1.min1
4 NH3 5 O2 4 NO 6 H2O
v
2,0 102
vmédia NO
0,5 102 mol.L1.min1
4
4
vmédia 5,0 103 mol.L1.min1
Resposta da questão 6:
[D]
A partir da análise da segunda e da terceira linha da tabela (de baixo para cima), teremos:
Quinina
(mol L-1)
Ácido
(mol L-1)
Velocidade
(u.a.)
1,0 x 10-4 (dobrou)
0,5 x 10-4
1,0 x 10-2 (constante)
1,0 x 10-2 (constante)
9,6 x 10-3 (dobrou)
4,8 x 10-3
Como a concentração de quinina dobrou e a velocidade também, concluímos que o expoente
da quinina é 1.
A partir da análise da primeira e da segunda linha da tabela (de cima para baixo), teremos:
Quinina
(mol L-1)
Ácido
(mol L-1)
Velocidade
(u.a.)
1,0 x 10-4 (constante)
1,0 x 10-4 (constante)
0,5 x 10-2
1,0 x 10-2 (dobrou)
2,4 x 10-3
9,6 x 10-3 (quadruplicou)
Como a concentração do ácido dobrou e a velocidade quadruplicou, concluímos que o
expoente do ácido é 2.
Resposta da questão 7:
[D]
Podemos notar que a concentração de HI dobra e a velocidade quadruplica, então:
velocidade = k[HI]2, a partir da segunda linha da tabela, teremos:
14 x 10-11 = k(0,02)2
k=
14 x 1011
(2 x 10
2 2
3,5 x 107
)
Resposta da questão 8:
[D]
A partir das equações fornecidas, somando teremos a equação global:
A4+ + B2+ A3+ + B3+
A4+ + B3+ A3+ + B4+
C+ + B4+ C3+ + B2+
2A4+ + C+ 2A3+ + C3+
(lenta)
(rápida)
(rápida)
(global)
Como B2+ entra com o reagente A4+ e sai no final do processo com o produto C3+, podemos
deduzir que ele é um catalisador.
B3+ e B4+ são produtos intermediários, pois são fabricados em uma etapa e consumidos na
seguinte.
A lei da velocidade depende da etapa mais lenta e será dada por: v = k[A4+][B2+], concluímos
que a alternativa d está errada.
A reação é de segunda ordem, pois a soma dos expoentes da equação v = k[A4+]1[B2+]1 (1 + 1)
é igual a 2.
Resposta da questão 9:
[D]
No ensino médio devemos considerar apenas a energia cinética média translacional em uma
direção, que é dada pela seguinte expressão matemática:
E
1
mv2 (I)
2
Calculando a massa de uma molécula de hidrogênio, (H = 1,01; H2= 2,02), teremos:
2,02 g 6,02 x 1023 moléculas H2
m 1 molécula de H2
m = 0,335548 x 10-23 g
m = 3,36 x 10-24 g = 3,36 x 10-27 kg
Substituindo em (I), vem:
1
x 3,36 x 10-27 x(1,85 x 103)2
2
E = 5,7498 x 10-27 x 106 kg.m2.s-2
E = 5,75 x 10-21 J
E=
Resposta da questão 10:
[C]
Para uma reação de ordem zero em relação a um reagente X, teremos:
v = k[X]0 v = k
Consequentemente, a velocidade de consumo de X permanece constante durante a reação.