1
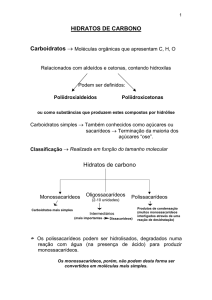
HIDRATOS DE CARBONO
Carboidratos → Moléculas orgânicas que apresentam C, H, O
Relacionados com aldeídos e cetonas, contendo hidroxilas
Podem ser definidos:
Poliidroxialdeídos
Poliidroxicetonas
ou como substâncias que produzem estes compostos por hidrólise
Carboidratos simples → Também conhecidos como açúcares ou
sacarídeos → Terminação da maioria dos
açúcares “ose”.
Classificação → Realizada em função do tamanho molecular
Hidratos de carbono
Monossacarídeos
Oligossacarídeos
(2-10 unidades)
Polissacarídeos
Carboidratos mais simples
Intermediários
(mais importantes
Dissacarídeos)
Produtos de condensação
(muitos monossacarídeos
interligados através de uma
reação de desidratação)
! Os polissacarídeos podem ser hidrolisados, degradados numa
reação com água (na presença de ácido) para produzir
monossacarídeos.
Os monossacarídeos, porém, não podem desta forma ser
convertidos em moléculas mais simples.
2
Carboidratos → Componentes mais abundantes das plantas, por absorção
da Esolar realizam a Fotossíntese.
Fótons da luz solar capturados
pela clorofila
Absorção de luz
Fotossíntese
Clorofila
Energia química
(Extenso sist. Conjugado)
Habilidade de absorver
a luz na região do visível.
Fica a disposição da planta
Pode ser usada para promover
as reações de oxi-redução.
Reduz o CO2 a carboidrato e oxida a água a oxigênio.
Equação geral da fotossíntese
x CO2 + y H2O + Esolar
Cx(H2O)y + x O2
! O metabolismo dos carboidratos também ocorre através de uma série
de reações catalisadas por enzimas, em que cada etapa liberadora de
energia é uma oxidação (ou conseqüência de uma oxidação)
HC Importantes reservatórios de Energia (Liberada quando as
plantas e animais os metabolizam a CO2 e H2O)
Cx(H2O)y + x O2
x CO2 + y H2O + E
ADP
+
Calor
Fosfato
Maior parte de energia
é convertida em uma nova
forma química.
inorgânico
ATP
Parte de energia perdida
Direcionamento
Processos que
Requerem energia
(Ex: Contração de um músculo,
síntese de uma macromolécula)
3
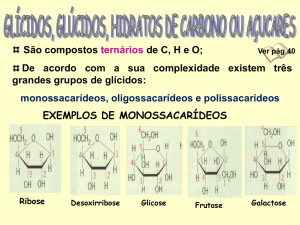
Classificação de monossacarídeos
(1) N° de átomos de C presentes na molécula
Monossacarídeos
(2) Presença de grupos aldeídicos ou cetônicos
Assim, um monossacarídeo contendo:
3 átomos de C (Triose)
Aldeídico (Aldose)
5 átomos de C (Pentose)
Cetônico (Cetose)
6 átomos de C (Hexose)
Classificações freqüentemente combinadas
Aldotriose
Cetopentose
-
Aldose com 3 átomos de C.
Monossacarídeo com 5 átomos
de carbono e um grupo cetônico.
O gliceraldeído, um dos mais
monossacarídeos é uma aldotriose.
simples
de
todos
os
No organismo é formado da degradação
de hexoses no tecido muscular.
Contém 3 átomos de carbono, um dos quais
é parte do grupo aldeídico.
Gliceraldeído
Cada um dos outros dois átomos de carbono
está ligado a um grupo hidroxila.
Os outros monossacarídeos maiores (tipo aldose)
derivados do gliceraldeído por alongamento da cadeia.
são
4
Monossacarídeos mais simples:
Gliceraldeído
(Contém 1 carbono quiral)
Diidroxiacetona
Dá origem às cetoses maiores
(+) Gliceraldeído
(-) Gliceraldeído
Enantiômeros
Início do século, um sistema de indicação estereoquímica foi
introduzido:
(Antes que as configurações absolutas de qualquer composto
orgânico fossem conhecidas)
(+) Gliceraldeído → D
(-) Gliceraldeído → L
! Referências configuracionais para todos os monossacarídeos
5
Se um monossacarídeo cujo carbono quiral de numeração mais
alta, possui a mesma configuração do D-gliceraldeído, ele é
designado como um açúcar D.
Se tiver a do L-gliceraldeído → um açúcar L.
Designações (D) e (L) não estão necessariamente relacionadas com as
rotações ópticas
D(+) ; D(-) ; L(+) ; L(-)
Monossacarídeos comuns na natureza → Forma D
(Configurações D ou L)
→ Grande importância biológica. Enzimas altamente
específicas reconhecem apenas 1 enantiômero)
Série de monossacarídeos (Fórmulas de Fischer)
6
(+) D-Glicose → Monossacarídeo mais abundante na natureza
Maior fonte de energia para a vida
Ex: No sangue (carboidrato encontrado em maior quantidade na corrente
sangüínea)
Concentração usual → 90 mg de glicose / 100 ml de sangue
A glicose pode ser administrada endovenosamente (5% isotônica)
(pacientes que não podem ingerir alimentos)
Diabetes mellitus – Quantidade de glicose acima do normal
Métodos usados p/det. de glicose no sangue (na urina)
Oxidação (Benedict ou Fehling)
Redução de íon Cu → Precipitado vermelho-laranja
Diferença de coloração indica a quantidade de glicose na urina
Testes modernos (específicos) → Reação catalisada por enzima
Glucose
Oxidase
D-Glicose + O2
D-glicuronato-δ-lactona + H2O2
Incolor
Peroxidase
Composto colorido
(Determinado espectroscopicamente)
D-Galactose → Encontrada nas glândulas mamárias
Junto com a glicose formam a lactose (Dissacarídeo)
Membranas cerebrais – “Cerebrose”
Substância dos grupos sangüíneos (Superfície externa
das hemácias e que determinam o
grupo sanguineo)
D-Frutose (Cetohexose) – Levulose
CH2OH
C=O
-
Açúcares das frutas. Mais hidrossolúvel e mais doce de todos.
-
Alimentação endovenosa (5 a 10%)
HO C H
H C OH
H C OH
CH2OH
! A D-galactose e a D-frutose são isômeros da D-glicose.
7
Fórmulas estruturais para os monossacarídeos
Fórmulas de Fischer → Cadeia aberta
Apesar de todas as propriedades serem explicadas em termos de cadeia
aberta, existem evidências que a estrutura em cadeia aberta encontra-se em
equilíbrio com duas formas cíclicas.
Nesta aldose, um dos
grupos hidroxila (carbono 5)
reage
com
o
grupo
aldeídico.
Como resultado, forma-se um
hemiacetal, e o grupo carbonila
não fica mais livre (hemiacetal
cíclico).
! Se o monossacarídeo
fosse uma cetose, iria-se
formar um hemicetal.
Dependendo da orientação
do grupo aldeídico, quando
o anel se fecha, podem ser
formados 2 hemiacetais
cíclicos.
Eles
diferem
apenas no arranjo em volta
do carbono 1 e são
designados α e β.
! Isômeros que diferem no carbono hemiacetálico → Anômeros
O átomo de carbono, que vem do grupo carbonila do aldeído, é
conhecido como carbono anomérico.
Quando um anômero é dissolvido em água, a outra forma logo aparece
Ela se forma por Mutarrotação (conversão dos anômeros α e β
através da forma aberta da molécula)
Forma cíclica α ↔ Forma aberta ↔ Forma cíclica β
Glicose (64% forma β e 36% na forma α em solução)
(forma aberta – Qde muito pequena. Mesmo assim → Análise clínica)
Como resultado deste processo, os anômeros α e β existem
em equilíbrio em solução.
8
Nem todos existem em equilíbrio com anéis hemiacetálicos de 6
carbonos, às vezes anéis de 5.
Sistema de nomenclatura baseado no n° de átomos de C.
α-D-glicopiranose
β -D-glicopiranose
Pirano
α -D-frutofuranose
β -D-frutofuranose
Furano
! Estes nomes são derivados dos heterocíclicos com oxigênio com
oxigênio no anel, pirano e furano.
Anel de 6 membros
Anel de 5 membros
______________________________________________
Reações de monossacarídeos
Oxidação
1) Reagentes de Benedict ou de Tollens
Ag(NH3)2+ OH-
Íon complexo de citrato cúprico
Complexos de prata
Oxidam e dão testes positivos para aldoses e cetoses
(Açúcares redutores)
Úteis para testes diagnóstico. (Não servem como reagentes sintéticos em
oxidações de carboidratos)
Sol. Alcalina (meio) → Reações complexas que levam a isomerizações e
fragmentações.
9
2) Água de bromo
Sol. Ligeiramente ácidas→Não sofrem isomerizações nem fragmentações.
Conversão de uma aldose em um ácido aldônico
A água de bromo oxida especificamente o anômero β.
As α-aldopiranoses demoram 250 vezes mais (provavelmente devido
à sua conversão no anômero β, seguida de oxidação)
3) Oxidação com ácido nítrico (diluído)
Agente oxidante mais forte que a água de bromo
Oxida tanto o grupo CHO como CH2OH terminais de uma aldose a
grupos COOH.
Os ácidos dicarboxílicos
gerados são conhecidos
como ácidos aldáricos.
10
4) Oxidação com periodato (HIO4)
Quebra oxidativa dos compostos poliidroxilados → A reação quebra as
ligações C-C e produz compostos carbonílicos (aldeídos, cetonas,
ácidos)
Glicerol
Rç processada em rendimento quantitativo. Serve para a identificação dos
produtos formados.
- Determinação do n° de moles de ácido periódico consumido na reação.
- Identificação dos produtos carbonílicos formados.
5) Redução de monossacarídeos
Aldoses e cetoses reduzidos para alditóis.
! A redução da D-glicose, por exemplo, produz, o D-glicitol.
11
Síntese de monossacarídeos (Kiliani – Fischer)
Hoje, o método para aumentar a cadeia de carbono de uma aldose
é chamada de síntese de Kiliani-Fischer.
12
Degradação de Ruff
! Da mesma maneira que a síntese de Kiliani-Fischer pode ser usada
para aumentar a cadeia de uma aldose (de 1 átomo de carbono), a
degradação de Ruff, pode ser usada para diminuir a cadeia de um
número semelhante.
Envolve:
(a) A oxidação da aldose a um ácido aldônico
(água e bromo)
(b) Descarboxilação oxidativa do ácido aldônico a uma
aldose inferior.
[H2O2 e Fe2(SO4)3]
_______________________________________________
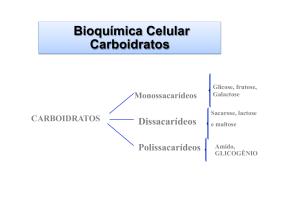
Dissacarídeos
Consistem de 2 unidades de monossacarídeos interligados por um
átomo de oxigênio.
Maltose → Consiste de 2 unidades de glicose
Uma molécula de H2O é
liberada para cada ligação
glicosídica formada.
O carbono anomêrico da
glicose β ainda existe como
hemiacetal.
Ligação glicosídica (α-1,4)
O glicosídeo final é uma
mistura das forma α e β.
Não ocorre em abundância na natureza (grãos em germinação)
Produto principal da hidrólise do amido (No nosso organismo, a maltose
é hidrolisada a glicose. A maltose é usada em “fórmulas” para alimentação de
crianças).
13
Celobiose
Igual à maltose, exceto na
configuração da ligação
glicosídica (β
β-1,4)
Lactose
Encontrado no leite humano e de outros mamíferos.
O leite humano tem cerca de 2 vezes mais lactose que o leite da vaca.
Açúcar redutor que se hidrolisa fornecendo glicose e galactose.
Enzima que está
presente nas crianças
e ativa em adultos
descendentes de
europeus nórdicos e
alguns outros grupos
étnicos.
Para digerir a lactose é necessária a enzima “lactase”.
A maioria dos adultos descendentes de povos orientais, africanos,
médio-orientais, indianos e mediterrânicos têm pouco da enzima e
mostram graus variáveis de “intolerância” à lactose.
Sacarose
Dissacarídeo mais comum (açúcar de mesa ou açúcar comum).
Encontrada em todas as plantas fotossintetizadoras.
Comercialmente (cana de açúcar ou beterraba)
Usado como padrão edulcorante
(α
α-1,2) → Ligação
glicosídica que envolve
2 carbonos anomêricos. Como resultado,
nenhum dos aneis
pode sofrer mutarrotação, e a sacarose não
tem formas α e β.
A hidrólise fornece glicose e frutose.
14
Polissacarídeos
Polímeros de condensação que geralmente
centenas de moléculas de monossacarídeos.
contêm
Pontes oxídicas (glicosídicas)
Pesos moleculares típicos – Milhares a milhões.
Três polissacarídeos mais importantes (polímeros da glicose)
Amido
Glicogênio
Celulose
Amido → Reserva alimentar das plantas.
Glicogênio → Reserva de carboidratos para os animais
Celulose → Material estrutural das plantas.
! Cada um destes polissacarídeos é especialmente adequado para a sua
função.
15
Amido
Grânulos microscópicos nas raízes, tubérculos e sementes das
plantas.
Milho, batata, trigo arroz – Mais importantes fontes comerciais
Aquecimento em água (inchamento) → Suspensão coloidal
Amilose
(10-20%)
Amilopectina
(80-90%)
Medidas físicas (constituída de mais de 1000 moléculas de
α-D-glicose 1→4)
Cadeias α-glicosídicas
Tendem a assumir um arranjo helicoidal (Forma compacta) Apesar
do alto PM
16
Amilopectina
Estrutura semelhante com ramificações. (Lig. 1→6) em intervalos
de 24-30 unidades de glicose. PM ∼1 a 6 milhões.
Amilopectina
Alto grau de
ramificação,
conhecido como
polissacarídeo
“dentrítico”.
17
Amido (plantas armazenam a energia obtida da luz solar)
Digerido(homens e animais) Decomposto em fragmentos menores
Dextrinas
Hidrólise
Maltose
Hidrólise
Glicose
! Quando o pão é torrado, parte do amido é convertido em dextrinas,
dando-lhe um sabor e texturas diferentes.
No processo comercial para a obtenção de dextrinas, o amido é altamente
degradado, convertendo-se em glicose. No resfriamento e neutralização, ocorre
um rearranjo de moléculas (formam-se macromoléculas com ramificações
curtas).
Dextrinas podem formar pastas pegajosas (usadas em mucilagens)
Ex: Verso dos selos dos correios
Cerca de 40% (Formulações adesivas)
Outros grandes consumidores
(Indústrias de papel, têxtil, farmacêutica e alimentícia)
Ex. Formulações alimentares infantis (dextrinas, maltose e leite)
Facilmente digeridas.
(Impedem que o leite forme grandes e pesados coágulos no
estômago das crianças)
18
Glicogênio
“Amido animal”
Estruturalmente semelhante à amilopectina do amido.
Moléculas muito maiores, pesos moleculares de milhões.
Muito mais ramificadas (8-12 resíduos de glicose)
Polissacarídeo de reserva dos animais.
Ocorre na maioria dos tecidos, mas é principalmente encontrado
no fígado e no tecido muscular esquelético.
Usado quando necessário como fonte de energia.
Glicogênio (Glicogênese)
Parte
armazenada
(Glicose
Glicose
(Após digestão)
na corrente sanguínea)
Hidrolisado a glicose
(Glicogenólise)
! O glicogênio é bem adaptado para armazenamento.
Tamanho grande → Impede difusão através das membranas celulares
(permanece dentro das células)
Milhares de moléculas numa só (não gera problemas osmóticos)
! Se tantas moléculas de glicose estivessem presentes na célula como
“moléculas individuais”, a pressão osmótica dentro da célula seria enorme,
tão grande, que fatalmente a célula se romperia.
A amilopectina (plantas) é menos ramificada que o glicogênio
pois a taxa metabólica é mais baixa do que a dos animais.
! Não requer despreendimentos repentinos de energia.
Os animais também armazenam energia sob a forma de gorduras
(triacilgliceróis) → Energia a longo prazo (maior energia)
19
Celulose
Substância orgânica mais abundante na natureza. (paredes
celulares de proteção das plantas como seu principal componente
estrutural)
Ligações glicosídicas β(1→4)
Cadeias essencialmente lineares.
Arranjo linear β → OH para fora da cadeia.
Quando 2 ou mais
cadeias de celulose
entram em contato,
os grupos hidroxila
encontram-se
em
posição ideal para
unir
as
cadeias
formando ligações de
hidrogênio
Ligações hidrogênio → Tornam o polímero fibroso (Insolúvel e rígido)
Ideal como material de parede celular das plantas.
Não pode ser digerido pelo organismo humano
Somente cupim, vaca e outros ruminantes contêm microorganismos
que secretam a enzima necessária.
Algodão (quase que inteiramente celulose). Madeira (40-50%)
Para outros produtos comerciais (necessitam tratamento químico)
Para a introdução de substituintes
Carboximetilcelulose, hidroxipropilcelulose, metilcelulose, nitrato de celulose,
etc → Derivados mais facilmente solúveis.
20
Outros polissacarídeos
Quitina
-
Polissacarídeo linear existente no exoesqueleto de milhares de
artrópodos, crustáceos e insetos.
-
Provavelmente o segundo polissacarídeo em abundância perto
da celulose.
Características estruturais similares à celulose
(Diferença no grupo acetamida substituinte no C2)
Forma longas fibras (Insolúvel em água e soluções alcalinas)
Apropriado para servir em funções estruturais.
! Não pode ser digerido por animais vertebrados
______________________________________________________
Hidrocolóides
Biopolímeros hidrossolúveis.
Exercem papel importante no controle da textura e estabilização de
muitos produtos industrializados.
Agentes espessantes, estabilizantes e gelificantes.
Capacidade de modificar o comportamento da água presente nesses
sistemas, prevenindo ou retardando uma série de fenômenos físicos, como a
sedimentação de partículas sólidas, cristalização ou evaporação da água,
agregação de partículas e a sinérese de sistemas gelificados.
21
Podem ser obtidos de diversas fontes.
As principais indústrias que se beneficiam são a alimentícia,
farmacêutica, de cosméticos, petrolífera, têxtil, tintas, entre outras.
Origem
Exsudatos de plantas
Extratos de algas
(Vermelhas, marrons)
Extratos de sementes
(Leguminosas)
Exemplo
Goma arábica, goma caraia,
goma Ghatti
Agar-agar, carragenanas,
alginatos
Goma guar, goma alfarroba
(LBG), goma tara
Extratos de plantas terrestre Pectinas
(Cítricos,maçã, etc)
Biossintéticas (Microorganismos) Dextrana, xantana, gelana
Extratos de algas – Alginatos (algas pardas) – Ácidos manurônico e
gulurônico
Gelificante (com íons cálcio)
Carragenanas (algas vermelhas) – Polissacarídeos
mais ou menos sulfatados
Kapa, Iota, Lambda (usados em sistemas lácteos)
Extratos de sementes – Encontrados como materiais de reserva
alimentar em sementes de árvores
leguminosas (galactomananas)
Usos: Espessantes
Extratos de plantas terrestres – Encontram-se associados à
celulose sob forma de compostos pécticos.
Essencialmente Ácidos α-D-galacturônicos, parcialmente esterificados
Conferem às células vegetais a capacidade de absorver água em grande
quantidade.
Dependendo do grau de metoxilação: HMP (alto grau de metoxilação: 80%)
LMP (baixo grau de metoxilação: 20-50%)
Biossintéticas – A mais importante é a goma xantana (fermentação da
bactéria Xantomonas campestris)
Características: Alta estabilidade térmica, a sais, ácidos, bases, etc.