4
Cardiopatia congênita
Introdução
A cardiopatia congênita é um termo genérico
utilizado para descrever anormalidades do coração e
dos grandes vasos presentes ao nascimento. A maior
parte desses distúrbios surge em decorrência da
embriogênese defeituosa durante o período
gestacional que se estende da terceira até a oitava
semana, quando ocorre desenvolvimento das
principais estruturas cardiovasculares. As anomalias
mais graves podem ser incompatíveis com a
sobrevida intra-uterina; entretanto, a maioria está
associada a nascimentos vivos. Alguns podem
produzir manifestações logo após o nascimento,
acompanhando quase sempre a mudança dos
padrões circulatórios fetais para o padrão pós-natal
(com utilização dos pulmões em lugar da placenta
para a oxigenação). Todavia, outras anomalias não se
tornam necessariamente evidentes até a idade adulta
(p. Ex., coarctação de aorta ou defeito septal atrial
[DSA]). Imensos progressos foram feitos no
diagnóstico e no tratamento dos defeitos cardíacos
congênitos, permitindo a sobrevida prolongada de
muitas crianças. Na atualidade, a maioria das
anomalias são acessíveis ao reparo cirúrgico, com
bons resultados.
A população de adultos com cardiopatia
congênita está crescendo rapidamente. Essa
população inclui aqueles que nunca foram submetidos
a cirurgia cardíaca, os que foram submetidos a
cirurgia cardíaca reparadora e não necessitam mais
de intervenção cirúrgica e aqueles que efetuaram uma
cirurgia incompleta ou paliativa. A compreensão do
prognóstico e dos possíveis problemas requer a
consideração da malformação congênita subjacente,
natureza e efeitos das intervenções terapêuticas e
lesões residuais e seqüelas pós-operatórias ou pósintervenção. Mais importantes são os riscos de
endocardite, dificuldades específicas devido à
hiperviscosidade , riscos maternos e focais associados
à gravidez em mulheres com doença congênita
cianótica, e patologia residual após cirurgia reparadora
(incluindo valvas anormais; próteses de valvas,
enxerto e condutos e risco aumentado de arritmias).
Etiologia e patogenia.
Os fatores genéticos desempenham um
papel óbvio em alguns casos, conforme evidenciado
pela ocorrência de malformações familiares de
cardiopatia congênita e por associações bem definidas
entre certas anormalidades cromossômicas (p. ex.,
trissomias 13, 15, 18, 21 e síndrome de Turner) e
malformações cardíacas congênitas. Os fatores
ambientais, como rubéola congênita, são
responsáveis por alguns casos. Entretanto, de modo
global, as influências genéticas ou ambientais óbvias
só podem ser identificadas em cerca de 10% dos
casos de cardiopatia congênita, embora a
compreensão de prováveis ligações genéticas esteja
se ampliando.
Manifestações clínicas
As
anomalias
estruturais
variadas
observadas na cardiopatia congênita distribuem-se
primariamente em três categorias principais:
• Malformações que causam derivação da
esquerda para a direita;
• Malformações que causam derivação da
direita para a esquerda;
• Malformações que causam obstrução.
Uma derivação (shunt) é uma comunicação
anormal entre as câmaras cardíacas ou entre os
vasos sanguíneos. Os canais anormais permitem o
fluxo de sangue da esquerda para a direita ou no
sentido contrário, dependendo das relações de
pressão. Quando o sangue do lado direito do coração
penetra no lado esquerdo (derivação da direita para a
esquerda), ocorre uma coloração azulada da pele e
das mucosas (cianose), devido à diminuição do fluxo
sanguíneo pulmonar e à entrada de sangue pouco
oxigenado na circulação sistêmica (denominada
cardiopatia congênita cianótica, cujos exemplos mais
importantes são a tetralogia de Fallot, a transposição
das grandes artérias, a persistência do tronco arterial
e a atresia tricúspide). Além disso, nas derivações da
direita para a esquerda, êmbolos moles ou sépticos,
que surgem nas veias periféricas, podem desviar-se
da ação de filtração normal dos pulmões e, assim,
penetrar diretamente na circulação sistêmica (embolia
paradoxal); as conseqüências potenciais disso
incluem infarto e abscesso cerebrais. Os achados
clínicos freqüentemente associados a cianose
prolongada e grave incluem baqueteamento das
pontas dos dedos das mãos e dos pés
(osteoartropatia hipertrófica) e policitemia.
Em contraste, as derivações da esquerda
para a direita, como DSA, defeito septal ventricular
(DSV) e persistência do canal arterial (PCA)
aumentam o fluxo sanguíneo pulmonar e, inicialmente,
não estão associadas a cianose. Expõem a circulação
pulmonar pós-natal normalmente de baixa pressão e
de baixa resistência a um aumento de pressão ou
volume (ou ambos), podendo resultar em hipertensão
pulmonar, seguida de hipertrofia ventricular direita e,
potencialmente, falência. As derivações associadas a
um aumento do fluxo sanguíneo pulmonar incluem os
DSA, enquanto as derivações associadas a um
aumento do fluxo sanguíneo e da pressão pulmonares
incluem os DSV e a PCA. As artérias pulmonares
musculares (com diâmetro < 1mm) respondem
inicialmente à pressão aumentada através de
hipertrofia da média e vasoconstrição, o quem
mantém as pressões venosa e capilar pulmonares
distais relativamente normais, ajudando a impedir a
ocorrência de edema pulmonar. Entretanto, a
vasoconstrição arterial pulmonar prolongada estimula
o desenvolvimento de lesões obstrutivas irreversíveis
da íntima. Por fim, a resistência vascular pulmonar e
as pressões aumentam para níveis sistêmicos,
revertendo, assim, a derivação no sentido da direita
para a esquerda com sangue não-oxigenado na
circulação sistêmica (cardiopatia cianótica tardia ou
síndrome de Eisenmnerger).
Uma vez instalada a hipertensão pulmonar
irreversível significativa, os defeitos estruturais da
cardiopatia congênita são considerados irreparáveis.
As alterações vasculares pulmonares secundárias
podem finalmente levar à morte do paciente. Isso
constitui a base racional da intervenção cirúrgica ou
não-cirúrgica precoce.
Algumas anomalias de desenvolvimento do
coração produzem obstruções do fluxo, devido a
estreitamentos anormais das câmaras cardíacas, das
valvas ou dos vasos sanguíneos. Dentre os exemplos,
destacam-se as estenoses valvares (obstruções
parciais) ou atresias (oclusões completas),
denominadas cardiopatias congênitas obstrutivas (p.
ex., coarctação de aorta, estenose valvar aórtica e
estenose valvar pulmonar). Em alguns distúrbios (p.
ex., tetralogia de Fallot), a presença de obstrução
(estenose pulmonar) está associada a uma derivação
(da direita para a esquerda através da DSV)
Na cardiopatia congênita, a hemodinâmica
alterada geralmente provoca dilatação ou hipertrofia
cardíaca (ou ambas). Em contraste, a redução no
volume e na massa muscular de uma câmara cardíaca
é denominada hipoplasia, quando ocorre antes do
nascimento, e atrofia quando se desenvolve após o
nascimento.
Derivações da Esquerda para a Direita –
Cianose Tardia
As derivações da esquerda para a direita
mais comumente encontradas incluem DSA, DSV,
PCA e defeitos septais AV (DSAV).
1. DEFEITO DO SEPTO ATRIAL
O DSA é uma abertura anormal, no septo
atrial, que permite a comunicação do sangue entre os
átrios esquerdo e direito (não devendo ser confundida
com a persistência do forame oval, presente em até
um terço dos indivíduos normais, e geralmente não
permite a ocorrência de fluxo, a não ser que haja
elevação das pressões atriais direitas). O DSA
constitui a anomalia cardíaca congênita mais comum,
geralmente permanecendo assintomática até a idade
adulta.
Embriologia
Começando ao final da quarta semana, o
átrio primitivo é dividido nos átrios direito e esquerdo
pela formação e subseqüente modificação e fusão de
dois septos, o septum primum e o septum secundum.
O septum primum, uma membrana delgada
em forma de crescente, cresce do teto do átrio
primitivo, em direção aos coxins endocárdicos, que
estão se fundindo, e divide parcialmente o átrio
comum em metades direta e esquerda. Ao crescer,
este septo, semelhante a uma cortina, forma uma
grande abertura – o forâmen primum (ostium
primum) – entre sua borda livre, em forma de
crescente, e os coxins endocárdicos. O foramen
primum torna-se progressivamente menor e
desaparece quando o septum primum se funde com
os coxins endocárdicos fundidos, formando o septo
AV primitivo. Antes de o foramen primum
desaparecer, aparecem perfurações – produzidas por
morte celular programada – na parte central do
septum primum. Quando o septo se funde com os
coxins endocárdicos já fundidos, estas perfurações
coalescem, formando outra abertura, o foramen
secundum (ostium secundum). Ao mesmo tempo, a
borda livre do septum primum se funde com o lado
esquerdo dos coxins endocárdicos fundidos,
obliterando o foramen primum. O foramen secundum
assegura um fluxo continuo de sangue oxigenado do
átrio direito para o esquerdo.
O septum secundum, uma membrana
muscular em forma de crescente, cresce da parede
ventrocefálica do átrio, imediatamente à direita do
septum primum. Com o crescimento deste septo
espesso, durante a quinta e a sexta semanas, ele se
superpõe, gradativamente, ao foramen secundum do
septum primum. o septum secundum forma um
tabique incompleto entre os átrios; conseqüentemente
forma-se uma perfuração ovalada – o forâmen oval.
A parte cefálica do septum primum, inicialmente presa
ao teto do átrio esquerdo, desaparece gradativamente.
A parte remanescente do septum primum, presa aos
coxins endocárdicos, forma a válvula do forâmen
oval, em forma de aba.
Antes do nascimento, o forâmen oval permite
que a maior parte do sangue oxigenado, que entra no
átrio direito vindo da veia cava inferior, passe para o
átrio esquerdo e impede a passagem do sangue na
direção oposta, porque o septum primum se fecha
contra o septum secundum relativamente rígido.
Após o nascimento, normalmente o forâmen
oval se fecha e a válvula do forâmen oval se funde co
o septum primum. como resultado, o septo interatrial
torna-se um tabique completo entre os átrios.
Morfologia
Os três principais tipos de DSA, classificados
de acordo com a sua localização no septo, são o
secundum, primum e do seio venoso. O DSA
secundum, responsável por cerca de 90% de todos os
casos de DSA, consiste num defeito localizado na
fossa oval, que resulta de uma deficiência ou
fenestração da fossa oval próximo ao septo médio. A
maioria é isolada (i.e., não associada a outras
anomalias). Quando o DSA está associado a outro
defeito, como tetralogia de Fallot, o outro defeito
costuma ser hemodinamicamente dominante. A
abertura atrial pode ser de qualquer tamanho,
podendo ser única, múltipla ou fenestrada. As
anomalias do tipo primum (5% dos DSA) ocorre numa
localização adjacente às valvas AV e, em geral, estão
associadas a um folheto mitral anterior fendido. Essa
combinação é conhecida como DSAV parcial. Os
defeitos do seio venoso (5%) localizam-se próximo à
entrada da veia cava superior. Em geral, são
acompanhados de conexões anômalas das veias
pulmonares direitas com a veia cava superior ou com
o átrio direito.
Os DSA resultam em derivação da esquerda
para a direita, em grande parte porque a resistência
vascular pulmonar é consideravelmente menor do que
a resistência vascular sistêmica, e visto que a
complacência do ventrículo direito é muito maior que a
do esquerdo. O fluxo sanguíneo pulmonar pode ser
duas a quatro vezes o normal. Embora alguns
neonatos possam estar em insuficiência cardíaca
congestiva profunda, os DSA isolados são, em sua
maioria, bem tolerados e, em geral, só se tornam
sintomáticos a partir dos 30 anos de idade. Com
freqüência, verifica-se a presença do sopro devido a
um fluxo excessivo através da valva pulmonar.
Posteriormente, pode haver desenvolvimento de
hipertrofia de volume do átrio e ventrículo direitos.
Verifica-se o desenvolvimento de hipertensão
pulmonar irreversível em menos de 10% dos
indivíduos com DSA isolado não-operado. O
fechamento cirúrgico de um DSA tem por objetivo
reverter as anormalidades hemodinâmicas e prevenir
as complicações incluindo insuficiência cardíaca,
embolização paradoxal e doença vascular pulmonar
irreversível. A taxa de mortalidade é baixa, e a
sobrevida pós-operatória é comparável àquela de uma
população normal.
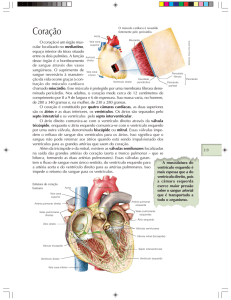
Anatomia Cirúrgica do Átrio direito
Embora o átrio direito seja morfologicamente
moldado como câmara única, ele é formado por dois
componentes: o “sinus venarum” (às vezes
mencionado como corpo do átrio) e o apêndice atrial
direito (auriculeta). O retorno venoso sistêmico flui
para o átrio de direções opostas através da veia cava
superior e inferior para o “sinus venarum”. Esta área
de paredes lisas é a porção mais posterior do átrio
direto e distende-se entre os orifícios das veias cavas.
Do ponto visual do cirurgião olhando para baixo no
átrio direito, o “sinus venarum” é mais ou menos
horizontal com a veia cava superior entrando pela
esquerda e a veia cava inferior entrando (ligada pela
válvula de Eustáquio) pela direita.
Logo imediatamente abaixo do orifício da veia
cava superior origina-se um feixe muscular, a crista
terminal, que se torna proeminente à medida que
circunda o orifício da veia cava superior para a parede
lateral direita do átrio e prossegue inferiormente em
direção à veia cava inferior, formando assim, os limites
entre o “sinus venarum” e a auriculeta direita. Este
feixe muscular é evidenciado por fora do átrio através
de um sulco, o sulco terminal. Estendendo-se pelo sub
epicárdio no sulco terminal, logo abaixo na entrada da
veia cava superior encontra-se no nódulo sinoatrial, o
qual pode ser vulnerável à lesão de várias incisões
cirúrgicas e canulações comumente realizadas no
átrio direito. O restante do átrio direito é formado pela
auriculeta, que se inicia na crista terminal e estendese para diante (para cima, da perspectiva do cirurgião)
para circundar a válvula tricúspide e formar uma
câmara expandida.
Ao contrário das paredes lisas do corpo atrial,
a parede lateral da auriculeta é rugosa com múltiplas
faixas de músculo, os “músculos pectinati”. Estas
faixas originam-se da crista terminal e passam para
cima à parte mais anterior do átrio. Funcionalmente,
elas suprem o átrio direito com suficiente capacidade
de bombeamento para propelir o influxo venoso
através da válvula tricúspide para o ventrículo direito.
Logo acima do corpo atrial no centro da
parede medial, encontra-se a fossa oval, uma
depressão em forma de ferradura ou elíptica. O
verdadeiro septo interatrial consiste da fossa oval com
contribuições variáveis dos feixes musculares límbicos
superior, anterior e inferior que a circundam. A raiz
aórtica esconde-se por trás da parede atrial ânteromedial entre a fossa oval e o término da auriculeta
direita acentuadamente trabeculada. Os segmentos
dos seios de Valsalva direito e não coronariano
encontram-se em intima aposição à parede atrial
nesta área. Suas localizações podem manifestar-se
através da saliência aórtica, a qual abaúla acima e
ligeiramente à esquerda da fossa oval. Aqui, a válvula
aórtica pode ser mais claramente visualizada se a sua
continuidade através do corpo fibroso central, com o
anel adjacente da válvula tricúspide é levada em
consideração.
Também invisível ao cirurgião é a artéria do
nódulo sinoatrial, a qual pode percorrer através desta
área. Embora imprevisível sua origem e localização
precisa, ela assume um trajeto variável superior para o
ângulo cavoatrial superior e nódulo sinusal.
A válvula tricúspide localiza-se de modo
ântero-inferior no átrio direito, onde se abre
amplamente no ventrículo direito. O anel da válvula
tricúspide cruza sobre o septo membranoso, dividindose nos segmentos atrioventricular e interventricular. O
septo membranoso, ou fibroso é uma continuação do
corpo fibroso central, através do qual encontram-se
conectadas as válvulas tricúspide, mitral e aórtica.
Logo abaixo do setor superior ou atrioventricular do
septo membranoso encontra-se o oculto nódulo
atrioventricular. Ele situa-se no ápice do triangulo de
Koch, cujos limites são o anel do folheto septal da
válvula tricúspide, o tendão de Todaro (indo
intramiocardicamente, do corpo fibroso central à
válvula de Eustáquio da veia cava inferior), e sua base
o seio coronariano. O tecido de condução passa do
nódulo atrioventricular como feixe de His, abaixo do
septo membranoso e descendo para o septo
interventricular muscular. O seio coronariano,
drenando as veias cardíacas, situa-se ao longo do
tendão de Todaro, entre ele e a válvula tricúspide.
Incisão
Todas as formas de comunicações
interatriais são geralmente abordadas através de
esternotomia mediana. Entretanto, alguns cirurgiões
preferem uma toracotomia direita por razões
cosméticas. Outros, preferem a modificação de Brom
da incisão de esternotomia mediana sempre que seja
desejável um fechamento mais cosmético e a
recomendam a todas as mulheres jovens.
Canulação
A aorta ascendente é canulada de modo
habitual. A veia cava superior é canulada diretamente
ou através da auriculeta direita; do mesmo modo, a
veia cava inferior é canulada através da parede atrial
logo acima da origem da veia cava inferior. A seguir,
são passados cadarços em torno de ambas as cavas.
Preservação do miocárdio
A parada cardioplégica fria do miocárdio é
mantida através da infusão cristalóide gelada ou de
cardioplegia sanguínea na raiz aórtica. O fechamento
direto de uma comunicação interatrial (CIA) tipo
“septum secundum” simples pode ser realizado com
bastante segurança com normotermia. A aorta é
pinçada pelo breve tempo necessário para a
realização da atriotomia e fechamento da CIA. A
seguir, é despinçada e a atriotomia é fechada
enquanto o coração está pulsando. De modo
alternativo, a aorta não é pinçada, porém o coração é
induzido a fibrilar, enquanto a CIA está sendo
corrigida. Isto impedirá a ejeção ventricular e,
portanto, qualquer possibilidade de embolia gasosa.
Se por qualquer razão ocorre uma complicação
imprevista, que requer um tempo mais prolongado,
pode ocorrer lesão miocárdica. Assim, é essencial que
se esteja preparado para induzir parada cardioplégica
do coração se desejável.
CIA do tipo venoso
A comunicação interatrial do tipo seio venoso
geralmente ocorre no alto do septo em intima
proximidade com o orifício da veia cava superior,
estando associada a uma drenagem anômala das
veias pulmonares do lobo superior do átrio direito.
Cerca de 10% dos pacientes com este tipo de defeito
atrial septal também apresentam uma persistente veia
cava superior esquerda, que pode revelar-se em uma
angiografia pré-operatória.
• Técnica: dependendo do local exato em que
as veias pulmonares anômalas juntam-se à veia cava
superior, poderá ser necessário canular diretamente a
veia cava superior. A aorta é pinçada e a solução
cardioplégica é administrada na raiz aórtica. Os
cadarços da veia são, a seguir, apertados. Executa-se
uma atriotomia longitudinal iniciando em um ponto a
0,5 a 1 cm anterior e paralelo ao sulco terminal. Os
bordos da incisão são, a seguir, afastados para
proporcionar uma boa exposição do defeito septal. Se
for necessária uma exposição adicional, a atriotomia é
ampliada superiormente em direção ao orifício da veia
cava superior. Um retalho de pericárdio ou Dacron é
cortado em dimensão e forma apropriados após
exame da extensão do defeito. Com uma sutura
contínua de Prolene 4-0, o retalho é suturado em torno
dos limites laterais dos orifícios das veias anômalas e
através da margem anteromedial da CIA. A atriotomia
é, a seguir, fechada através de uma sutura contínua
com Prolene 4-0
• Remoção do retorno venoso da veia cava
superior esquerda: nem sempre a veia cava superior
esquerda persistente necessita canulação. O retorno
venoso pode ser simplesmente removido através de
aspiração por bomba, ou a veia cava superior
esquerda é temporariamente apertada com torniquete
se está presente a veia inominada esquerda.
• Ampliação da incisão: a ampliação superior
da atriotomia pode ter que ser retraída para cima ou,
as vezes, ampliada através da junção atriocaval para
a cava superior para proporcionar uma exposição
adequada. O nódulo sinoatrial pode ser lesado, a não
ser que a atriotomia seja ampliada bem
posteriormente a ele.
• Identificação de Todas as Veias
Anômalas: é importante constatarmos se todo o
cadarço em torno da veia cava superior encontra-se
bem acima do nível de drenagem de todas as veias
anômalas.
• Exposição dificultada: a veia ázigo em sua
união com a veia cava superior pode, as vezes,
obscurecer as estruturas circunvizinhas. Neste caso,
ela deve ser seccionada para liberar a veia cava
superior e proporcionar melhor exposição das veias
pulmonares anômalas.
• Prevenção da estenose ostial das veias
anômalas: é preferível a colocação de pontos no
retalho e bordo do defeito antes de abaixar o retalho à
posição. As suturas adequadamente colocadas, bem
distante dos orifícios das veias anômalas, prevenirão
uma estenose subseqüente. Esta técnica facilita a
drenagem completa de todas as veias pulmonares sob
o retalho para o átrio esquerdo, prevenindo sua
obstrução tardia.
• Obstrução do retorno venoso pulmonar:
se a CIA não é relativamente grande, ela deve ser
ampliada para prevenir a obstrução do retorno venoso
pulmonar. A direção da incisão septal para ampliação
da CIA deve ser caudal, e não cranial de modo a não
lesar a artéria do nódulo sinusal.
• Remoção do ar: mantendo-se os pulmões
insuflados, o coração esquerdo é inundado com
sangue para deslocar qualquer bolha de ar loculado
de dentro da circulação pulmonar e átrio esquerdo o
retalho é mantido parcialmente aberto até que todo o
ar seja removido; somente, então, serão os extremos
dos fios de sutura apertados e amarrados, fechando
completamente o defeito.
• Prevenção de obstrução da veia cava
superior: se a atriotomia foi ampliada para a veia
cava superior, seu fechamento pode levar ao
estreitamento da veia cava superior e dar origem a
obstrução subseqüente. Tal inconveniência pode ser
prevenida incorporando-se um retalho do pericárdio no
fechamento atrial. De modo alternativo, a atrioplastia
da parede pode ser realizada se o átrio direito é
volumoso.
• Lesão do nódulo sinoatrial: como
mencionamos acima, a linha do fechamento atrial
encontra-se em íntima proximidade do nódulo
sinoatrial. Os bordos da atriotomia devem ser
manuseados com cuidado para prevenir distúrbios de
condução decorrentes de lesão do nódulo sinoatrial.
CIA tipo Ostium Secundum
Este tipo de CIA constitui a forma mais
comum entre os defeitos que
afetam o septo
atrial. São geralmente grandes e incluem toda a área
da fossa oval.
• Técnica: A aorta é pinçada e a solução
cardioplégica é administrada na raiz aórtica. Os
cadarços da veia são, a seguir, apertados. Executa-se
uma atriotomia longitudinal iniciando em um ponto a
0,5 a 1 cm anterior e paralelo ao sulco terminal. Os
bordos da incisão são, a seguir, afastados para
proporcionar uma boa exposição do defeito septal.
Muitas CIA “secundum” menores podem ser fechadas
diretamente. As suturas são colocadas nos extremos
superior e inferior do defeito e continuadas em direção
um ao outro, incorporando as margens da CIA. Na
maioria dos casos, os cirurgiões preferem utilizar uma
placa de pericárdio ou de Dracon para fechar a CIA
tipo “ostium secundum” e, assim, eliminar qualquer
tensão ao longo das linhas de sutura. Um retalho de
dimensão apropriada é preparado e suturado em
posição através de suturas contínuas de Prolene 4-0.
A atriotomia é, a seguir, fechada com uma sutura
contínua de Prolene 4-0.
• Fechamento com placas: se o defeito é
grande ou se existe qualquer tensão ao longo da linha
de sutura, o defeito será fechado com uma placa de
pericárdio ou de Dacron para prevenir deiscência da
correção.
• Profundidade dos pontos: os pontos devem
incorporar o endocárdio espessado de ambos os lados
do septo interatrial. O tecido da fossa oval é
geralmente muito débil e friável para proporcionar uma
correção segura.
• Extensão da CIA para a veia cava inferior:
as vezes, a CIA pode estender-se para o orifício da
veia cava inferior, tornando difícil sua exposição. A
cânula da veia cava inferior deve ser afastada para
permitir o fechamento desta margem sob visão direta
através de uma sutura contínua de Prolene 4-0
incorporando o retalho.
• Identificação cuidadosa da margem
inferior da CIA: a margem inferior da CIA deve ser
identificada e diferenciada da válvula de Eustáquio à
margem anterior da CIA criará um túnel desviando a
drenagem da veia cava inferior para o átrio esquerdo.
• Profundidade das suturas: como no
fechamento direto, a sutura deve incorporar o
endocárdio espessado de ambos os lados do septo e
não o tecido da fossa oval, o qual é, com freqüência,
delgado e friável.
• Remoção do ar: mantendo-se os pulmões
insuflados, o coração esquerdo é inundado com
sangue para deslocar qualquer bolha de ar loculado
de dentro da circulação pulmonar e átrio esquerdo o
retalho é mantido parcialmente aberto até que todo o
ar seja removido; somente, então, serão os extremos
dos fios de sutura apertados e amarrados, fechando
completamente o defeito.
• Drenagem da veia pulmonar direita no
átrio direito: a margem posterior da CIA pode ser tão
acentuada que permita a drenagem das veias
pulmonares direitas diretamente no átrio direito. O
retalho deve, então, ser suturado à parede atrial, a
direita dos orifícios da veia pulmonar, para permitir o
desvio de sua drenagem por trás do retalho para o
átrio esquerdo.
Átrio Comum
Em situações raras, o septo atrial pode
encontrar-se ausente, dando origem à uma câmara
atrial comum única. Também podem coexistir outras
lesões como uma drenagem venosa sistêmica
anômala com ou sem veia cava superior esquerda e
defeitos coxim endocárdicos. Cada anomalia deverá
ser individualmente abordada com a subseqüente
septação do átrio comum.
Um determinado caso apresentando
ausência completa do septo atrial, ausência da veia
cava superior direita, persistência da veia cava
superior esquerda e uma válvula mitral fendida foi
submetido a correção completa levando em
consideração as seguintes orientações:
• A canulação aórtica é realizada de modo
habitual. Os cadarços são passados em torno da veia
cava superior esquerda e veia cava inferior. A veia
cava inferior é canulada através da parede atrial
direita. Inicia-se a circulação extracorpórea parcial e o
torniquete em torno da veia cava inferior é apertado.
Realiza-se, a seguir, a atriotomia tradicional (acima e
paralela ao sulco terminal). A veia cava superior
esquerda é canulada diretamente e o torniquete em
torno dela é agora apertado. Deste modo, obtém-se
uma circulação extracorpórea total.
• A aorta é pinçada e a cardioplegia é
administrada na raiz aórtica. A válvula mitral fendida é
corrigida através de múltiplos pontos separados. Um
amplo retalho do pericárdio ou de Dacron é, a seguir,
suturado à parede posterior
A septação deve iniciar-se na região do anel entre as
válvulas atrioventriculares. A sutura deve incluir o anel
e uma pequena fração do tecido da válvula tricúspide.
O folheto da válvula mitral deve ser poupado para
evitar a produção de insuficiência mitral. A sutura
prossegue em sentido horário ao redor do orifício do
seio coronariano (o qual freqüentemente está ausente)
de tal modo que drena para o átrio sistêmico. A
mesma sutura prossegue adiante ao longo da parede
atrial posterior em torno dos orifícios das veias
pulmonares direitas. A outra extremidade da sutura
prossegue em sentido anti-horário por baixo e por trás
do orifício da veia cava superior esquerda até que o
retalho assuma a configuração de um septo. O retalho
deve ser sempre de dimensão gêneros; se existe
excesso de retalho, ele pode ser aparado antes de
completada a sutura; caso contrário, ele pode ter que
ser ampliado através da sutura de outro retalho a ele.
2. DEFEITO DO SEPTO VENTRICULAR
A anomalia congênita mais comum consiste no
fechamento incompleto do septo ventricular,
permitindo uma comunicação livre entre os ventrículos
direito e esquerdo. Com freqüência, o DSV está
associado a outros defeitos estruturais, como
tetralogia. Cerca de 30% ocorrem como anomalias
isoladas. Dependendo do tamanho do defeito, podem
produzir dificuldades praticamente desde o
nascimento, ou, no caso de lesões menores, podem
não ser reconhecidos até uma fase mais tardia da
vida, podendo inclusive fechar espontaneamente.
Embriologia
A primeira indicação da divisão do ventrículo
primitivo em dois ventrículos é constituída por uma
crista muscular mediana – o septo IV primitivo – no
soalho do ventrículo, próximo ao seu ápice. Esta
espessa prega, em forma de crescente, tem uma
borda livre côncava. Inicialmente, a maior parte do seu
aumento em altura resulta da dilatação dos ventrículos
de ambos os lados do septo IV. As paredes mediais
dos ventrículos em expansão se aproximam e se
fundem, formando o primórdio da parte muscular do
septo IV. Mais tarde, a proliferação ativa de mioblastos
no septo aumenta o seu tamanho. Até a sétima
semana, há um forâmen IV entra a borda livre do
septo IV em forma de crescente e os coxins
endocárdicos fundidos. O forâmen IV permite a
comunicação entre os ventrículos direito e esquerdo.
O forâmen IV usualmente se fecha ao final da sétima
semana, quando as cristas bulbares se fundem com
os coxins endocárdicos.
O fechamento do forâmen IV e a formação da
parte membranosa do septo IV resultam da fusão de
tecidos provenientes de três fontes:
• A crista bulbar direita
• A crista bulbar esquerda
• O coxim endocárdico
A parte membranosa do septo IV deriva de
uma extensão de
tecido do lado direito do coxim
endocárdico para a parte muscular do septo IV. Este
tecido é contínuo com o septo aorticopulmonar. Após
o fechamento do forâmen IV e formação da parte
membranosa do septo IV, o tronco pulmonar fica em
comunicação com o ventrículo direto e a aorta
comunica-se com o ventrículo esquerdo.
A cavitação das paredes ventriculares forma
uma estrutura trabeculada de feixes musculares.
Alguns destes feixes permanecem como as trabéculas
carnosas (feixes musculares sobre o revestimento das
paredes ventriculares), enquanto outros se tornam os
músculos papilares e a cordoalha tendinosa. Os
cordões tendinosos vão dos músculos papilares para
as válvulas atrioventriculares.
Morfologia
Os DSV são classificados de acordo com o
seu tamanho e localização. A maioria tem
aproximadamente o tamanho do orifício da valva
aórtica. Cerca de 90% afetam a região do septo
membranoso (DSV membranoso). O restante situa-se
abaixo da valva pulmonar (DSV infundibular) ou no
interior do septo muscular. Apesar de mais
freqüentemente isolado, o DSV no septo muscular
pode ser múltiplo (o denominado septo em queijo
suíço).
O significado funcional do DSV depende do
tamanho do defeito e da presença de outras
anomalias. Cerca de 50% dos pequenos DSV
musculares fecham de modo espontâneo, e o restante
é, em geral bem tolerado durante anos. Os grandes
defeitos
costumam
ser membranosos
ou
infundibulares e, em geral, permanecem abertos,
permitindo um fluxo significativo da esquerda para a
direita. A hipertrofia ventricular direita e a hipertensão
pulmonar estão presentes desde o nascimento. Com o
decorrer do tempo, verifica-se o desenvolvimento de
doença vascular pulmonar irreversível em
praticamente todos os pacientes com grandes DSV
não-operados, resultando em reversão da derivação,
cianose e morte.
Os grandes defeitos podem manifestar-se
praticamente ao nascimento, com sinais de
insuficiência cardíaca acompanhando o sopro. Em
geral, não se efetua o fechamento cirúrgico dos DSV
assintomático no lactente, na esperança de
fechamento espontâneo. Entretanto, a correção está
indicada em crianças com1 ano de idade portadoras
de grandes defeitos, antes que a doença vascular
pulmonar obstrutiva se torne irreversível.
Anatomia cirúrgica
O desenvolvimento embriológico das
comunicações interventriculares (CIV) é, de fato,
interessante e tem constituído a base para diversas
classificações. Entretanto, um número crescente de
clínicos prefere uma classificação proposta por
Anderson, a qual é simples e com diversas
implicações clínicas, principalmente do ponto de vista
do cirurgião. Anderson divide os defeitos septais
ventriculares em tipos perimembranoso, subarterialinfundibular e muscular.
A variedade perimembranosa do defeito
septal ventricular engloba subgrupos de defeitos que
ocorrem na vizinhança do segmento membranoso do
septo interventricular e inclui os defeitos septais
comumente observados na tetralogia de Fallot
“atrioventricularis comunis” (AVC). Como o trajeto do
tecido de condução encontra-se intimamente
relacionado à margem inferior destes defeitos, é muito
útil um conhecimento preciso da anatomia cirúrgica
desta região.
O nódulo atrioventricular situa-se em sua
posição habitual no ápice do triângulo de Koch (cujos
limites consistem da fixação septal da válvula
tricúspide, o tendão de Todaro e o seio coronariano
com sua base. O tecido de condução passa do nódulo
atrioventricular de His através do corpo fibroso central
e o anel tricúspide para o septo ventricular seguindo
um trajeto ao longo da margem inferior do defeito em
direção ao lado ventricular esquerdo do septo.
Incisão
Todas as comunicações interventriculares
são habitualmente abordadas através de uma
esternotomia mediana.
Canulação
A parada hipotérmica profunda combinada à
circulação extracorpórea limitada é mais comumente
utilizada em bebês e pacientes com peso menor que
10 kg. A aorta ascendente é canulada de modo
habitual. Nestes pacientes, uma única cânula venosa
através da auriculeta direita proporciona uma
drenagem venosa adequada para a limitada circulação
extracorpórea utilizada durante as fases de
resfriamento e aquecimento do procedimento
cirúrgico.
Em pacientes mais velhos é preferível a
circulação extracorpórea com hipotermia moderada. A
veia cava superior é canulada diretamente ou através
da auriculeta direita; do mesmo modo, a veia cava
inferior é canulada através da parede atrial logo acima
da origem da veia cava inferior. A seguir, os cadarços
são passados em torno e ambas as cavas.
Preservação do miocárdio
A parada cardioplégica fria do miocárdio é
mantida através da infusão de cardioplegia cristalóide
gelada ou cardioplegia sanguínea na raiz aórtica.
Abordagem Transatrial da CIV
Quase todos os tipos de comunicações
interventriculares perimembranosas e tipo AVC e
muitos da variedade muscular podem ser expostos e
fechados através do átrio direito. O tipo subarterialinfundibular é melhor abordado através de
ventriculotomia direita.
A aorta é pinçada e a solução cardioplégica é
administrada na raiz aórtica. Os torniquetes das veias
cavas são, a seguir, apertados. Realiza-se uma
atriotomia longitudinal ou oblíqua iniciando em um
ponto 0,5 a 1 cm anterior e paralelo ao sulco terminal
e ampliado em direção ao orifício da veia cava inferior.
Os bordos da incisão são, a seguir, afastados para
proporcionar uma exposição adequada da válvula
tricúspide e do triangulo de Koch.
• Coexistência da persistência do canal
arterial: se está presente o canal arterial, ele deverá
ser ligado antes do início da circulação extracorpórea
ara prevenir ulterior excesso de circulação em
pulmões pletóricos já sobrecarregados.
• Lesão do nódulo sinoatrial: o nódulo
sinoatrial é vulnerável à lesão pelo torniquete em torno
da veia cava superior. Pode também ser lesado se a
atriotomia é ampliada muito para cima.
Técnica do Fechamento
O folheto anterior da válvula tricúspide é
afastado com uma sutura Prolene 6-0 ou alças
vasculares finas para expor o defeito e suas margens
para identificação. Com um fio Prolene 4-0 com duas
agulhas semicirculares, inicia-se a sutura na posição
de 12 horas ao longo da margem muscular. A agulha
é, a seguir, passada através de um retalho de velour
de Dacron ligeiramente maior que a dimensão do
defeito, novamente através da margem muscular e, a
seguir, novamente através do retalho, o qual é a
seguir, baixado em posição.
A sutura prossegue em sentido anti-horário
ao longo da margem superior, a qual passa sobre a
válvula aórtica, até a junção fibrosa central do septo,
raiz aórtica e anel tricúspide serem atingidos. A agulha
é, a seguir, passada através do folheto septal da
válvula tricúspide. Durante o procedimento, a
colocação de cada ponto é facilitada pelo assistente
aplicando ligeira tração sobre a sutura de Prolene.
• Reforçando as suturas: as vezes, a
margem muscular do defeito septal ventricular pode
ser muito friável, permitindo sua secção pelo Prolene
delgado. Isto ocorre com maior probabilidade quando
existe uma associada hipertrofia muscular prolongada,
como na tetralogia de Fallot. Os pontos separados
múltiplos reforçados com almofadas de Teflon são,
então, substituídos pela técnica de sutura contínua
(ver adiante abordagem transventricular da
comunicação interventricular).
• Lesão da válvula aórtica: os folhetos da
válvula aórtica encontram-se imediatamente abaixo da
margem superior da CIV e podem ser puncionados
durante a sutura se pontos profundos são dados nesta
área.
• Suturas de transição: a junção do anel
tricúspide, raiz aórtica e septo constitui uma área
vulnerável onde pode ocorrer uma CIV residual. Um
ponto de transição incorporando a margem da CIV, o
retalho e o folheto tricúspide (nesta ordem) irá
assegurar um fechamento mais seguro. Isto pode ser
satisfatoriamente conseguido tato na técnica com
pontos separados como na sutura contínua.
• O outro lado da sutura com Prolene
prossegue, então, em sentido horário; pontos
superficiais que incluem apenas o endocárdio são
dados ao longo da margem inferior do defeito antes de
penetrar o folheto tricúspide. De modo alternativo, este
lado da sutura prossegue, movendo-se para fora a
uma distância de 3 a 5 mm da margem do defeito para
evitar o tecido de condução subjacente antes de
penetrar novamente o folheto septal da válvula
tricúspide.
• Prevenção do bloqueio cardíaco: como já
descrevemos, o feixe de His penetra o corpo fibroso
central e o anel tricúspide antes de penetrar o septo
ventricular, onde segue um trajeto ao longo da
margem inferior do defeito em direção ao lado
ventricular esquerdo do septo. Como a sutura ao
longo deste trajeto pode ser perigosa e culminar em
bloqueio cardíaco, são dados pontos superficiais que
incluam apenas o esbranquiçado endocárdico 3 a 5
mm da margem do defeito. De fato, a agulha deve ser
visível através do endocárdio translúcido.
• Interferência das cordoalhas tendinosas: a
conduta adequada do fechamento da CIV pela sutura
pode, às vezes, sofrer interferência de uma ou duas
cordoalhas tendinosas fixadas ao folheto septal. Elas
podem ser simplesmente seccionadas para permitir o
assentamento satisfatório do retalho.
• Suturas de transição: a junção onde o anel
tricúspide forma a margem da CIV é também muito
vulnerável a uma CIV residual. Normalmente, um
ponto de transição incorporando uma camada
superficial do endocárdio espessado, o retalho e o
folheto tricúspide (nesta ordem) proporcionará um
fechamento mais seguro. Isto pode ser realizado
através da técnica de sutura contínua ou de pontos
separados. A agulha é, a seguir, passada através do
folheto tricúspide cerca de 2 mm do anel através de
um ponto em U saindo no ventrículo direito, pegando o
retalho antes de penetrar novamente o folheto. Esta
manobra prossegue em sentido horário até o encontro
da outra ponta do fio de Prolene, de tal modo que
ambas as pontas possam ser firmemente amarradas
entre si.
• Reforçando as suturas: a sutura de Prolene
pode seccionar o delgado tecido do folheto tricúspide.
A linha de sutura pode ser reforçada com almofadas
múltiplas ou uma tira de feltro de Teflon. Com a
técnica de sutura com pontos separados são utilizados
fios com almofadas de Teflon.
• Prevenção da insuficiência tricúspide: a
incorporação de excessivo tecido do folheto na linha
de sutura pode levar a insuficiência tricúspide. A linha
de sutura ao longo do folheto tricúspide não deve
exceder a distância de 2 mm do anel tricúspide.
Quando completa a correção, a atriotomia é, então,
fechada com sutura contínua de Prolene 5-0.
Abordagem Transventricular da CIV
Todas as comunicações interventriculares,
com exceção das que ocorrem próximas do ápice
ventricular esquerdo, podem ser fechadas através de
uma ventriculotomia direita, uma abordagem que
ainda é preferida por muitos cirurgiões. Quando
existem lesões associadas, como estenose valvular
infundibular ou pulmonar (como na tetralogia de
Fallot), uma ventriculotomia vertical torna-se a
abordagem de escolha, uma vez que ela pode ser
ampliada ao longo do trato de saída ventricular direito,
proporcionando, assim, uma exposição excelente.
Uma ventriculotomia transversa apresenta algumas
vantagens teóricas, principalmente quando uma
artéria coronária aberrante cruza a parede anterior do
ventrículo direito.
• Evitando as artérias coronárias: toda a
precaução será tomada no sentido de se evitar a
secção de uma artéria coronária aberrante. Quando a
artéria coronária descendente anterior esquerda
origina-se da artéria coronária direita, ela cursa
através da parede anterior do ventrículo direito. Sua
secção acidental pode levar à grave disfunção
miocárdica.
• Hipertrofia infundibular ocultando a
localização da CIV: a hipertrofia infundibular pode
ocultar a localização do tipo perimembranoso de CIV.
O excesso de massa muscular hipertrofiada, que pode
ser também responsável por certa obstrução da via de
saída ventricular direita, deve ser cuidadosamente
excisada para expor as margens da CIV e aliviar a
obstrução.
A técnica do fechamento transventricular da
comunicação interventricular perimembranosa é
basicamente a mesma descrita para a abordagem
transatrial. Os bordos da incisão da ventriculotomia
são afastados através de pontos com fios finos
almofadados. As margens da CIV são inspecionadas,
iniciando-se a colocação de pontos separados de
Tevdek 4-0 com almofadas de Teflon na porção de 12
horas ao longo da margem muscular evertendo-se os
bordos. Ambas as agulhas são, a seguir, passadas
através de um retalho de velour de Dacron
ligeiramente maior que a dimensão da CIV. Uma
ligeira tração neste ponto pelo assistente melhorará a
exposição e facilitará a colocação do ponto seguinte.
A sutura prossegue deste modo em sentido
anti-horário ao longo da margem superior (que recobre
a válvula aórtica) até a junção fibrosa central do septo,
raiz e anel tricúspide sejam alcançados. Ambas as
agulhas dos pontos separados seguintes incorporam a
margem muscular da CIV e o folheto tricúspide (nesta
ordem). Dependendo da consistência do folheto
tricúspide, as agulhas poderão ser passadas através
de outra almofada de Teflon antes de serem
amarrados. A sutura prossegue, a seguir, do ponto de
início em sentido horário, movendo-se para fora a uma
distância de 3 a 5 mm da margem da CIV para evitar o
tecido de condução subjacente. Também pode ser
utilizada a técnica alternativa de pontos muito
superficiais que incluam somente o endocárdio na
região da margem inferior.
Quando o anel tricúspide torna-se parte da
margem inferior da CIV, ambas as agulhas dos pontos
separados com almofadas de Teflon pegam
superficialmente o endocárdio espessado, o retalho, a
válvula tricúspide e a outra almofada de Teflon (nesta
ordem). Os pontos restantes são passados do átrio
direito através do folheto tricúspide cerca de 2 mm do
anel antes de passarem através do retalho. Quando
todos os pontos estão satisfatoriamente colocados, o
retalho é baixado em posição e os fios são amarrados
justos.
De modo alternativo, pode-se utilizar no
mesmo padrão uma sutura contínua de Prolene 4-0.
Quando a CIV foi satisfatoriamente corrigida, a
ventriculotomia é a seguir, fechada com duas
camadas de suturas contínuas de Prolene 4-0.
• Lesão da válvula aórtica: os folhetos da
válvula aórtica encontram-se imediatamente abaixo da
margem superior da CIV e podem ser puncionados
durante a sutura se pontos profundos são dados nesta
área. Assim, a sutura nesta área deve incorporar a
crista marginal que suporta bem as suturas
• Prevenção do bloqueio cardíaco: como já
descrevemos, o feixe de His penetra o corpo fibroso
central e o anel tricúspide antes de penetrar o septo
ventricular, onde segue um trajeto ao longo da
margem inferior do defeito em direção ao lado
ventricular esquerdo do septo. Como a sutura ao
longo deste trajeto pode ser perigosa e culminar em
bloqueio cardíaco, são dados pontos superficiais que
incluam apenas o esbranquiçado endocárdico 3 a 5
mm da margem do defeito.
• Suturas de transição: a junção onde o anel
tricúspide forma a margem da CIV é também muito
vulnerável a uma CIV residual. Normalmente, um
ponto de transição incorporando uma camada
superficial do endocárdio espessado, o retalho e o
folheto tricúspide (nesta ordem) proporcionará um
fechamento mais seguro.
• Reforçando as suturas: a sutura de Prolene
pode seccionar o delgado tecido do folheto tricúspide.
A linha de sutura pode ser reforçada com almofadas
múltiplas ou uma tira de feltro de Teflon.
O tipo de CIV subpulmonar-infundibular pode
ser fechado com sucesso com um retalho de velour de
Dacron através de técnicas de sutura contínua ou de
pontos separados, sem a preocupação acerca de
produzir qualquer anomalia de condução.
Abordagem por Ventriculotomia Esquerda
Dependendo de sua localização, as CIV
musculares podem ser abordadas através do átrio e
do ventrículo direito. As vezes, quando a CIV ocorre
no septo distal inferior, uma ventriculotomia esquerda
limitada próxima ao ápice proporciona a melhor
exposição. A CIV é, a seguir, fechada com um retalho
de velour de Dracon utilizando pontos em U
separados com almofadas de Teflon.
3. PERSISTÊNCIA DO CANAL ARTERIAL
O PCA refere-se à persistência, após o
nascimento, da comunicação normal entre o sistema
arterial pulmonar e a aorta do feto. Cerca de 90% dos
casos de PCA ocorrem como anomalia isolada. O
restante está mais freqüentemente associado a DSV,
coarctação ou estenose pulmonar ou aórtica. A
extensão e o diâmetro do canal variam amplamente.
Com mais freqüência, a PCA não produz
dificuldades funcionais ao nascimento. Um canal
estreito pode não exercer nenhum efeito sobre o
crescimento e desenvolvimento durante a infância.
Entretanto, sua existência pode ser geralmente
detectada por um sopro áspero contínuo, descrito
como semelhante a maquinaria. Como a derivação é,
a princípio, da esquerda para a direita, não ocorre
cianose. Entretanto, verifica-se finalmente o
desenvolvimento de doença vascular pulmonar
obstrutiva, com reversão final do fluxo e suas
conseqüências associadas.
Em geral, existe consenso quanto à
necessidade de fechamento da PCA o mais cedo
possível no decorrer da vida. A preservação da
viabilidade ductal (através da administração de
prostaglandina E) pode assumir grande importância na
sobrevida dos lactentes com várias formas de
cardiopatia congênita com fluxo sanguíneo pulmonar
ou sistêmico obstruído, como atresia da valva aórtica.
Ironicamente, o canal pode ser potencialmente fatal ou
salvar a vida do indivíduo.
Embriologia
Ao nascimento, o canal arterial entra e
constrição, mas, em um recém-nascido a termo,
saudável, freqüentemente há um pequeno desvio de
sangue da aorta para a artéria pulmonar esquerda.
Nos recém-nascidos prematuros e nos que tem
hipóxia persistente, o CA pode permanecer aberto por
mais tempo. O oxigênio é o fator mais importante no
controle do fechamento do CA nos recém-nascidos a
termo. O fechamento do CA parece ser mediado pela
bradicinina, uma substância liberada pelos pulmões
durante a insuflação inicial. A bradicinina tem um
efeito contrátil potente sobre o músculo liso. A cão
desta substância parece depender do alto conteúdo
de oxigênio do sangue aórtico resultante da aeração
dos pulmões ao nascimento. Quando a PO2 do sangue
que passa pelo CA atinge cerca de 50 mmHg, a
parede do ducto entra em constrição. Os mecanismos
pelos quais o oxigênio causa as restrições ductais não
são bem compreendidos. O efeito do oxigênio sobre o
músculo liso ductal pode ser direto ou pode ser
mediado por seus efeitos sobre a secreção de
prostaglandina E2 e de prostaciclina. O fechamento
funcional do CA usualmente é completado com 10 a
15 horas após o nascimento. O fechamento anatômico
do canal e a formação do ligamento arterial
normalmente ocorrem com 12 semanas.
Anatomia Cirúrgica
O CA corre paralelamente ao arco aórtico
desde a porção superior da origem da artéria
pulmonar esquerda, passando através do pericárdio
para unir-se à margem medial da aorta em ângulo
agudo logo em oposição a origem da artéria subclávia
esquerda. O tronco do vago esquerdo penetra o tórax
da raiz do pescoço em um sulco entre a artéria
subclávia esquerda e a artéria carótida comum
esquerda, cruza o arco aórtico bom como o CA e
prossegue para baixo. O ramo do laríngeo recorrente
curva-se em torno do CA e estende-se de volta para
cima para o pescoço. O nervo vago dá origem a vários
outros pequenos ramos que são tributários
importantes para os plexos pulmonar e cardíaco.
Geralmente existem alguns gânglios linfáticos
encrustados no hilo do pulmão esquerdo que, as
vezes, estende-se para cima próximo da margem
inferior do CA. O nervo frênico esquerdo penetra o
tórax medialmente ao nervo vago e prossegue para
baixo no pericárdio.
Incisão
O CA pode ser adequadamente exposto
através da toracotomia anterior esquerda no terceiro
interespaço ou através de toracotomia lateral posterior
através do leito da quarta costela. A abordagem lateral
posterior proporciona exposição mais ampla e é mais
comumente utilizada.
Técnica de Exposição e
Dissecção do Canal
O pulmão esquerdo é tracionado para baixo
para permitir a visualização da área do canal. A pleura
parietal é seccionada longitudinalmente por trás do
nervo vago se a intenção é retrair medialmente o
nervo vago. De modo alternativo, a incisão da pleura
pode ser realizada entre os nervos vago e frênico
quando o nervo vago será lateralmente retraído. A
incisão escolhida é ampliada para cima ao longo da
artéria subclávia esquerda e para baixo até o hilo
esquerdo. Os bordos pleurais são, a seguir,
suspensos.
No recém-nascido, o canal é exposto através
de dissecção cortante com tesouras, para cima e para
baixo. Um mixter de ângulo reto, é, a seguir, passado
em torno do canal para criar um plano para a sua
ligadura ou divisão. O canal também pode ser ocluído
através da aplicação de um clipe de metal.
• Lesão do nervo laríngeo recorrente
durante a dissecção do canal: se o canal é
posteriormente aderido, a técnica de dissecção romba
pode lesar o canal e o nervo laríngeo recorrente (ou
ambos). Portanto, recomenda-se a dissecção cortante
do canal, inclusive sua parede posterior.
• Lesão do nervo pela direção da tração:
para facilitar a dissecção exposição da porção
posterior do canal, muitos cirurgiões preferem que o
nervo vago e seu ramo laríngeo recorrente sejam
medialmente refletidos sobre o retalho pleural. O
cirurgião deve estar ciente de que a tração do nervo
em direção a artéria pulmonar faz com que o nervo
recorrente se encontre ao longo de um trajeto diagonal
por trás do canal anterior, aumentando, assim, o risco
de lesão do nervo.
De modo alternativo, o nervo vago e seus
ramos podem ser isolados e lateralmente retraídos
para assegurar sua proteção durante o processo de
dissecção da parede posterior do canal. A aorta e o
canal são, a seguir, mobilizados através de dissecção
cortante (aguda).
• Exposição completa do canal: cuidados
especiais devem ser tomados quando se disseca na
vizinhança do ângulo entre a artéria pulmonar e o
canal, pois este é particularmente susceptível de
lesão. Uma dobra do pericárdio quase sempre recobre
o canal anteriormente. Ela deve ser dissecada para
assegurar a exposição completa do canal.
• Liberação da aorta: a aorta é também
dissecada, evitando-se a lesão das artérias
intercostais. A face posterior do canal encontra-se
sempre aderente aos tecidos circundantes e pode ser
lacerado durante o processo de mobilização. Dois
cadarços são passados em torno da aorta algo acima
e abaixo do nível do canal.
Os cadarços são, a seguir, tracionados para
cima e medialmente, expondo a superfície posterior da
aorta e do canal para uma cuidadosa dissecção sob
visão direta.
Técnica de Secção e Ligadura do Canal
Os nervos vago e laríngeo recorrente são
identificados para que não sejam inadvertidamente
divididos. Dois fios grossos de Ethibond ou cadarços
são individualmente passados por trás do canal, o
qual é então, ligado com segurança. Um material de
sutura mais fino pode cortar a parede friável do canal
e levar a hemorragia. Uma sutura em bolsa de Prolene
4-0 pode ser colocada entre as ligaduras para
assegurar uma oclusão completa do canal. De modo
alternativo, o canal é seccionado entre pinças e os
cotos suturados com fios finos não absorvíveis. Esta
técnica é especialmente útil quando o canal é
excepcionalmente curto e amplo. Outra opção é a
oclusão do canal com clipes, principalmente em bebês
prematuros.
• Dificuldades de dissecção: as vezes, pode
existir alguma dificuldade na dissecção da vizinhança
da parede posterior do canal, principalmente em
pacientes mais idosos. A passagem do material de
sutura ou cadarços diretamente em torno do canal
pode, então, ser impossível. Os cadarços passados
em torno da aorta podem ser manobrados para
envolver e proporcionar exposição e controle do canal.
• Lesão do nervo laríngeo recorrente
durante a ligadura do canal: o cirurgião deve sempre
dedicar especial atenção ao nervo laríngeo recorrente
que pode ser facilmente seccionado durante a
mobilização do canal. Ele também pode ser
incorporado na ligadura ou no pinçamento do canal.
• Laceração do canal: o canal é passível de
lesão e laceração em qualquer momento durante a
dissecção, ligadura ou secção, levando à hemorragia
maciça. A simples compressão digital sobre o canal
geralmente é suficiente para controlar o sangramento
e proporcionar uma exposição adequada em um
campo seco. A aorta pode, então, ser pinçada acima e
abaixo do canal ao longo dos cadarços previamente
colocados enquanto que o canal lacerado é suturado
com fios não absorvíveis. A extremidade da artéria
pulmonar do canal pode, do mesmo modo, ser
suturada. As vezes, esta extremidade do canal, se
muito lesada, pode retrair-se medialmente, tornando
impossível sua exposição. Nestas circunstâncias,
enquanto se prossegue o controle digital do
sangramento, o cirurgião deve incisar o pericárdio
longitudinalmente, anterior ao nervo frênico esquerdo.
A artéria pulmonar esquerda é temporariamente
ocluída. A abertura do canal é, a seguir, suturada sob
visão direta em um campo relativamente seco.
• Pinçamento parcial da aorta: sempre que o
cirurgião decide seccionar o canal, é essencial que a
pinça inclua as paredes da aorta e artéria pulmonar e
não apenas o tecido do canal, o qual é muito friável e
propenso a romper-se. Além disso, o canal nunca
deve ser diretamente pinçado e tracionado.
• Ligadura inadvertida do arco aórtico: o
canal e o arco aórtico devem ser ambos identificados.
As vezes, o canal pode ser muito grande e o arco
subdesenvolvido e hipoplásico. A ligadura inadvertida
do arco aórtico, ao invés do canal, constitui uma
catástrofe que pode ser prevenida através da oclusão
seqüencial do canal e do arco enquanto se observa
pelo desaparecimento da pressão arterial conforme
monitorização no braço esquerdo.
• Oclusão do canal: é de boa prática a
oclusão do canal com uma pinça de tecido
atraumático antes de sua ligadura ou secção. A
ocorrência de hipotensão, bradicardia e outros,
podem, então, ser observados todos os quais sugerido
que o paciente não tolera a oclusão do canal,
possivelmente devido a reversão do fluxo ou alguma
outra anomalia congênita complexa.
Calcificação do Canal
O canal pode estar calcificado e
aneurismático e a simples ligadura ou secção pode
não ser exeqüível. Nestas circunstâncias, a aorta é
pinçada superior e inferiormente e a abertura do canal
é fechada através de uma aortotomia longitudinal com
uma placa de Dacron.
• Tecidos friáveis: se os tecidos são friáveis,
o retalho de Dacron pode ser suturado no local com
pontos almofadados separados.
Ligadura do PCA - Abordagem Anterior
Muitos bebês e crianças pequenas com
cardiopatias congênitas que estão para submeter-se a
cirurgia corretiva continuam a apresentar persistência
do canal arterial. Com o início da circulação
extracorpórea, pode ocorrer uma inundação da
circulação pulmonar a não ser que o canal seja
ocluído. Portanto, em todo paciente deve-se verificar a
existência da presença do canal arterial
rotineiramente.
Antes do início da circulação extracorpórea, a
aorta é ligeiramente afastada para a direita e a artéria
pulmonar principal é gentilmente afastada para baixo.
O canal e a artéria pulmonar esquerda são liberados
da concavidade do arco da aorta. O canal é
circundado por um fio grosso, trançado e ligado no
início da circulação extracorpórea.
4. DEFEITO SEPTAL ATRIOVENTRICULAR
Os DSAV resultam do desenvolvimento
anormal do canal AV embriológico, em que os coxins
endocárdicos superior e inferior não sofrem fusão
adequada, resultando em fechamento incompleto do
septo AV e formação inadequada das valvas
tricúspide e mitral. As duas formas mais comuns são o
DSAV parcial (constituindo em DSA primum e folheto
mitral anterior fendido, causando insuficiência mitral) e
DSAV completo (consistindo em grande DSAV
combinado e grande valva AV comum – em essência,
um orifício no centro do coração). Na forma completa,
todas as quatro câmaras cardíacas comunicam-se
livremente, induzindo hipertrofia de volume de cada
uma delas. Mais de um terço de todos os pacientes
com DSAV completo apresentam síndrome de Down.
O reparo cirúrgico é possível.
Embriologia
Próximo ao final da quarta semana, formamse coxins endocárdicos nas paredes dorsal e ventral
do canal atrioventricular (AV). Quando estas massas
de tecido são invadidas por células mesenquimatosas
durante a quinta semana, os coxins endocárdicos AV
se aproximam um do outro e se fundem, dividindo o
canal AV em canais AV direito e esquerdo. Estes
canais separam parcialmente o átrio primitivo do
ventrículo, e os coxins endocárdicos funcionam como
válvulas AV.
Anatomia cirúrgica
Nos últimos anos tem havido muita discussão
em relação a definição e embriogênese do que foi
denominado de complexo do canal atrioventricular. É
apropriado referir-se a este complexo anatômico como
comunicações atrioventriculares pois, afinal, isto é o
que é realmente observado clinicamente. A
comunicação geralmente inclui o segmento inferior do
septo atrial e o segmento superior ou a porção de
influxo do septo interventricular. As válvulas
atrioventriculares também se desenvolvem de modo
normal, porém variável.
A não ser nas formas mais leves, em todos
existe uma válvula atrioventricular comum que pode
dizer-se constituída por seis folhetos de dimensão e
forma variáveis ligadas a músculos papilares normal
ou anormalmente localizados através de cordoalhas
tendinosas. Esta válvula atrioventricular comum pode
ser subdividida em um componente ou segmento
mitral e tricúspide, cada um com três folhetos. Os
folhetos que constituem a válvula tricúspide são
designados superior direito, inferior direito e lateral
direito, e os que compõem a válvula mitral são
designados superior esquerdo, inferior esquerdo e
lateral esquerdo.
Tem significado clínico e anatômico o fato de
que em corações normais o folheto mitral anterior
contribui apenas um terço, e o folheto posterior com
dois terços do anel da válvula mitral. Na comunicação
atrioventricular esta relação se inverte; o folheto
posterior (lateral esquerdo) constitui um terço e a
cúspide do bifolheto anterior (os folhetos superior e
inferior esquerdo conjuntos) contribuem com dois
terços do anel da válvula mitral.
Entretanto, do ponto de vista clínico, existem
formas parciais, intermediárias e completas de
comunicações atrioventriculares. Na forma parcial,
existe um tipo “ostium primum” de comunicação
interatrial. Aqui, as válvulas atrioventriculares estão
fixadas à crista do septo interventricular (e não existe
habitualmente comunicação interventricular abaixo
das válvulas). O folheto anterior da válvula mitral, que
apresenta uma fenda de grau variável, é atualmente
considerada como formando parte de uma válvula
mitral de três folhetos. Muito freqüentemente, esta
válvula mitral é competente, embora possa ocorrer
algum grau de insuficiência.
A forma intermediária é basicamente
semelhante à forma parcial da comunicação
atrioventricular. A principal característica diferencial é
a fixação incompleta das válvulas atrioventriculares ao
septo ventricular. Na realidade, podem existir algumas
fendas, podendo também estar presentes vários graus
de subdesenvolvimento dos tecidos dos folhetos.
A forma completa de comunicação AV é uma
comunicação no septo atrial inferior e ventricular
superior. A configuração e os detalhes da fixação dos
folhetos atrioventriculares ao septo ventricular são
bastante variáveis.
Comunicação AV tipo “ostium primum”
(AVC Parcial)
O tipo “ostium primum” de comunicação AV
constitui, de fato, parte do complexo da comunicação
AV, as vezes, citado como forma parcial do canal AV.
Clinicamente, detecta-se um grande “ostium primum”
que é habitualmente não restritivo, porém sempre
existe uma fenda de grau variável no folheto anterior
da válvula mitral. A válvula mitral nestes casos deve
ser considerada uma estrutura de três folhetos.
• Incisão: Todas as formas de defeito septal
atrial são geralmente abordadas através de
esternotomia mediana. Entretanto, alguns cirurgiões
preferem uma toracotomia direita por razões
cosméticas.
• Canulação: A aorta ascendente é canulada
de modo habitual. A veia cava superior é canulada
diretamente ou traves de auriculeta direita; do mesmo
modo a veia cava inferior é canulada através da
parede atrial logo acima da origem da veia cava
inferior. A seguir, são passado cadarços em torno de
ambas as veias cavas.
• Preservação miocárdica: Realiza-se a
parada cardioplégica fria do coração e mantêm-se
através de infusão de cristalóide gelada ou solução
cardioplégica sanguínea na raiz aórtica.
• Técnica: Realiza-se uma atriotomia ampla da
base da auriculeta direita próximo do local de
canulação o da veia cava inferior, paralelamente no
sulco AV. PS bordos da atriotomia são afastados com
suturas finas, às vezes almofadas. Deverá ser
cuidadosamente avaliada a presença e intensidade da
insuficiência mitral. Isto pode ser realizado através da
injeção simples forcada de salina através da válvula
mitral.
De modo alternativo, pode ser introduzida
uma bomba de aspiração no átrio esquerdo através de
um forâmen oval patente ou iatrogenicamente
introduzido. O aspirador pode ser utilizado para
manter o campo seco. Este cateter de sucção também
pode ser utilizado para a injeção de salina no
ventrículo esquerdo para detectar uma insuficiência da
válvula mitral. A fenda no folheto anterior da válvula
mitral é deixada se não existir insuficiência valvular.
Entretanto existe algum sopro de insuficiência que
pode ser corrigido com sucesso aproximando-se os
bordos que se “beijam” da fenda adjacente ao anel
com um ou dois pontos de Prolene 5-0
- Fechamento da fenda: deve-se
adotar cautela para aproximar apenas os
bordos que se “beijam” do tecido do folheto
que não são os mesmos dos bordos livres da
fenda. A incorporação adicional do folheto
para assegurar uma melhor correção levará
geralmente à uma insuficiência valvular
severa. Os bordos da fenda são fortes e
bastante fibrosados, principalmente em
pacientes mais idosos e, portanto, suportam
bem as suturas.
É rara a presença de insuficiência
valvular significativa no defeito do tipo “ostium
primum”. Entretanto, as vezes isto ocorre,
devendo realizar-se uma reconstrução
agressiva. Se o defeito do ostium primum é
pequeno e não permite completa visualização
da válvula, o defeito septal atrial deverá ser
ampliado em direção à fossa oval.
- Super correção da insuficiência
do folheto anterior: a tentativa exagerada
de se atingir a perfeição pode levar à
estenose mitral. Um grau leve de insuficiência
é bem tolerado e pode não ser clinicamente
detectado. Assim, não é necessário fechar
completamente a fenda na maioria dos
pacientes.
Quando completadas todas as
manobras para se avaliar a adequação da
correção da válvula mitral, o defeito septal
atrial é fechado com um retalho amplo de
pericárdio ou velour de Dacron. Inicia-se uma
sutura com Prolene 4-0 duplamente
agulhado, no anel próximo do folheto mitral
anterior, dando-se pontos profundos que
incorporem o retalho. A sutura prossegue em
sentido horário e anti-horário com pontos
pequenos no tecido do folheto mitral a 1 mm
do anel.
- Incorporação
do
folheto
tricúspide: para prevenir a possibilidade de
desenvolvimento ou agravamento da
insuficiência mitral, a sutura pode, de modo
alternativo, prosseguir a 1 mm distante do
anel comum incluindo o tecido do folheto
tricúspide. Se esta técnica é adotada, então a
sutura em sentido horário deve prosseguir em
torno do orifício do seio coronariano de tal
modo que ele drene sob o retalho no átrio
esquerdo para reduzir o risco de desenvolver
bloqueio cardíaco.
A sutura prossegue em todas as
direções até que os bordos da CIA primum
estejam incorporadas e o defeito é fechado
pelo retalho. As extremidades dos fios de
sutura são amarradas apos o enchimento do
átrio esquerdo com o retorno venoso
pulmonar, deslocando o ar loculado. Esta
manobra pode ser posteriormente realizada
através do forâmen oval se estiver sendo
utilizado para aspiração. O forâmen oval é
fechado em uma poça de sangue à medida
que o anestesista enche o átrio esquerdo e
inunda o sangue venoso pulmonar. A
atriotomia é, a seguir, fechada com uma
sutura contínua de Prolene 4-0. O processo
de remoção do ar é cuidadosamente
controlado e a pinça é removida. O dreno da
raiz aórtica é mantido aberto no campo ou
conectado à sucção até que ocorra uma
adequada ejeção dos ventrículos.
- Risco do tecido de condução: a
sutura profunda na área entre o anel
tricúspide e o seio coronariano é passível de
lesão do tecido de condução com produção
de bloqueio cardíaco.
Comunicação AV total
O fator mais crucial a se considerar na
realização da correção é a competência da válvula
mitral conseqüentemente, toda tentativa será realizada
para se avaliar a competência. O procedimento deve
seguir uma seqüencia definida.
• Canulação: É necessária uma exposição
máxima, e a canulação direta da veia cava superior e
do átrio direito ao nível da veia cava inferior é
obrigatória. Esta técnica mantém todas as cânulas
fora do campo e proporciona ao cirurgião uma boa
visão das válvulas. Esta técnica também previne uma
tensão indevida sobre o aparelho valvular. A
canulação aórtica é realizada de modo habitual.
A circulação extracorpórea é estabelecida e o
paciente é resfriado a 25° C; a solução cardioplégica
sanguínea é administrada na raiz aórtica tão logo a
aorta seja pinçada.
• Técnica: Após o aperto dos cadarços das
cavas, realiza-se uma atriotomia ampla desde logo
abaixo da auriculeta para baixo em direção à veia
cava inferior paralelamente ao sulco atrioventricular.
Os bordos da atriotomia são afastados com fios finos,
às vezes com almofadas de Teflon. Para proporcionar
uma exposição adicional utilizam-se pequenos
afastadores de folhetos. Avalia-se com precisão o
aspecto funcional e anatomia patológica.
Utiliza-se um ponto de reparo com Prolene 60 para aproximar os folhetos anterior esquerdo e
posterior (ou os folhetos superior e inferior esquerdo)
logo ao nível do septo ventricular, o que constitui um
ponto de referência para o estabelecimento do futuro
anel comum. O grau de competência da válvula
atrioventricular é avaliado através da injeção de uma
solução de salina sob pressão no ventrículo esquerdo,
sendo localização qualquer local específico de jato de
regurgitação. Toda tentativa será realizada no sentido
de se manter a configuração de três folhetos da
válvula atrioventricular esquerda. Entretanto, as vezes,
poderá ser necessário a divisão do folheto superior
esquerdo ou inferior esquerdo para uma melhor
exposição e, talvez, um fechamento mais seguro da
comunicação interventricular. Serão seccionadas
quaisquer fixações de cordoalhas secundarias ao
septo ventricular que possam interferir com o
fechamento da CIV. Um retalho de velour de Dacron
de dimensão apropriada, de forma semicircular, é
suturado com Prolene 5-0 ou 4-0 de duas agulhas à
face ventricular direita do septo ventricular e
reforçando com almofada de Teflon.
- Prevenção do bloqueio cardíaco:
a sutura do retalho ao septo ventricular deve
ser vem além da margem do defeito septal
ventricular de tal modo que não produza
qualquer lesão de condução. A tração
delicada do fio facilitará a sutura nas duas
direções até que sejam atingidos os folhetos.
As agulhas são passadas para dentro do
folheto e os fios são amarrados a novos fios
nestes pontos.
- Altura
do
retalho
septal
interventricular: a ressuspenção dos
folhetos das válvulas ao nível apropriado é
crítica. Assim, a altura do retalho do defeito
septal ventricular é da maior importância. Um
amplo
retalho
do
pericárdio
é
adequadamente determinado para cobrir a
comunicação interatrial. A linha de sutura que
cruza a válvula atrioventricular comum
incorporará o tecido do folheto bem como o
retalho de velour de Dacron utilizado para
fechar a comunicação interventricular. Uma
sutura contínua simples é utilizada se o
folheto não foi seccionado. Se o tecido do
folheto foi seccionado, deve-se tomar um
cuidado especial para incorporar ambos os
lados do tecido do folheto, isto é, tecido
valvular atrioventricular esquerdo e direito,
bem como o retalho de velour interventricular
e o retalho pericárdio interatrial.
- Deformação da anatomia do
folheto: a incorporação exagerada do tecido
do folheto atrioventricular na sutura ou no
reforço da linha de sutura com almofadas de
Teflon pode reduzir a largura do folheto e
levar a insuficiência da válvula. Uma vez
estabelecida a continuidade dos retalhos
ventricular e atrial, o retalho atrial é puxado
para a cavidade atrial direita e a válvula
atrioventricular é novamente testada quanto a
competência. Novamente injeta-se soro
fisiológico para revelar qualquer local
específico de jato regurgitante. Dependendo
do grau e local de insuficiência, poderá ser
necessária a colocação adicional de pontos
iniciando-se pela fenda entre os folhetos
superior e inferior. Também podem ser
utilizados pontos com almofada de Teflon nas
comissuras para realizar a anuloplastia mitral.
Algum fluxo central de regurgitação pode ser
sempre aceito, porém, todo esforço será
aplicado para se conseguir uma válvula mais
competente possível. O retalho pericárdico é
suturado aos bordos do defeito septal atrial,
deixando o seio coronariano de seu lado
esquerdo ou direito, dependendo da situação
anatômica. Isto realiza-se através de uma
sutura contínua de Prolene 5-0. Se o seio
coronariano ficar no átrio direito, deve-se
tomar o cuidado para a colocação de pontos
superficiais próximo do tecido de condução.
- Competência
valvular:
a
insuficiência valvular severa residual é muito
deletéria. As vezes, é melhor uma
supercorreção e produção de leve estenose
ao invés de aceitar uma severa insuficiência
da válvula mitral, o que poderá impor a
substituição da válvula mitral. Com a
operação próxima do final, o paciente é
aquecido e a atriotomia é fechada com uma
sutura contínua de Prolene 4-0. Realizam-se
todas as manobras para a remoção de ar e a
pinça aórtica é removida. O paciente é
gradualmente desmamado da circulação
extracorpórea.
Derivações da Direita para a Esquerda –
Cianose Precoce
Embora o DSV constitua a malformação
cardíaca congênita mais comum, a tetralogia de Fallot
representa a forma mais comum de cardiopatia
congênita cianótica. Outras anomalias encontradas
com relativa freqüência nessa categoria incluem a
transposição das grandes artérias, a atresia tricúspide,
a conexão venosa anormal total e o troco arterial. Com
ajuda mnemônica, observe que o nome de cada
entidade apresenta a letra T.
1. TETRALOGIA DE FALLOT
As quatro características da tetralogia de
Fallot são:
•
•
•
•
DSV
Obstrução do trato de efluxo ventricular
direito (estenose subpulmonar)
Aorta que se sobrepõe ao DSV
Hipertrofia ventricular direita.
Todas as característica resultam, a nível
embriológico, do deslocamento ântero-superior do
septo infundibular. Mesmo quando não tratados,
alguns pacientes com tetralogia sobrevivem
freqüentemente até a vida adulta. As conseqüências
clinicas da tetralogia de Fallot dependem,
primariamente, da gravidade da estenose
subpulmonar.
Morfologia
Com freqüência, o coração está aumentado e
pode assumir a forma de bota, devido à acentuada
hipertrofia do VD, particularmente da região apical. O
DSV costuma ser grande e aproxima-se ao diâmetro
do orifício aórtico. A valva aórtica forma a sua borda
superior, sobrepondo, assim, o defeito e ambas as
câmaras ventriculares. A obstrução do efluxo
ventricular direito é mais freqüentemente causada por
estreitamento do infundíbulo (estenose subpulmonar),
porém é freqüentemente acompanhada de estenose
valvar pulmonar. Algumas vezes, ocorre atresia
completa da valva pulmonar e de porções variáveis
das artérias pulmonares, de modo que o fluxo
sanguíneo através de um canal persistente e/ou de
artérias brônquicas dilatadas é necessário para a
sobrevida. Além disso, pode haver insuficiência valvar
aórtica ou DSA e observa-se um arco aórtico direito
em cerca de 25% dos casos.
A gravidade da obstrução ao efluxo
ventricular direito determina a direção do fluxo
sanguíneo. Se estenose subpulmonar for leve, a
anormalidade assemelha-se a um DSV isolado, e a
derivação pode ser da esquerda para a direita, sem
cianose (a denominada tetralogia rósea). À medida
que a obstrução aumenta de intensidade, verifica-se
uma resistência proporcionalmente maior ao efluxo
ventricular direito. À medida que se aproxima do nível
da resistência vascular sistêmica, predomina a
derivação da direita para a esquerda e, juntamente
com ela, ocorre cianose (tetralogia clássica). Com a
crescente gravidade da estenose subpulmonar, as
artérias
pulmonares
apresentam
paredes
progressivamente menores e mais delgadas
(hipoplásicas), enquanto o diâmetro da aorta torna-se
progressivamente maior. À medida que a criança se
desenvolve e o coração aumenta de tamanho, o
orifício pulmonar não sofre expansão proporcional,
agravando ainda mias a obstrução. Por conseguinte, a
maioria dos lactentes com tetralogia de Fallot
apresenta cianose desde o nascimento ou pouco
tempo depois. Entretanto, a estenose subpulmonar
protege a vasculatura pulmonar da sobrecarga de
pressão, e a insuficiência ventricular direita é rara,
visto que o ventrículo direito é descomprimido no
ventrículo esquerdo e na aorta.
Técnica de Correção
A esternotomia mediana proporciona
exposição excelente. O preparo para a circulação
extracorpórea é realizado através de canulação
aórtica e bicaval diretas. O paciente é resfriado a 24
ou 25°C. A aorta é pinçada e a parada cardioplégica
do coração é realizada através da infusão da
cardioplegia sanguínea na raiz aórtica. Os cadarços
em trono das veias cavas são apertados e realiza-se
uma pequena atriotomia direita. Um pequeno dreno
de aspiração é passado no átrio esquerdo através do
foramen oval patente, ou CIA (se presente) ou uma
abertura com bisturi iatrogenicamente induzida através
da fossa oval. A comunicação interventricular e a via
de saída ventricular direita são exploradas através da
válvula tricúspide. É possível, as vezes, fechar a CIV e
ressecar o músculo infundibular hipertrofiado através
do átrio direito. Entretanto, tradicionalmente uma
ventriculotomia direita proporciona uma exposição
excelente, constituindo a abordagem de escolha.
Realiza-se uma ventriculotomia direita vertical e os
bordos são retraídos com fios com almofadas. Uma
ventriculotomia transversal apresenta algumas
vantagens teóricas, principalmente quando uma
artéria coronária aberrante cruza a parede anterior do
ventrículo direito. Os feixes musculares infundibulares
hipertrofiados
são
agressivamente,
porém
cuidadosamente, excisados.
• Evitando as artérias coronárias: o defeito
ventricular é fechado com um retalho de Dacron
utilizando-se suturas contínuas ou pontos separados.
Toda precaução será tomada para se evitar a divisão
da artéria coronária aberrante. O defeito septal
ventricular torna-se, agora, visível. De um modo geral,
trata-se de um defeito amplo, perimembranoso,
subcristal. As margens do defeito são inspecionadas,
iniciando-se uma sutura com pontos separados de
Tevdek 4-0 com almofada de Teflon na posição de 12
horas ao longo da margem muscular de tipo eversão.
Ambas as agulhas são passadas através de um
retalho de velour de Dracon que é ligeiramente maior
que o defeito. Uma ligeira tração deste ponto pelo
assistente melhora a exposição e facilita a colocação
do ponto seguinte. A sutura prossegue deste modo em
sentido anti-horário ao longo da margem superior, a
qual recobre a válvula aórtica, até que a junção fibrosa
central do septo, raiz aórtica e o anel tricúspide sejam
alcançados. Ambas as agulhas dos pontos separados
com almofadas seguintes incorporam a margem
muscular da CIV, o retalho e o folheto tricúspide
(nesta ordem). Dependendo da consistência do folheto
tricúspide, as agulhas podem ser passadas através de
outra almofada de Teflon antes de serem amarrados.
O processo de sutura prossegue do ponto inicial em
direção horária, movendo-se para fora a uma distância
de 3 a 5 mm da margem da CIV para evitar o tecido
de condução subjacente. A alternativa técnica de se
realizarem pontos bem superficiais que incluam
somente endocárdio na região da margem inferior
também pode ser utilizada. Quando o anel tricúspide
torna-se parte da margem inferior da CIV, ambas as
agulhas da sutura com pontos separados dão
mordidas superficiais do endocárdio espessado, do
retalho, válvula tricúspide e outra almofada de Teflon.
Os pontos restantes são passados do átrio direito
através do folheto tricúspide a cerca de 2 mm do anel
antes de passar através do retalho. Quando todos os
pontos foram satisfatoriamente colocados, o retalho é
rebaixado em posição e os fios são amarrados justos.
De modo alternativo um retalho de velour de Dacron é
fixado com uma sutura contínua de Prolene através da
mesma técnica.
• Comunicação interventricular residual: os
bordos do retalho são cuidadosamente conferidos
quanto a uma CIV residual. Suturas adicionais
reforçadas com almofadas de Teflon são utilizadas
para o fechamento de qualquer CIV residual.
• Lesão da válvula aórtica: os folhetos da
válvula aórtica localizam-se imediatamente abaixo da
margem superior do defeito e podem ser puncionados
durante a sutura se forem utilizados pontos profundos
nesta área. Assim, a sutura nesta área deve
incorporar a crista marginal, a qual suporta bem as
suturas.
• Prevenção do bloqueio cardíaco: como já
assinalamos, o feixe de His penetra o corpo fibroso
centra e o anel tricúspide antes de cruzar para o septo
ventricular e seguindo um trajeto ao longo da margem
inferior em direção ao lado ventricular esquerdo do
septo. Como a sutura ao longo deste trajeto pode ser
perigosa e culminar com um bloqueio cardíaco, são
dados pontos superficiais incluindo apenas o
endocárdio esbranquiçado 3 a 5 mm da margem do
defeito.
• Suturas de transição: a junção onde o anel
tricúspide forma a margem do defeito é também muito
vulnerável a CIV residual. Um ponto transicional
incorporando um ponto superficial de endocárdio
espessado, o retalho e o folheto tricúspide proporciona
um fechamento mais seguro.
• Reforçando os pontos: o ponto de Prolene
pode seccionar o folheto tricúspide delgado e friável. A
linha de sutura pode ser reforçada com múltiplas
almofadas ou uma tira de feltro de Teflon. A
adequação da via de saída ventricular direita é
avaliada. A valvotomia pulmonar é realizada trazendose folhetos da válvula pulmonar para baixo na
ventriculotomia. Um ditador de dimensão apropriada é
passado na artéria pulmonar. Se existe qualquer
duvida acerca da adequação do anel pulmonar ou da
artéria pulmonar principal, utiliza-se um retalho de
pericárdio ou de Dacron para ampliar a via de saída
ventricular.
2. TRANSPOSIÇÃO DAS GRANDES
ARTÉRIAS
A transposição implica discordância
ventriculoarterial, de modo que a aorta se origina do
ventrículo direito, enquanto a artéria pulmonar emana
do ventrículo esquerdo. As conexões AV estão
normais (concordantes).
O defeito embriológico essencial na
transposição completa consiste na formação anormal
do tronco e septos aortopulmonares. A aorta originase do ventrículo direito e situa-se anteriormente e à
direita da artéria pulmonar; em contraste, no coração
normal, a aorta é posterior e situa-se a direita. O
resultado é a separação das circulações sistêmica e
pulmonar, uma condição incompatível com a vida pós
natal, a não ser que exista uma derivação para a
mistura adequada do sangue. Os pacientes com
transposição e DSV apresentam derivação estável.
Entretanto, aqueles que apresentam apenas um
forâmen oval persistente ou PCA apresentam
derivações instáveis, que tentem a se fechar, exigindo,
portanto, uma intervenção imediata para criar uma
derivação (como a septostomia atrial com balão) nos
primeiros dias de vida. A hipertrofia ventricular direita
torna-se proeminente, visto que essa câmara funciona
como ventrículo sistêmico. Concomitantemente, o
ventrículo esquerdo passa a ter paredes delgadas
(atróficas), por suportar a circulação pulmonar de
baixa resistência.
O prognóstico para lactentes com
transposição dos grandes vasos depende do grau de
mistura do sangue, da magnitude da hipóxia tecidual e
da capacidade do ventrículo direito de manter a
circulação sistêmica. Sem cirurgia, a maioria dos
pacientes morre nos primeiros meses de vida.
Tratamento Cirúrgico
A correção anatômica completa deveria,
teoricamente, constituir-se na abordagem ideal do
tratamento cirúrgico de pacientes com transposição
das grandes artérias. Em 1975, Janete realizou com
sucesso este procedimento, porém, a mortalidade
operatória permaneceu elevada. Nos últimos anos, a
operação da destransposicao arterial foi revista. A
mortalidade e a morbidez foram drasticamente
reduzidas devido à introdução de diversas manobras
cirúrgicas inovadoras, facilitando assim, a realização
de operação. Entretanto, o resultado excelente obtido
ainda não foi universalmente duplicado e os
procedimentos Mustard e Senning continuam como
procedimentos de eleição em diversos serviços. Aqui,
descreveremos o procedimento de Senning.
• Incisão: Tanto a toracotomia anterior direita
como a esternotomia mediana proporcionam uma
exposição satisfatória para a realização da operação
de Senning, embora a maioria dos cirurgiões prefira a
esternotomia mediada.
• Canulação: A face ântero-superior da aorta
ascendente é canulada de modo habitual. De um
modo geral, os candidatos a esse procedimento são
bebês com menos de 6 meses de idade e de peso
relativamente baixo. A operação é geralmente
realizada com CEC, hipotermia profunda e parada
circulatória total. Entretanto, alguns cirurgiões
preferem não utilizar a parada circulatória e realizar a
operação com hipotermia profunda e pressão de
perfusão muito baixa.
Uma cânula única através da auriculeta
direita será suficiente para iniciar a circulação
extracorpórea no preparo para a parada circulatória
total. Se esta não é planejada, as veias cavas superior
e inferior podem ser diretamente canuladas com as
cânulas de Rygg enquanto a criança está sendo
esfriada. O local da canulação da veia cava superior
deve ser o mais alto possível acima da junção
cavoatrial. As vezes, a canulação da cava implica em
alguma dissecção, o que pode interferir com o retorno
venoso e precipitar episódios de hipotensão ou
arritmia e levar à fibrilação ventricular. Portanto, a
seqüência da canulação é particularmente importante
uma vez que cada cava pode ser individualmente
canulada com o paciente já em CEC e o coração bem
descomprimido.
Uma sutura em bolsa de Prolene 5-0 é
aplicada às veias cavas superior e inferior e a cânula
de Rygg de dimensão apropriada é introduzida através
da técnica de Bayonet. O pinçamento da aorta na
maneira habitual seguida pela infusão da solução
cardioplégica fria leva à parada cardioplégica do
coração.
• Incisão atrial: O acesso ao interior do átrio
direito é realizado através de uma incisão longitudinal
realizada 3 a 4 mm anterior e paralela ao sulco
terminal.
• Comprimento da incisão: a incisão deve ser
bem afastada do nódulo sinoatrial e sua ampliação
cranial deve limitar-se 0.5 cm da margem superior do
átrio direito. Se é necessária uma ampliação adicional,
a incisão pode ser ventricularmente ampliada para a
auriculeta direita.
• Direção da incisão: somente após a
inspeção pelo cirurgião do interior do átrio direito é
que a incisão será caudalmente ampliada, de tal modo
que possa ser dirigida em direção à inserção lateral da
válvula da veia cava inferior (válvula de Eustáquio)
O Septo Atrial
A fossa oval é habitualmente lacerada se
ocorrer a realização anterior de uma septostomia por
balão. O retalho septal trapezóide é desenvolvido
iniciando pela porção mais anterior do foramen oval e
é cranialmente incisado a uma distância de cerca de 7
mm. A direção da incisão é dorsalmente modificada
em direção à margem superior da veia pulmonar
superior direita, ampliando-se para a base do septo
interatrial. Do mesmo modo, uma incisão da porção
inferior da fossa oval prossegue para baixo em direção
à margem inferior da veia pulmonar inferior direita. As
margens cruentas do septo são endotelizadas com
pontos separados de Prolene 5-0 superficiais e
aproximando endotélio a endotélio. Este retalho septal
átrio é conectado apensa em sua base, o que
corresponde no exterior do átrio ao sulco interatrial.
• Lesão da artéria do nódulo sinoatrial: a
artéria do nódulo sinoatrial cruza o quadrante ânterosuperior da parede medial do átrio direito. O
desenvolvimento do retalho septal atrial deve poupar o
suprimento vascular do nódulo sinoatrial não
desviando anteriormente a ampliação cranial da
incisão.
• Perfuração da parede medial do átrio
direito: do mesmo modo, a direção da ampliação
cranial no septo é significativa; se esta incisão é
anteriormente desviada em direção a saliência
muscular aórtica, ela pode levar o pericárdio por fora
do coração. Se isto ocorrer, ela deve ser
imediatamente detectada e o defeito reaproximado
com múltiplos pontos de Prolene fino.
• Tratos de condução preferenciais: existem
três principais tratos preferenciais de condução ou
faixas musculares reunindo o nódulo sinoatrial ao
nódulo atrioventricular. Estes provavelmente
correspondem crista terminal e feixes musculares
límbicos. O trato de condução anterior passa
anteriormente a fossa oval e ao seio coronariano. O
trato médio também localiza-se anteriormente à fossa
oval, porém pode passar através ou logo
posteriormente ao seio coronariano. O trato
preferencial posterior cruza a parede posterior do átrio
direito entre as veias cavas e curva-se para a frente
em direção ao seio coronariano. Durante o
desenvolvimento do retalho o trato mediano será
sacrificado na maioria dos casos. Deve-se tomar muito
cuidado para prevenir a lesão às outras vias de
condução.
O defeito no retalho da fossa é preenchido
através da sutura de uma peca de Dacron de
dimensão apropriada. A dimensão do retalho septal
atrial assim desenvolvido é muito constante,
possuindo uma base de cerca de 3 cm, uma altura de
2 cm e uma dimensão anterior de 1,5 a 2 cm em
bebês de 6 a 12 meses de idade.
• Dimensão inadequada do retalho: o retalho
de dimensão não adequada (e raramente o é), pode
ser ampliado através da sutura de uma peça de
Dracon de dimensão adequada através de uma sutura
contínua de Prolene 5-0.
• Laceração da fossa oval: um seguimento
da fossa oval é habitualmente aberto por laceração
devido à uma septostomia anterior por balão. É
também geralmente delgado e, as vezes, com orifícios
perfurantes. Este segmento deve ser excisado pois
pode lacerar-se na linha de sutura e produzir um
defeito no septo atrial recém construído.
O sulco interatrial é dissecado de modo a
liberar o melhor possível as paredes atriais
posteriores. A tração sobre o retalho trará à vista o
átrio esquerdo e as veias pulmonares. Realiza-se uma
incisão longitudinal logo paralela e posterior ao sulco
no átrio esquerdo.
• Abertura reduzida do átrio esquerdo: uma
incisão transversal pode ser feita para baixo na veia
pulmonar superior direita ou entre as veias
pulmonares superior e inferior direitas para assegurar
uma maior abertura do átrio esquerdo.
Retalho Septal
O retalho septal deve ser suficientemente
móvel para que possa ser ligeiramente rodado sem
causar qualquer tensão. O ponto médio da margem
anterior do retalho é suturado à parede atrial esquerda
por trás da auriculeta esquerda logo adiante de e entre
as veias pulmonares superior e inferior esquerdas
através de suturas contínuas de Prolene 5-0. A linha
de sutura prossegue superior e inferiormente ao longo
da parede posterior do átrio esquerdo até a base do
retalho.
• Obstrução das veias pulmonares
esquerdas: o retalho deve ser de dimensão adequada
ou permanecerá sob tensão, podendo levar à
obstrução das veias pulmonares esquerdas em seus
orifícios.
• Vazamentos nas linhas de sutura: a linha
de sutura deve ser controlada quanto a vazamentos
através de um gancho de nervo para prevenir
qualquer mistura de sangue no pós-operatório.
A Sutura do Bordo Anterior do Segmento
Posterior
O bordo anterior do seguimento
posterior do átrio direito é suturado à porção
anterior do defeito septal entre as válvulas
mitral e tricúspide. A sutura prossegue
superior e inferiormente em torno das
margens laterais dos orifícios das veias
cavas superior e inferior
• Lesão do nódulo atrioventricular: a linha
de sutura, quando prossegue para baixo em direção à
veia cava inferior, deve parras por baixo ou posterior
ao seio coronariano para evitar qualquer lesão ao
nódulo atrioventricular
• Obstrução da veia cava inferior: a porção
medial da válvula de Eustáquio da veia cava inferior,
quando bem desenvolvida, constitui um marco
importante pois significa o limite medial do orifício da
veia cava inferior. A aproximação do retalho da parede
atrial à margem medial da válvula de Eustáquio
assegura um cana de influxo adequado para a veia
cava inferior.
• Válvula de Eustáquio ausente ou
subdesenvolvida: se a válvula de Eustáquio está
ausente ou é subdesenvolvida, pode-se introduzir uma
cânula venosa de dimensão adequada através da
auriculeta esquerda e o recém construído defeito
septal atrial na veia cava inferior. O retalho da parede
atrial é suturado no local utilizando a cânula como um
molde. Esta cânula pode ser utilizada como um meio
de drenagem venosa durante a fase de aquecimento
do procedimento.
• Obstrução da cava: se a sutura invade os
orifícios das veias cava superior ou inferior, a
construção resultante pode levar à obstrução do
retorno venoso. Isto pode ser particularmente
problemático com a veia cava superior.
A Sutura do Bordo Posterior do Segmento
O bordo posterior do segmento anterior da
parede atrial direita é, a seguir, suturado à abertura
atrial esquerda e à parede atrial direita em torno do
canal caval.
• Lesão do nódulo sinoatrial: para prevenir a
lesão do nódulo sinoatrial, a sutura é realizada com
pontos separados 0,5 a 1 cm acima da junção
cavoatrial superior. Se o tempo constitui um fator
limitante, a sutura contínua com Prolene 6-0 ou 7-0
com pequenos pontos constitui uma técnica alternativa
• Constrição caval: os torniquetes são
afrouxados de tal modo que ambas as cavas tornamse cheias, completamente distendidas e tensas antes
de se prosseguir com a sutura. Isto prevenirá qualquer
constrição caval.
• Constrição da linha de sutura: para se
permitir espaço para o futuro crescimento, são
preferíveis as suturas com pontos separados (fios
absorvíveis como os de Vicryl ou PDS poderiam ser
utilizados como sutura contínua).
• Parede atrial direita inadequada: as vezes,
a porção anterior da parede atrial direita pode não ser
adequada para proporcionar um teto satisfatório sobre
a nova câmara de drenagem caval e permitir uma
aproximação confortável à abertura atrial esquerda.
Este problema pode ser superado através da adição
de um retalho de pericárdio ou de Dracon para ampliar
a parede atrial. Isto é particularmente útil quando os
átrios encontram-se justapostos. Nestes casos existe
sempre muito pouca parede atrial e ampliação com o
retalho torna-se obrigatória.
Embriologia
Durante
a
quinta
semana
do
desenvolvimento, a proliferação de células
mesenquimatosas nas paredes do bulbo cardíaco
resulta na formação das cristas bulbares. Formam-se
cristas semelhantes no tronco arterial, que são
contínuas com as cristas bulbares. As cristas truncais
e bulbares derivam, em grande parte, do mesênquima
da crista neural. As células da crista neural migram
pela faringe primitiva e pelos arcos faríngeos para
atingir as cristas. Quando isto ocorre, as cristas
bulbares e truncais passam por um movimento de
espiralização de 180°. A orientação espiralada das
cristas bulbares e truncais, possivelmente causada
pelo fluxo do sangue vindo dos ventrículos, resulta na
formação de um septo aorticopulmonar espiralado
quando as cristas se fundem. Este septo divide o
bulbo cardíaco e o tronco arterial em dois canais
arteriais, a aorta e o tronco pulmonar. Por causa da
espiralização do septo aorticopulmonar, o tronco
pulmonar gira em torno da aorta ascendente.
O bulbo cardíaco é incorporado pelas
paredes dos ventrículos definitivos:
• no ventrículo direito, o bulbo cardíaco é
representado pelo cone arterial (infundíbulo), que dá
origem ao tronco pulmonar.
• no ventrículo esquerdo, o bulbo cardíaco
forma as paredes do vestíbulo aórtico, a parte da
cavidade ventricular imediatamente inferior à válvula
aórtica.
Incisão
A esternotomia
abordagem de escolha.
mediana
constitui
a
Técnica
3. TRONCO ARTERIAL
A persistência do tronco arterial origina-se de
uma falha de desenvolvimento da separação do tronco
arterial embriológico em aorta e artéria pulmonar. O
resultado é uma única grande artéria que recebe
sangue de ambos os ventrículos, acompanhada de
DSV subjacente, dando origem às circulações
sistêmicas, pulmonar e coronária. Devido à mistura do
sangue dos ventrículos direitos e esquerdo, ocorre
cianose sistêmica precoce, bem como fluxo sanguíneo
pulmonar aumentando, com risco de hipertensão
pulmonar inoperável.
Realiza-se uma canulação aórtica alta. Uma
canulação atrial única é adequada se uma parada
circulatória total é planejada. Alguns cirurgiões
preferem a canulação direta da veia cava superior e
uma canulação atrial baixa logo acima da veia cava
inferior. A anatomia é bem avaliada e a aorta e as
artérias pulmonares são dissecadas e mobilizadas.
São passados cadarços em torno das artérias
pulmonares de tal modo que possam ser ocluídos logo
antes do início da circulação extracorpórea.
• Oclusão da artéria pulmonar: é essencial a
dissecação da artéria pulmonar e ambos os ramos de
modo bastante liberal para assegurar a mobilidade
máxima para que possam ser apertadas com
torniquete e ocluídas tão logo iniciada a circulação
extracorpórea, caso contrário, a infusão da solução
cardioplégica inundará os pulmões, mesmo após a
aorta ser pinçada.
Inicia-se a circulação extracorpórea e o
paciente é esfriado a 20°C. O esfriamento tópico é
também utilizado.
• Insuficiência da válvula truncal: a
insuficiência da válvula do tronco constitui um grave
fator complicador. A aorta deve ser imediatamente
pinçada para se prevenir a superdistensão ventricular.
A solução cardioplégica pode ter que ser administrada
diretamente nas artérias coronárias. A aorta é pinçada
e a solução cardioplégica é administrada de modo
habitual. Os cadarços cavais são apertados; realiza-se
uma pequena atriotomia direita e a solução
cardioplégica é eliminada através de aspiração. Um
pequeno aspirador é passado no átrio esquerdo
através do foramen oval patente para manter seco o
campo. O tronco da artéria pulmonar é destacado da
artéria troncular e o defeito é fechado com duas
camadas de sutura contínua com Prolene 5-0.
• Defeito muito grande na aorta: se o defeito
é muito grande e o fechamento direto da artéria do
tronco (agora aorta) levará a uma estenose
supravalvular, utiliza-se um retalho de Dracon de
dimensao apropriada para fechar o defeito.
Realiza-se ventriculotomia direita longitudinal
alta e identifica-se uma comunicação interventricular
alta. Habitualmente a comunicação é do tipo
infundibular subarterial com uma margem inferior
espessa. Por outro lado, pode ser do tipo
perimembranosa ampla estendendo-se para a
margem da válvula tricúspide.
• Ramos anormais da artéria coronariana: a
ventriculotomia deve procurar poupar qualquer artéria
coronária importante na superfície do ventrículo
direito. A artéria coronária descendente anterior
esquerda encontra-se especialmente em risco quando
sua origem é da coronária direita.
A comunicação interventricular é, a seguir,
fechada com sutura de Prolene 4-0 contínua com
pontos profundos que incorporam uma dupla camada
de retalho de velour de Dacron. Os bordos superiores
do retalho devem adaptar-se ao bordo superior da
ventriculotomia e ser incorporados na linha de sutura
do conduto ventricular direito-artéria pulmonar. O ar
deve ser removido da raiz aórtica e a aorta
desclampeada, abreviando assim, o tempo de
isquemia.
De modo ideal, o homoenxerto é utilizado
como conduto, porém um conduto Hancock ou
Ionesco-Shiley de 12 mm também é funcionalmente
muito bom. A realização da anastomose com um
homoenxerto é muito mais fácil do que com um
enxerto sintético; vazamentos anastomóticos são
raros. Além disso, a válvula do homoenxerto é muito
maior.
• Dimensão correta do conduto: um conduto
Hancock de 12 mm é amplo para um bebê, não
devendo ser utilizado um conduto muito grande.
A artéria pulmonar distal é adequadamente
adaptada. Utilizam-se quatro fios de tração em sua
adventícia para manter a luz aberta.
• Luz muito pequena da artéria pulmonar: a
luz da artéria pulmonar pode ser ampliada através da
extensão da abertura de ambos os seus ramos.
O comprimento do conduto pré-coagulado é
adequadamente seccionado e anastomosado à artéria
pulmonar com fio Prolene 3-0. A camada posterior da
anastomose é inicialmente completada.
• Vazamentos anastomóticos da parede
posterior: uma vez completada a operação é
praticamente impossível de se controlar um
vazamento anastomótico da parede posterior. Por esta
razão, devem ser feitos pequenos pontos próximos
entre si.
A seguir, completa-se a anastomose distal
anterior. O conduto proximal é adequadamente
seccionado em um ângulo oblíquo, realizando-se uma
incisão longitudinal ao longo de sua face posterior, o
qual é a seguir anastomosado ao ventrículo direito
com sutura contínua de Prolene 3-0 reforçada com
uma longa tira de feltro de Dacron. Na margem
superior da anastomose, o fechamento com retalho da
comunicação interventricular é incorporado à linha de
sutura.
• Dimensão e posição do conduto: a
localização e o comprimento do conduto devem ser
precisos. O erro deve ser sempre em relação a
escolha de um conduto muito grande.
Atualmente estão disponíveis homoenxertos
de aorta e artéria pulmonar com ramos da artéria
pulmonar sendo provavelmente, superiores aos
condutos com válvulas biológicas. Entretanto, devido
às discrepâncias de comprimento, poderá ser
necessária a extensão da conexão do homoenxerto
ventricular direito com um retalho do pericárdio ou
Dracon como uma cobertura sobre a anastomose.
Quando completo o procedimento o aspirador
é removido do foramen oval o qual é, a seguir,
fechado por sutura. A atriotomia direita é também
fechada e os cadarços das cavas são removidos.
Quando o paciente é aquecido, realiza-se
meticulosamente o processo de remoção do ar e o
paciente é gradualmente desmamado da circulação
extracorpórea à medida questão fixados os fios de
marcapasso ao ventrículo e átrio direitos para o uso
profilático de marcapasso. São inseridos drenos
torácicos e a esternotomia é fechada de modo
habitual.
• Pressão sobre o conduto: o conduto deve
repousar de tal modo que não seja comprimido ou
ocluído pelo esterno fechado
Anomalias que causam obstrução
Pode ocorrer obstrução congênita do fluxo
sanguíneo a nível das valvas cardíacas ou no interior
de um grande vaso. Exemplos relativamente comuns
incluem a estenose da valva pulmonar, a estenose ou
atresia da valva aórtica e a coarctação da aorta. A
obstrução também pode ocorrer no interior de uma
câmara cardíaca, no caso da estenose subpulmonar
na tetralogia.
1. COARCTAÇÃO DA AORTA
A coarctação (estreitamento, constrição) da
aorta ocupa uma das primeiras posições quanto à sua
freqüência entre as anomalias estruturais comuns.
Foram descritas duas formas clássicas: (1) uma forma
infantil, com hipoplasia tubular do arco aórtico
proximal a um PCA, que é quase sempre sintomático
no início da infância, e (2) uma forma adulta, em que
existe um discreto pregueamento semelhante a uma
crista na aorta, exatamente oposto ao canal arterial
fechado (ligamento arterial). A obstrução da luz da
aorta é de gravidade variável, deixando, algumas
vezes, apenas um pequeno canal ou produzindo
apenas estreitamento mínimo. As manifestações
clínicas dependem quase totalmente da gravidade do
estreitamento e da persistência do canal arterial.
Embora a coarctação possa ocorrer como defeito
solitário, ela é acompanhada de valva aórtica
bicúspide em 50% dos casos e também pode estar
associada a estenose aórtica congênita, DSA, DSV,
regurgitação mitral e aneurisma de Berry do círculo de
Willis.
A coarctação com PCA geralmente resulta
em manifestações no início da vida, podendo causar
sinais e sintomas logo após o nascimento. Muitos
lactentes com essa anomalia não sobrevivem durante
o período neonatal sem intervenção cirúrgica. Nesses
casos, a liberação de sangue não saturado através do
canal arterial produz cianose localizada na metade
inferior do corpo.
O prognóstico é diferente na coarctação sem
PCA, a não ser que seja grave. As crianças são, em
sua maioria, assintomáticas, e a doença pode não ser
detectada até a vida adulta. Tipicamente, ocorre
hipertensão nas extremidades superiores; entretanto,
são observados pulsos fracos e menor pressão arterial
nas extremidades inferiores, associada a
manifestações de insuficiência arterial (i.e.,
claudicação e sensação de frio). Nos adultos, é
particularmente característico o desenvolvimento de
circulação colateral entre os ramos arteriais précoarctação e as artérias pós-coarctação através de
artérias mamárias internas e intercostais aumentadas,
havendo
erosões
radiograficamente
visíveis
(chanfradura) das superfícies inferiores das costelas.
Como todas as coarctações significativas, é
freqüente a presença de sopros durante toda a sístole
e, algumas vezes, pode haver um frêmito. Ocorre
cardiomegalia devido à hipertrofia ventricular
esquerda.
Anatomia Cirúrgica
A coarctação da aorta na cavidade torácica
compromete a junção do arco aórtico, aorta
descendente e canal arterioso na maioria dos
pacientes. Entretanto pode ocorrer um qualquer altura
do trajeto da aorta.
O nervo esquerdo penetra na cavidade
torácica pela raiz do pescoço entre as artérias
subclávia esquerda e carótida comum esquerda, cruza
o arco aórtico e prossegue para baixo medialmente à
aorta descendente, atravessando o ligamento
arterioso. O nervo laríngeo recorrente tem sua origem
no nervo vago, curva-se para cima para o pescoço.
Pode existir uma dilatação pós-estenótica logo distal a
coarctação. Em pacientes mais idosos a dilatação
pós-estenótica pode ser mais acentuada, podendo
existir intenso aumento dos vasos colaterais próximo
do ombro e músculos dorsais. Isto pode incluir as
aterias intercostais, cujas paredes podem ser
delgadas como papel e friáveis.
Incisão
A coarctação da aorta pode se
adequadamente exposta através de uma toracotomia
lateral posterior esquerda no quarto espaço
intercostal.
Exposição da Coarctação
Os bebês com coarctação isolada ou com
anomalias cardíacas associadas podem apresentar
uma insuficiência ventricular esquerda e refratária às
formas habituais de tratamento clínico. A infusão da
prostaglandina E1 pode manter o canal aberto e,
assim, melhorar o fluxo sanguíneo renal e a perfusão
dos tecidos. Esta redução na pós-carga pode melhorar
a função ventricular esquerda e com uma pressão
arterial reduzida para 100 a 110 mmHg as pinças
podem ser mais seguramente aplicadas e a
anastomose pode ser realizada com mais segurança.
O pulmão esquerdo é afastado para baixo e
medialmente. A pleura parietal é incisada
longitudinalmente sobre a artéria subclávia esquerda e
aorta torácica descendente através do segmento da
coarctação. Os bordos pleurais são suspensos. A
artéria subclávia esquerda e a aorta descendente são
amplamente mobilizadas da raiz do pescoço até a
uma distância bem abaixo da coarctação. Os cadarços
são passados em torno da aorta e artéria subclávia
para facilitar a exposição.
• Proteção dos nervos vago e laríngeo
recorrente: o nervo vago e seu ramo laríngeo
recorrente são passiveis de lesão durante a
mobilização.
• Artérias intercostais dilatadas: as artérias
intercostais dilatadas podem apresentar paredes
extremamente delgadas e causar um incômodo
sangramento se traumatizadas.
• Sangramento dos ramos aórticos: as
artérias brônquicas podem originar-se da superfície
posterior da aorta subclávia esquerda. Elas podem ser
inadvertidamente laceradas durante a mobilização e
dissecção, levando a sangramento.
Coartectomia
Sempre que possível, a coartectomia é o
procedimento de escolha. Ela promove a remoção dos
segmentos estenosados e hipoplásicos da aorta entre
a artéria subclávia e a coarctação em crianças
maiores e do tecido anormal do canal arterial em
recém-nascidos. O canal arterial (se presente) ou o
ligamento é dividido para dar mobilidade adicional à
aorta. O segmento coarctado é excisado entre pinças
e a aorta é anastomosada com fios Prolene (5-0 para
crianças maiores e 7-0 em recém-nascidos) para
estabelecer a continuidade. Será mas útil uma
combinação de pinças atraumáticas reta e em forma
de colher com um aproximador. Isto permite que as
pinças permaneçam imóveis enquanto as
extremidades da aorta são anastomosadas sem
tensão. O campo operatório não é obscurecido pelas
mãos do assistente; este é um ponto importante
principalmente em recém-nascidos.
Angioplastia com Retalho da Subclávia
Este procedimento é principalmente indicado
no recém-nascido. A artéria subclávia esquerda é bem
mobilizada até a origem de seus ramos na raiz do
pescoço. Todos os ramos são ligados e a artéria
subclávia esquerda é longitudinalmente incisada para
baixo ao longo da aorta bem adiante do segmento
coarctado. Sempre que presente uma crista de
coarctação proeminente, ela deverá ser excisada. A
artéria subclávia é seccionada ao nível de seus ramos,
dobrada para baixo e suturada na incisão aórtica
como retalho com das suturas contínuas de
Polidioxaon.
• Síndrome do roubo da subclávia: a artéria
vertebral deve ser identificada e ligada separadamente
para eliminar a possibilidade de desenvolvimento da
síndrome do roubo da subclávia
• Ressecção da crista de coarctação: a
crista na luz da aorta deve ser excisada, mas não de
modo muito profundo ao ponto de enfraquecer a
parede aórtica posterior. Qualquer perfuração deve
ser suturada com Prolene fino amarrado pelo lado de
fora.
• Artéria subclávia curta: uma artéria
subclávia muito curta não alcançará para além do
segmento coarctado, deixando uma estenose residual.
Por outro lado, a cicatrização com sua fibrose
resultante dará origem a recoarctação.
• Estenose distal: o bico da anastomose deve
situar-se pelo menos a 8 ou 10 mm distalmente do
local da coarctação, pois caso contrário, a cicatrização
e conseqüente fibrose dará origem a recoarctação.
• Posicionamento do retalho da artéria
subclávia: de modo ideal, o retalho da artéria
subclávia deve abaular-se simetricamente sobre a
coarctação. Uma torção na base do retalho sugere
que foi aplicada tensão excessiva ao retalho subclávio
em um esforço em um esforço para descê-lo
suficientemente abaixo do segmento coarctado.
• Incisão da artéria subclávia e aorta: a linha
de incisão na artéria subclávia e aorta deve ser reta.
Qualquer desvio interferirá com uma anastomose
satisfatória.
Angioplastia com Enxerto Protético em
Forma de Diamante
Coarctação Complexa
• Enxerto Tipo Ponte Subclávia Esquerda
Aórtica
Em pacientes com recoarctação complexa,
coarctação de segmento longo ou coarctação
associada a um arco aórtico hipoplásico, pode
ser preferível um procedimento de desvio. Isto
pode ser realizado anastomosando-se um
enxerto em tubo de dimensão apropriada na
artéria subclávia esquerda e na aorta torácica
descendente.
- Artéria subclávia muito pequena: a artéria
subclávia deve ser bem volumosa, de dimensão
comparável a da aorta torácica descendente,
para evitar a persistência de qualquer gradiente
através das duas anastomoses. Não importando
o tamanho do enxerto tubular empregado, a luz
da artéria subclávia constitui o fator limitante do
fluxo através do enxerto. Portanto, se a artéria
subclávia não é de dimensão adequada, a
anastomose proximal deve incorporar o arco
aórtico normal distal à origem da artéria carótida
comum esquerda.
Enxerto Tipo Ponte da Aorta AscendenteDescendente
Nos grupos selecionados cujo arco aórtico é
hipoplásico ou nos quais a dissecção próxima do
arco é perigosa devido à cirurgia prévia, o
enxerto de desvio da aorta torácica ascendente
para a descendente constitui uma alternativa
razoável.
O procedimento compreende duas incisões
diferentes. Inicialmente, através de uma
toracotomia esquerda, um longo enxerto tubular
com uma luz de dimensão adequada, é
anastomosada à aorta torácica descendente de
modo término-lateral. Após a heparinização
sistêmica mínima, o coto distal do enxerto em
tubo é suturado e o mesmo deixado no
mediastino superior anterior, cruzando o hilo do
pulmão esquerdo.
O tórax é fechado e o paciente reposicionado
para uma esternotomia mediana e exposição da
aorta ascendente. A pleura esquerda é aberta e
o enxerto tubular é visualizado, seccionado e
anastomosado à aorta ascendente de modo
término-lateral.
- Coagulação do sangue no enxerto tubular: as
vezes, o sangue pode coagular no enxerto em
tubo, principalmente se a heparinização não é
adequada e se for muito prolongado o intervalo
entre a realização das duas anastomoses. O
coágulo é suavemente ordenhado para fora do
tubo antes de anastomosá-ló à aorta
ascendente.
•
Se o segmento da coarctação é muito longo,
poderá não ser exeqüível a coarctemia com
anastomose término-terminal ou angioplastia com
retalho subclávio. Uma alternativa à interposição ou
desvio com enxerto tubular é cobrir o defeito com um
retalho protético. Este procedimento é igualmente útil
nos casos de reoperação de coarctação da aorta.
A aorta é pinçada acima e abaixo do
segmento de coarctação como acima descrito. A aorta
é longitudinalmente incisada através da lesão. A crista
proeminente da coarctação é, a seguir, excisada
tomando-se as precauções habituais. Um retalho
protético amplo, em forma de diamante de dimensão
apropriada é suturado com suturas finas contínuas de
Prolene aos bordos aórticos.
- Lesão da medula espinhal: a lesão da
medula espinhal sempre é possível quando a aorta é
pinçada transversalmente. Portanto, o tempo de
pinçamento deverá ser o menor possível.
- Artérias
intercostais
e
colaterais
dilatadas: as artérias intercostais e colaterais em
pacientes mais idosos podem estar dilatadas e
facilmente laceradas, dando origem a um
sangramento incômodo. Portanto, é essencial uma
dissecção delicada.
- Recoarctação: a recoarctação pode ocorrer
à medida que a aorta cresce. Por esta razão, é
necessário que o retalho protético em forma de
diamante seja bem amplo, resultando em um
abaulamento redundante sobre a coarctação. Um
retalho esteticamente satisfatório freqüentemente leva
a recoarctação.
- Torção do enxerto: a torção do enxerto interfere
com seu fluxo normal. O enxerto deve situar-se
como uma curva natural folgadamente anterior
ao hilo do pulmão esquerdo e deve unir-se
obliquamente com a aorta ascendente.
- Prevenção de abaulamento anterior: o enxerto
deve ser anastomosado à aorta ascendente um
pouco à esquerda da linha média lateralmente do
modo oblíquo para prevenir um grande
abaulamento anterior, o qual pode interferir com
o fechamento esternal.