1. Compostos iônicos são aqueles que apresentam ligação iônica. A ligação iônica é a ligação
entre íons positivos e negativos, unidos por forças de atração eletrostática.
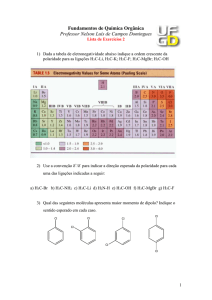
(Texto adaptado de: Usberco, João e Salvador, Edgard, Química: química geral, vol 1, pág 225,
Saraiva, 2009).
Sobre as propriedades e características de compostos iônicos são feitas as seguintes
afirmativas:
I. apresentam brilho metálico.
II. apresentam elevadas temperaturas de fusão e ebulição.
III. apresentam boa condutibilidade elétrica quando em solução aquosa.
IV. são sólidos nas condições ambiente (25 C e 1 atm).
V. são pouco solúveis em solventes polares como a água.
Das afirmativas apresentadas estão corretas apenas
a) II, IV e V.
b) II, III e IV.
c) I, III e V.
d) I, IV e V.
e) I, II e III.
2.
Considere que os átomos dos elementos X e Z apresentam, respectivamente, os
seguintes conjuntos de números quânticos para seus elétrons de diferenciação:
Átomo X : n 4;l 0;m 0;s 1 2
Átomo Z : n 5;l 1;m 0;s 1 2
(Convenção do spin do 1º elétron 12)
Qual é a afirmativa correta?
a) O elemento X é um metal alcalino e o elemento Z é um gás nobre.
b) Os números atômicos dos elementos X e Z são, respectivamente, 30 e 51.
c) O elemento X possui 2 elétrons de valência e o Z possui 5 elétrons.
d) A fórmula do composto formado por átomos de X e Z é XZ 2 .
3.
O principal componente do sal de cozinha é o cloreto de sódio. Este composto se
apresenta no estado sólido nas condições ambientes (temperatura de 25C e pressão de
1atm) em decorrência das fortes atrações que se estabelecem entre seus cátions e ânions.
Quando dissolvido em água, são rompidas as ligações químicas
a) dativas.
b) iônicas.
c) metálicas.
d) covalentes.
4. Levando em conta as ligações e interações que ocorrem entre átomos e moléculas, dentre
as substâncias abaixo, a que possui maior ponto de fusão é
a) H2O
b) CO2
c) CaC 2
d) C6H12O6
e) C12H22O11
5. Desde os primórdios da humanidade, há uma busca por entender questões acerca da
origem, do funcionamento e da organização do Universo. Na tentativa de propor explicações,
os cientistas elaboram modelos. Considerando que as propriedades físico-químicas da matéria,
os tipos de ligações e as geometrias moleculares podem ser explicados por meio de modelos
atômicos, modelos de ligações e modelos de moléculas, relacione a coluna da esquerda com a
da direita.
II. A água é uma substância molecular,
polar
e
considerada
solvente
universal.
III. O benzeno é uma substância apolar
e líquida em temperatura ambiente.
A. Geometria linear, ligação covalente e
forças intermoleculares do tipo dipolodipolo.
B. Geometria linear, molécula apolar e forças
intermoleculares do tipo dipolo-induzido
dipolo-induzido.
C. Composto aromático e forças do tipo
dipolo-induzido dipolo-induzido.
IV. O HC é um gás em temperatura
ambiente.
D. Alto ponto de fusão e ebulição, composto
formado por ligação iônica.
V. O CO2 é um gás em temperatura
ambiente.
E. Ligações de hidrogênio e geometria
angular.
I. O NaC é um sólido em temperatura
ambiente.
Assinale a alternativa que contém a associação correta.
a) I-B, II-A, III-C, IV-E, V-D.
b) I-B, II-A, III-E, IV-D, V-C.
c) I-D, II-C, III-E, IV-B, V-A.
d) I-D, II-E, III-C, IV-A, V-B.
e) I-C, II-E, III-B, IV-A, V-D.
6. Analise o texto a seguir.
Durante o verão, verificam-se habitualmente tempestades em muitas regiões do Brasil. São
chuvas intensas e de curta duração, acompanhadas muitas vezes de raios. No litoral, essas
tempestades constituem um risco para os banhistas, pois a água salgada é eletricamente
condutora. Isso se explica pelo fato de a água salgada conter grande quantidade de
__________, como Na e C , livres para transportar carga elétrica no meio. Uma maneira de
liberar essas partículas é dissolver sal de cozinha em um copo de água. Nesse processo, os
__________ existentes no sal sofrem __________.
As expressões que completam corretamente o texto são, respectivamente:
a) átomos – cátions e ânions – ionização
b) átomos – átomos e moléculas – dissociação
c) íons – elétrons livres – hidrólise
d) íons – cátions e ânions – dissociação
e) moléculas – átomos e moléculas – ionização
7. Em uma aula prática, um béquer com uma solução concentrada de ácido nítrico foi deixado
próximo a outro contendo hidróxido de amônio. Entre os béqueres, foi observada a formação
de uma fumaça branca que se depositou sobre a bancada. Sobre o sólido branco obtido,
afirma-se, corretamente, que
a) é insolúvel em água.
b) possui caráter básico.
c) apresenta N com número de oxidação 3 e 5.
d) tem temperatura de ebulição menor que o HNO3.
e) resulta da condensação do NH4OH e evaporação do HNO3.
TEXTO PARA A PRÓXIMA QUESTÃO:
Analise a reação abaixo:
HC NaOH NaC H2O
8. Considerando o produto da reação, o NaC, assinale a alternativa correta.
NOTA:
2
Distribuição
2
6
2
eletrônica
Na : 1s2 , 2s2 , 2p6 , 3s1.
do
Distribuição
eletrônica
do
5
C : 1s , 2s , 2p , 3s , 3p .
a) O sal formado é um hidrogeno-sal.
b) A reação de formação do sal é do tipo de decomposição.
c) A ligação intramolecular no NaCl é do tipo iônica.
d) O NOX do C é 5.
e) O NaCl é formado em uma reação de neutralização parcial.
9. Um elemento ―A‖, de número atômico 20, e outro ―B‖, de número atômico 17, ao reagirem
entre si, originarão um composto
a) molecular de fórmula AB2.
b) molecular de fórmula A2B.
c) iônico de fórmula AB.
d) iônico de fórmula AB2.
e) iônico de fórmula A2B.
10. O fluoreto de sódio é um haleto alcalino muito utilizado na prevenção de cáries e pode ser
obtido a partir da reação do ácido fluorídrico com carbonato de sódio.
O tipo de ligação química existente entre o sódio e o flúor é:
a) Covalente apolar
b) Dipolo-dipolo
c) Covalente polar
d) Metálica
e) Iônica
11. Água dura é aquela que contém concentrações relativamente altas de íons Ca2 e Mg2
dissolvidos. Apesar de esses íons não representarem risco para a saúde, eles podem tornar a
água imprópria para alguns tipos de consumo doméstico ou industrial. Objetivando reduzir a
concentração de íons Ca2 e Mg2 de uma amostra de água dura ao mínimo possível, um
técnico em química testou os seguintes procedimentos no laboratório:
I.
Decantação
da
II.
Filtração
da
III. Aquecimento da amostra de água.
IV.
Adição
do
solvente
orgânico
V.
Adição
de
CaO
e
amostra
amostra
CC 4
Na2CO3
de
de
à
à
amostra
amostra
água.
água.
de
de
água.
água.
BROWN, T. L. et al. Química, a ciência central. São Paulo: Pearson Prentice Hall, 2005
(adaptado).
O método considerado viável para tratar a água dura e aumentar seu potencial de utilização é
o(a)
a) decantação, pois permite que esses íons se depositem no fundo do recipiente.
b) filtração, pois assim os íons Ca2 e Mg2 são retidos no filtro e separados da água.
c) aquecimento da amostra de água, para que esses íons sejam evaporados e separados.
d) adição do solvente orgânico CC 4 à amostra, para solubilizar esses íons e separá-los da
água.
e) reação química com CaO e Na2CO3 , para precipitar esses íons na forma de compostos
insolúveis.
12. O sal de cozinha é considerado tanto mocinho quanto vilão para o nosso organismo, se
ingerido em quantidades acima do recomendado, pode causar vários danos ao nosso
organismo, o mesmo acontece quando em quantidades muito abaixo do recomendado.
Sobre este composto é CORRETO afirmar:
a) É formado por uma mistura de sódio e cloro.
b) Na temperatura ambiente, também pode ser encontrado no estado gasoso.
c) Misturado com a água forma, o soro fisiológico (em proporção apropriada), que pode ser
utilizado como medicamento para o organismo humano.
d) Não causa danos ao organismo humano em hipótese alguma.
e) É encontrado somente na água do mar.
TEXTO PARA A PRÓXIMA QUESTÃO:
Toneladas de lixo são lançadas todos os dias nos lixões, terrenos onde o lixo fica amontoado
ao ar livre, sem nenhum cuidado. A matéria orgânica em decomposição atrai ratos, baratas,
moscas, mosquitos e outros transmissores de organismos que nos causam doenças (vírus,
bactérias, protozoários, fungos). Ela também produz um caldo negro malcheiroso – o chorume.
No chorume podem ser encontrados, além de matéria orgânica, produtos tóxicos como o
chumbo e o mercúrio, que se originam de tintas, solventes, pilhas, lâmpadas fluorescentes etc.‖
(In: GEWANDSNAJDER, F. Ciências – Planeta Terra. São Paulo:Ática, 2012, 1ªed. p.95)
O óxido de chumbo e o óxido de mercúrio, substâncias tóxicas, têm fórmulas PbO2 e
HgO, respectivamente. Sabendo-se que o número atômico do oxigênio é 8, podemos concluir
que:
a) o chumbo é tetravalente e o mercúrio é divalente.
b) o chumbo é divalente e o mercúrio é monovalente.
c) o mercúrio é divalente e o oxigênio é monovalente.
d) o chumbo é monovalente e o mercúrio é tetravalente.
13.
14.
Tendo como base a reação química entre o átomo de sódio e o átomo de cloro para
formar os íons Na e C – , assinale a(s) alternativa(s) correta(s).
01) Supondo que o raio atômico do sódio seja X e o raio atômico do cloro seja Y, a distância da
+
ligação química entre Na e C – no cloreto de sódio será obrigatoriamente X+Y.
02) O átomo de sódio é maior do que o átomo de cloro, no entanto o íon sódio é menor do que
o íon cloro.
04) A regra do octeto é respeitada nos íons sódio e cloro do NaC, mas não é respeitada para
o boro no BF3.
08) Sais formados entre metais alcalinos e halogênios apresentarão, para ambos os íons, uma
2 6
+
camada de valência do tipo s p , exceto o Li .
16) A quantidade de energia envolvida na segunda ionização do sódio é de valor
aproximadamente igual ao envolvido na primeira ionização.
+
15. O dióxido de zircônio se assemelha ao diamante, uma forma alotrópica do carbono,
podendo substituí-lo na confecção de joias de baixo custo.
Escreva a fórmula química do dióxido de zircônio, classifique o tipo de ligação interatômica
dessa substância e nomeie um dos outros alótropos do carbono.
16. No Laboratório de Química, um professor disponibilizou as seguintes substâncias:
I.
II.
III.
IV.
O3
NaI
KNO3
NH3
V.
VI.
VII.
VIII.
Ca(OH)2
HCN
CO2
Li2O
Os compostos formados somente por ligações iônicas são
a) I e VII.
b) II e VIII.
c) III e V.
d) IV e VI.
17. Analise as equações químicas a seguir, que ocorrem em meio aquoso.
HC (A) AgNO3 (B) AgC (C) H (aq) NO3 (aq)
NaHCO3 (D) HC (aq) Na (aq) H2O() CO2 (E)
Os compostos, cujos estados de agregação estão representados pelas letras A, B, C, D e E,
são, respectivamente,
a) um eletrólito forte, um composto solúvel, um composto insolúvel, um sólido iônico e um gás.
b) um eletrólito fraco, um composto solúvel, um sólido iônico, um gás e um composto insolúvel.
c) um eletrólito forte, um composto insolúvel, um composto insolúvel, um sólido iônico e um
gás.
d) um eletrólito fraco, um composto insolúvel, um sólido iônico, um composto solúvel e um gás.
e) um eletrólito fraco, um composto insolúvel, um composto solúvel, um sólido iônico e um gás.
18. Considere o esquema a seguir.
Em relação às situações apresentadas, afirma-se, corretamente, que em
a) I a lâmpada está acesa, devido à capacidade de condução de calor.
b) II a lâmpada está apagada, porque o açúcar é insolúvel na água.
c) II a lâmpada está apagada, pois o açúcar é uma substância composta.
d) I a lâmpada está acesa, devido à movimentação dos íons presentes na solução.
19. O nióbio é um metal encontrado em jazidas naturais, principalmente na forma de óxidos.
Em uma jazida que contenha nióbio com número de oxidação +5, a fórmula do óxido
predominante desse metal corresponde a:
a) NbO5
b) Nb5O
c) Nb5O2
d) Nb2O5
20. As propriedades das substâncias estão diretamente relacionadas com as suas ligações
químicas. Nesse contexto, é CORRETO afirmar que o
a) CO2 é uma molécula triangular, com duas ligações covalentes apolares.
b) C 2 apresenta ligação covalente polar e é um gás a temperatura ambiente.
c) KBr apresenta ligação iônica e conduz corrente elétrica em solução.
d) Na realiza ligação metálica no estado sólido e tem alta energia de ionização.
21.
Para evitar bolor em armários utilizam-se produtos denominados comercialmente de
―substâncias secantes‖. Esses produtos, como o cloreto de cálcio anidro, são higroscópicos, ou
seja, capazes de absorver moléculas de água. Por isso, o frasco contendo esse secante acaba
por acumular líquido no fundo, que nada mais é que solução aquosa de cloreto de cálcio.
Dados os números atômicos: Ca 20 e C 17; é correto afirmar que:
a) entre o cálcio e o cloro ocorre ligação iônica.
b) na formação do cloreto de cálcio anidro, o cálcio recebe 2 elétrons e o cloro perde um
elétron.
c) a fórmula do cloreto de cálcio é Ca2C.
d) o cloreto de cálcio é uma base.
e) o cálcio forma o ânion Ca2– e o cloro forma cátion C1 .
22.
A construção da tabela periódica de Mendeleev deu-se pela necessidade de
sistematização dos elementos químicos até então descobertos em meados do século XIX. Um
movimento constante de organização dos elementos químicos impulsionou trabalhos de vários
estudiosos da época, numa tentativa de estruturar a química e conferir-lhe cientificidade. Pela
análise da tabela periódica, faça o que se pede.
a) Explique a diferença da energia potencial do lítio e do flúor, relacionando-a com o raio
desses elementos.
b) Construa e explique a ordem crescente da fila de eletronegatividade dos seguintes
elementos: carbono, bromo, nitrogênio, oxigênio e flúor.
c) Preveja o tipo de ligação química e a fórmula química do composto formado por alumínio e
cloro.
23. Analise os esquemas a seguir.
Tendo em vista as estruturas apresentadas,
a) explique a diferença de comportamento entre um composto iônico sólido e um metal sólido
quando submetidos a uma diferença de potencial;
b) explique por que o comportamento de uma solução de substância iônica é semelhante ao
comportamento de um metal sólido, quando ambos são submetidos a uma diferença de
potencial.
24. A tabela abaixo apresenta alguns dos produtos químicos existentes em uma residência.
Sal de cozinha
Um dos componentes
do produto
Cloreto de sódio
Açúcar
Sacarose
Fórmula do
componente
NaC
C12H22O11
Refrigerante
Ácido Carbônico
H2CO3
Limpa-forno
Hidróxido de sódio
NaOH
Produto
Assinale a alternativa correta:
a) O cloreto de sódio é um composto iônico que apresenta alta solubilidade em água e, no
estado sólido, apresenta boa condutividade elétrica.
b) A solução aquosa de sacarose é uma substância molecular que conduz muito bem a
corrente elétrica devido à formação de ligações de hidrogênio entre as moléculas de
sacarose e a água.
c) O hidróxido de sódio e o cloreto de sódio são compostos iônicos que, quando dissolvidos em
água, sofrem dissociação, em que os íons formados são responsáveis pelo transporte de
cargas.
d) Soluções aquosas de sacarose e de cloreto de sódio apresentam condutividade elétrica
maior que aquela apresentada pela água destilada (pura), pois existe a formação de
soluções eletrolíticas, em ambas as soluções.
e) O ácido carbônico é um diácido, muito estável, sendo considerado como ácido forte, não
conduz corrente elétrica.
25.
Dois elementos químicos A e B apresentam número atômicos iguais a 13 e 16,
respectivamente. Ao reagirem entre si, eles formam um composto iônico do tipo
a) AB
b) AB2
c) A2B
d) A2B3
26. Em uma feira de ciências, apresentou-se um vídeo que mostrava, simultaneamente, três
experimentos diferentes (I, II e III), conforme indicados a seguir. Em cada recipiente, havia: I –
Solução de cloreto de sódio; II - Cloreto de sódio sólido; III – Cloreto de sódio fundido.
Passados alguns instantes, percebeu-se que se acendeu (acenderam) apenas a(s) lâmpada(s)
a) I.
b) II.
c) III.
d) I e II.
e) I e III.
27. A obtenção do cloreto de sódio, a partir da água do mar, é um processo eficiente e de
baixo impacto ambiental, visto que se utiliza da energia solar e dos ventos para evaporação da
água.
A respeito do cloreto de sódio, identifique as afirmativas corretas:
( ) É uma substância iônica formada pela combinação de um metal e um ametal.
( ) É uma substância formada por íons que se ligam covalentemente.
( ) Tem alto ponto de fusão devido à grande atração entre seus íons.
( ) Apresenta compartilhamento de um conjunto desordenado de elétrons.
( ) É condutor de eletricidade, quando fundido.
28. Quando átomos do elemento X, o qual está presente no terceiro período e no grupo 17 da
moderna classificação periódica, se combinam com átomos do elemento Y, o qual está
presente no terceiro período e grupo 2, forma-se um composto
a) molecular de fórmula XY2
b) iônico de fórmula X2Y
c) molecular de fórmula XY
d) iônico de fórmula YX2
e) iônico de fórmula Y2X
29. Acidente na rodovia Castello Branco causa vazamento de ácido clorídrico
Um acidente entre dois caminhões ocorrido em fevereiro deste ano bloqueou totalmente os
dois sentidos da rodovia Castello Branco durante cerca de quatro horas na região de Itapevi (a
40 km de São Paulo). Uma pessoa morreu e outra ficou ferida. Um caminhão bateu na traseira
de outro, que transportava ácido clorídrico. Segundo a concessionária, o compartimento que
carregava o produto se rompeu, o que provocou vazamento do ácido e liberação de fumaça
tóxica.
O ácido clorídrico é tóxico e deve ser manuseado com cuidado. A fumaça liberada por esse
produto químico é sufocante e corrosiva. Esse ácido é usado na produção de tintas e corantes,
na indústria alimentícia e na extração de petróleo.
Disponível em: <http://noticias.uol.com.br/cotidiano/ultimas-noticias/2014/02/18/acidente-comcarreta-que-transportava-acido-bloqueia-a-castello-bran-co.htm> [Adaptado] Acesso em: 31
ago. 2014.
Sobre o assunto tratado acima, é CORRETO afirmar que:
01) o ácido clorídrico, em contato com água, ioniza-se para formar íons cloreto.
02) a fórmula molecular do ácido clorídrico é HCO4 .
04) para neutralizar o ácido clorídrico derramado na pista, o Corpo de Bombeiros poderia
recorrer ao uso de vinagre em grande quantidade.
08) o ácido clorídrico poderia ser neutralizado com solução de bicarbonato de sódio (NaHCO3 ).
16) se 40,0 L de ácido clorídrico tivessem se misturado a um certo volume de água neutra de
um córrego próximo, o pH do córrego se elevaria naquele local.
32) por se tratar de uma molécula com ligação covalente, o ácido clorídrico é polar e insolúvel em água.
30.
A relação entre a molécula, sua geometria e sua polaridade está representada
corretamente em:
a) CC 4 , tetraédrica e polar.
b) PBr3 , piramidal e apolar.
c) BeF2 , angular e polar.
d) CO2 , linear e apolar.
31. Há duas características que podem definir se uma molécula é ou não polar: a diferença de
eletronegatividade entre os átomos ligados e a geometria da molécula. Com base nessas
informações, assinale a alternativa INCORRETA.
a) A geometria das moléculas de oxigênio e ozônio é linear, as ligações são apolares e as
moléculas são apolares.
b) A geometria da molécula da água é angular, as ligações entre os átomos são polares e a
molécula é polar.
c) A geometria da molécula de tetracloreto de carbono é tetraédrica, as ligações entre os
átomos são polares e a molécula é apolar.
d) A geometria da molécula do gás carbônico é linear, as ligações entre os átomos são polares
e a molécula é apolar.
e) A geometria da molécula de diclorometano é tetraédrica, as ligações entre os átomos são
polares e a molécula é polar.
32. A coluna da esquerda, abaixo, apresenta cinco espécies moleculares que têm o elemento
enxofre como átomo central, a da direita, tipos de geometria molecular que correspondem a
quatro dessas espécies.
Associe corretamente a coluna da direita à da esquerda.
1. SO2
( ) trigonal-plana
2. SOC 2
( ) tetraédrica
3. H2SO4
( ) piramidal
4. SO3
5. H2S
( ) angular
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
a) 2 – 3 – 1 – 4.
b) 2 – 4 – 3 – 1.
c) 3 – 2 – 1 – 5.
d) 4 – 3 – 2 – 1.
e) 4 – 2 – 3 – 5.
33. O uso dos combustíveis fósseis, gasolina e diesel, para fins veiculares resulta em emissão
de gases para a atmosfera, que geram os seguintes prejuízos ambientais: aquecimento global
e chuva ácida. Como resultado da combustão, detecta-se na atmosfera aumento da
concentração dos gases CO2 , NO2 e SO2 .
Sobre as moléculas desses gases, é correto afirmar que
a) CO2 é apolar e NO2 e SO2 são polares.
b) CO2 é polar e NO2 e SO2 são apolares.
c) CO2 e NO2 são apolares e SO2 é polar.
d) CO2 e NO2 são polares e SO2 é apolar.
e) CO2 e SO2 são apolares e NO2 é polar.
34.
Haleto de
hidrogênio,
HX*
Diferença
de
eletronegatividade**
entre H e X
HF
1,9
HCℓ
0,9
HBr
0,7
Hl
0,4
* X representa um átomo de halogênio
** eletronegatividade de Pauling.
Comprimento de
ligação, Å,
de H — X
0,92
1,27
1,41
1,61
Momento de
dipolo (D), м,
de HX
1,82
1,08
0,82
0,44
Entalpia média de
-1
ligação (kJ.mol )
H— X
567
431
366
299
Tendo em vista que alguns ácidos são melhores doadores de próton que outros, ao ordená-los
segundo essa habilidade, verifica-se que sua força depende da facilidade com que um átomo
de hidrogênio se ioniza em meio aquoso. Essa força, em uma molécula HX, é o resultado da
polaridade da ligação H — X , representada pelo momento de dipolo, da energia dessa ligação
e da estabilidade da base conjugada X−, formada durante a reação de HX com a água.
Com base nessas informações e nos dados da tabela que apresenta algumas propriedades
físicas dos haletos de hidrogênio:
• estabeleça uma relação entre a variação do momento de dipolo de HX com a distância entre
os átomos na ligação H – X e com a intensidade da carga elétrica parcial sobre X, e a
influência dessa relação sobre a força do ácido HX(aq) .
• escreva as fórmulas moleculares que representam os ácidos HX(aq) , em ordem decrescente
de força, e justifique a sua resposta com base na entalpia média de ligação H — X .
35. Como usualmente definido na Química, a medida da polaridade das ligações químicas é
feita pelo momento dipolar representado pelo vetor momento dipolar. A molécula de BF 3
apresenta três ligações covalentes polares e independentes entre um átomo de boro e um
átomo de flúor, e podem ser representadas como vetores. A polaridade e a representação
plana dessa molécula são, respectivamente,
a)
b)
c)
d)
e)
36. Na figura, são apresentados os desenhos de algumas geometrias moleculares.
SO3, H2S e BeCℓ2 apresentam, respectivamente, as geometrias moleculares:
a) III, I e II.
b) III, I e IV.
c) III, II e I.
d) IV, I e II.
e) IV, II e I.
TEXTO PARA A PRÓXIMA QUESTÃO:
Durante um experimento, seu professor de química pediu que você identificasse as soluções
aquosas presentes em cada um dos béqueres (A, B, C) apresentados a seguir.
37. Um dos béqueres contém um sistema não homogêneo de sacarose cuja fórmula estrutural
é:
a) Identifique o béquer que contém a solução de sacarose. Justifique sua resposta.
b) Coloque em ordem crescente de eletronegatividade os elementos químicos presentes na
sacarose. Justifique sua resposta, com base na estrutura eletrônica dos elementos.
38. O elemento bromo forma compostos iônicos e moleculares. Assinale a alternativa que
apresenta, respectivamente, um composto iônico e um molecular formado pelo bromo.
a) CaBr2 e HBr
b) CBr4 e KBr
c) NaBr e MgBr2
d) KBr e NH4Br
39. Para o estudo das relações entre o tipo de ligação química e as propriedades físicas das
substâncias X e Y, sólidas à temperatura ambiente, foram realizados experimentos que
permitiram concluir que:
- A substância X conduz corrente elétrica no estado líquido, mas não no estado sólido.
- A substância Y não conduz corrente elétrica em nenhum estado.
Considerando-se essas informações, é CORRETO afirmar que:
a) a substância X é molecular e a substância Y é iônica.
b) a substância X é iônica e a substância Y é metálica.
c) a substância X é iônica e a substância Y é molecular.
d) as substâncias X e Y são moleculares.
TEXTO PARA A PRÓXIMA QUESTÃO:
Num balão de vidro, com meio litro de capacidade, contendo 250 mL de água destilada (H 2O),
nas condições ambientais, foi dissolvida (por borbulhamento) uma certa quantidade de gás
amônia (NH3).
40. Em contato com a água (H2O), a amônia (NH3) sofreu um processo de
a) amonólise.
b) dissociação.
c) hidrólise.
d) ionização.
41. Os fornos de micro-ondas são aparelhos que emitem radiações eletromagnéticas (as
micro-ondas) que aquecem a água e, consequentemente, os alimentos que a contêm. Isso
ocorre porque as moléculas de água são polares, condição necessária para que a interação
com esse tipo de radiação seja significativa. As eletronegatividades para alguns elementos são
apresentadas na tabela a seguir.
a) Com base nessas informações, forneça a fórmula estrutural e indique o momento dipolar
resultante para a molécula de água.
b) Sabendo que praticamente não se observam variações na temperatura do dióxido de
carbono quando este é exposto à ação das radiações denominadas micro-ondas, forneça a
estrutura da molécula de CO2. Justifique sua resposta, considerando as diferenças nas
eletronegatividades do carbono e do oxigênio.
42. Na ligação entre átomos do elemento químico cloro, que tem número atômico igual a 17,
forma-se uma:
a) molécula triatômica.
b) substância simples iônica.
c) molécula apolar.
d) molécula polar.
e) substância composta gasosa.
2-
43. Considere as seguintes espécies no estado gasoso: NF 3, BeF2, BCℓ3, CℓF3, KrF4 e SeO4 .
Quais delas apresentam momento de dipolo elétrico?
2a) Apenas NF3 e SeO4 .
b) Apenas BeF2, CℓF3 e KrF4.
2c) Apenas BCℓ3, SeO4 e KrF4.
d) Apenas NF3 e CℓF3 .
2e) Apenas BeF2, BCℓ3 e SeO4 .
44.
Considere a tabela a seguir e selecione a(s) proposição(ões) que relaciona(m)
CORRETAMENTE a forma geométrica e a polaridade das substâncias citadas:
01) H2O: angular e polar.
02) CO2: linear e apolar.
04) CCℓ4: trigonal e polar.
08) NH3: piramidal e polar.
16) CCℓ4: tetraédrica e apolar.
45. Assinale a(s) proposição(ões) CORRETA(S).
Os compostos formados a partir dos elementos oxigênio, cloro, sódio e cálcio devem
apresentar fórmulas, ligações químicas predominantes e estados físicos, em condições
ambientes, respectivamente:
01) CaCℓ2, iônica, sólido.
02) NaCℓ, iônica, líquido.
04) Cℓ2, covalente, gás.
08) Na2O, covalente, líquido.
16) O2, iônica, gás.
46. A capacidade que um átomo tem de atrair elétrons de outro átomo, quando os dois
formam uma ligação química, é denominada eletronegatividade. Esta é uma das propriedades
químicas consideradas no estudo da polaridade das ligações.
Assinale a opção que apresenta, corretamente, os compostos H 2O, H2S e H2Se em ordem
crescente de polaridade.
a) H2Se < H2O < H2S
b) H2S < H2Se < H2O
c) H2S < H2O < H2Se
d) H2O < H2Se < H2S
e) H2Se < H2S < H2O
47. Existem três estruturas possíveis para a molécula de PF 3(CH3)2, onde o átomo de fósforo
é o átomo central. Desenhe as três estruturas e explique como valores de momento de dipolo
obtidos experimentalmente podem ser utilizados para distingui-las.
48. A acetona (H3C-CO-CH3), um importante solvente orgânico, apresenta nos seus carbonos,
respectivamente, os seguintes tipos de hibridação:
2
3
a) sp, sp e sp
3
3
3
b) sp , sp e sp
2
3
c) sp , sp e sp
3
2
3
d) sp , sp e sp
3
2
2
e) sp , sp e sp
49.
Sejam dadas as seguintes moléculas: H 2O, BeH2, BCℓ3 e CCℓ4. As configurações
espaciais dessas moléculas são, respectivamente:
a) angular, linear, trigonal, tetraédrica
b) angular, trigonal, linear, tetraédrica
c) angular, linear, piramidal, tetraédrica
d) trigonal, linear, angular, tetraédrica
50. Não obstante os cientistas terem grande capacidade de planejar suas pesquisas para fins
de obtenção de produtos específicos, muitos materiais de nobres utilidades para o homem
foram descobertos de maneira absolutamente acidental. O teflon, por exemplo, foi descoberto
em 1938 por Roy Plunkett, quando pesquisava as propriedades do gás tetrafluoretileno (C 2F4),
o qual originou um polímero sólido, de cor branca, bastante resistente ao calor.
Com relação ao tetrafluoretileno, é correto afirmar que sua molécula e as ligações químicas
nela existentes são, respectivamente:
Dados:
C (Z = 6); F (Z = 9); H (Z = 1)
a) polar; todas covalentes apolares do tipo pi (ð).
b) polar; iônicas (C-F) e eletrovalentes (C-C).
c) apolar; todas covalentes apolares do tipo sigma (ó).
d) apolar; covalentes polares (C-F) e apolares (C-C).
e) iônica; covalentes apolares (F-F) e polares (C-F).
51. Sobre as seguintes geometrias moleculares, assinale o que for correto.
01) O composto CO2 é apolar, porque o vetor μ = 0.
02) Os compostos NH3 e H2O são moléculas polares.
04) Os compostos BF3 e CO2 são apolares.
08) Os compostos H2O e BF3 são moléculas polares, pois o vetor μ ≠ 0.
16) Os compostos NH3 e BF3 são moléculas apolares.
52.
As temperaturas de ebulição de tetraclorometano, CCℓ 4, e metano, CH4, são iguais,
°
°
respectivamente, a +77 C e a -164 C.
Assinale a alternativa que explica CORRETAMENTE essa diferença de valores.
a) A eletronegatividade dos átomos de Cℓ é maior que a dos átomos de H.
b) A energia necessária para quebrar ligações C-Cℓ é maior que aquela necessária para
quebrar ligações C-H.
c) As interações de dipolos induzidos são mais intensas entre as moléculas de CCℓ4 que entre
as moléculas de CH4.
d) As ligações químicas de CCℓ4 têm natureza iônica, enquanto as de CH4 têm natureza
covalente.
53.
Relacione a fórmula, forma geométrica e polaridade a seguir, assinalando a opção
CORRETA:
a) Fórmula - CO2; Forma Geométrica - linear; Polaridade - polar;
b) Fórmula - CCℓ4; Forma Geométrica - tetraédrica; Polaridade - polar;
c) Fórmula - NH3; Forma Geométrica - piramidal; Polaridade - apolar;
d) Fórmula - BeH2; Forma Geométrica - linear; Polaridade - apolar;
54.
Analise os compostos abaixo e assinale a alternativa que os dispõe em ordem
decrescente de pontos de ebulição.
I- CH3CH2CHO
II- CH3COOH
III- CH3CH2CH2OH
IV- CH3CH2CH2CH3
a) II, III, I, IV.
b) IV, II, III, I.
c) I, II, IV, III.
d) II, IV, III, I.
TEXTO PARA A PRÓXIMA QUESTÃO:
Considere o texto abaixo para responder à(s) quest(ões) a seguir.
―Anderson Silva ainda não deu sua versão sobre ter sido flagrado no exame antidoping,
conforme divulgado na noite de terça-feira. O fato é que a drostanolona, substância encontrada
em seu organismo, serve para aumentar a potência muscular - e traz uma série de problemas a
curto e longo prazos.‖
Disponível em: <http://sportv.globo.com/site/combate/noticia/
2015/02/medica-explica-substancia-em-exame-de-andersonsilva-drostanolona.html>. Acesso em: 16 abr. 2015.
55. A pouca solubilidade dos compostos em água está relacionada às interações químicas.
Sendo assim, a pouca solubilidade do esteroide propionato de drostanolona deve-se à ligação
do tipo
a) de hidrogênio
b) de dipolo-dipolo
c) eletrovalente
d) de Van der Waals
e) covalente
56. A água (H2 O) e o ácido sulfídrico (H2 S) possuem algumas características em comum,
por exemplo: os elementos oxigênio e enxofre pertencem à mesma família na Tabela
Periódica; a molécula da água e a do ácido sulfídrico possuem a mesma geometria. Porém, o
ponto de fusão (PF) de cada um desses dois compostos (H2 O e H2 S), nas C.N.T.P., é
distinto: PF(H2 O) 0C e PF(H2 S) 85C.
a) Explique por que o ponto de fusão (PF) da água é maior do que o ponto de fusão (PF) do
ácido sulfídrico.
b) Considerando que o primeiro elétron a ser preenchido em um orbital possui spin negativo
(Ms 12) e que a distribuição eletrônica do elemento oxigênio é 1s2 2s2 2p4 , descreva o
conjunto dos quatro números quânticos para os quatro elétrons do subnível 2p.
c) O ácido sulfídrico pode reagir com diversos compostos metálicos formando espécies de
sulfetos insolúveis em água. Determine a fórmula mínima de um composto metálico que
contém 42,3% de cromo e 57,7% de cloro.
d) Calcule o volume ocupado, em L, por 17,04 g de ácido sulfídrico a 27,0C e 1,50 atm.
Dado: R 0,0820L atm K 1 mol1
57.
Os gases dióxido de carbono (CO2 ) e oxigênio (O2 ) fazem parte do processo de
respiração celular. Sobre esse tema, assinale o que for correto.
01) Na molécula de CO2 , o átomo de carbono tem valência 2, pois está ligado a dois átomos
de oxigênio.
02) A entrada de gás oxigênio nas células ocorre por difusão facilitada.
04) A molécula de oxigênio é uma molécula estável, pois cada átomo de oxigênio está com o
octeto completo e possui configuração do gás nobre Neônio.
08) A concentração do gás carbônico é maior no interior da célula do que no meio externo.
16) As moléculas de CO2 apresentam forças intermoleculares do tipo dipolo permanentedipolo permanente.
58.
O gelo seco é o dióxido de carbono (CO2 ) solidificado, utilizado em sistemas de
refrigeração. Sobre o dióxido de carbono, assinale o que for correto.
Dados: C (Z 6); O (Z 8)
01) Os íons que compõem o CO2 promovem a solidificação do gás.
02) A molécula de CO2 é formada por duplas ligações.
04) A força intermolecular que promove a interação entre suas moléculas é do tipo dipolodipolo.
08) A ligação química existente entre seus átomos é a ligação covalente.
16) A geometria das moléculas é angular, semelhante à geometria das moléculas da água.
59. As vitaminas são indispensáveis à nossa dieta alimentar pois atuam na regulação de
muitos processos vitais. Com base nas estruturas moleculares (abaixo apresentadas) e na
atuação destas substâncias no organismo humano, assinale a(s) alternativa(s) correta(s).
01) A vitamina A é encontrada no fígado de boi, nos peixes, na gema do ovo e nos vegetais
com folhas verde-escuras. Sua carência pode causar a cegueira noturna, pele seca e baixa
resistência a infecções.
02) Recentemente tem sido divulgado o aumento de casos de osteoporose em função do uso
ininterrupto de protetor solar, que protege a pele, mas deixa o organismo com carência de
vitamina D.
04) As funções orgânicas presentes nas vitaminas A e E são, respectivamente, alcino e álcool.
08) As vitaminas A e E, devido as suas estruturas moleculares, são lipossolúveis e são
armazenadas no fígado, sendo que a ingestão exagerada dessas vitaminas pode causar
problemas neste e em outros órgãos.
16) A vitamina C, também chamada ácido ascórbico, apresenta vários grupos OH, o que faz
com que ela seja solúvel em água.
60. Em um laboratório existem três frascos sem identificação. Um contém benzeno, outro
tetracloreto de carbono e o terceiro, metanol. A tabela abaixo apresenta a densidade e a
solubilidade desses líquidos em água. Sabendo que a densidade da água é 1,00 g / cm3 ,
assinale o que for correto.
Benzeno
Tetracloreto de carbono
Metanol
Densidade (g / cm3 )
Solubilidade em água
0,87
1,59
0,79
Insolúvel
Insolúvel
Solúvel
01) O frasco com metanol pode ser identificado através da solubilidade em água, isto é, o
líquido desse frasco, em água, formará uma mistura sem fases.
02) O tetracloreto de carbono é insolúvel em água porque é uma substância apolar.
04) A mistura de tetracloreto de carbono e água pode ser separada através de um funil de
decantação.
08) A mistura de água e metanol pode ser separada por destilação simples.
16) O frasco com benzeno pode ser identificado através da densidade e a solubilidade em
água, isto é, o líquido desse frasco é insolúvel em água e na presença da água ficará na
parte inferior da mistura.
61. Um experimento de laboratório para estudo de misturas foi realizado em uma aula prática,
empregando-se as substâncias da tabela seguinte:
Recipiente
Substâncias
Fórmula molecular
I
Tetracloreto de carbono
CC 4
II
Benzeno
C6H6
III
Água
H2O
IV
Iodo
I2
Densidade
Os alunos documentaram os reagentes por meio de fotografias:
3
g / cm 20C
1,6
0,88
1,0
4,9
aproximada
Uma fotografia do resultado da mistura de 3 dessas substâncias, seguida da agitação e da
decantação, é apresentada a seguir:
É correto afirmar que, no tubo de ensaio contendo a mistura do experimento, a fase superior é
composta de _______ e a fase inferior é composta de ________.
As lacunas no texto são preenchidas, correta e respectivamente, por:
a) água e iodo … tetracloreto de carbono
b) água e iodo … benzeno
c) tetracloreto de carbono e iodo … benzeno
d) benzeno … água e iodo
e) benzeno e iodo … água
62. O mercúrio é um metal líquido à temperatura ambiente, conhecido desde os tempos
antigos da Grécia. Apresenta boa condutividade elétrica, além de formar amálgamas
relativamente consistentes com ouro, prata e chumbo. É frequentemente utilizado na
fabricação de termômetros, barômetros, lâmpadas e interruptores elétricos. Industrialmente,
esse metal pode ser obtido a partir do tratamento térmico do mineral cinábrio (HgS), na
presença de gás oxigênio, em um alto forno. Esse processo, conhecido como ustulação, pode
ser representado simplificadamente por meio da equação química descrita abaixo.
HgS(s) O2(g) Hg() SO2(g)
Considerando as informações do enunciado, assinale a alternativa correta.
a) 1,0mol de mercúrio é produzido a partir de 2,0mols de gás oxigênio na reação de ustulação
do cinábrio.
b) Os átomos de mercúrio e enxofre no cinábrio estão unidos entre si por meio de ligações
metálicas.
c) O gás oxigênio utilizado na reação de ustulação do cinábrio apresenta uma ligação
covalente normal tripla em sua estrutura química e geometria angular.
d) A reação química que ocorre durante a ustulação do cinábrio é de análise.
e) A substância composta obtida na reação de ustulação do cinábrio é polar e solúvel em água.
63. A remoção de gordura em utensílios domésticos é feita por ação mecânica, entretanto, a
ação dos sabões facilita o processo de remoção de sujeiras gordurosas. Um exemplo de uma
molécula de sabão é o dodecanoato de sódio, cuja estrutura química está mostrada a seguir.
O papel do sabão no processo de limpeza ocorre devido à
a) interação de van der Walls da parte apolar e à ligação de hidrogênio da parte polar de sua
molécula, respectivamente, com a gordura e a água.
b) redução do pH do meio, possibilitando a solubilização da gordura na água.
c) diminuição da densidade da água, facilitando a precipitação das moléculas de gordura, que
serão removidas por centrifugação.
d) tensão superficial da água que é elevada e que possibilita a formação de espuma que
remove a sujeira.
64. Inúmeras cidades vêm passando por dificuldades por falta d’água e o desperdício de água
vem sendo exposto em vários programas de televisão. A charge a seguir é de 2012 e já
retratava a preocupação e a consciência desse bem tão precioso.
A respeito da molécula de água, assinale a afirmativa INCORRETA.
a) Possui um ângulo de aproximadamente 105.
b) Tem ponto de ebulição menor que ácido sulfídrico.
c) As moléculas de água estão mais afastadas no estado sólido do que no estado líquido.
d) A vaporização da água pode receber três nomes distintos: ebulição, evaporação ou
calefação.
65.
Certamente você já estourou pipoca no micro-ondas ou já aqueceu algum alimento
utilizando esse eletrodoméstico. Você sabe como isso ocorre? O micro-ondas emite uma
radiação eletromagnética com comprimento de onda maior que o da luz e menor que o das
ondas de rádio. À medida que as ondas passam pelas moléculas de água, estas absorvem a
radiação e movimentam-se mais rapidamente. Ao colidirem com moléculas vizinhas, transferem
a elas parte de sua agitação térmica e, assim, o alimento vai sendo aquecido.
Moléculas polares são capazes de absorver as micro-ondas e transformar essa energia em
agitação térmica.
Fonte: CISCATO, Carlos A. M.; PEREIRA, Fernando P. Planeta Química.
São Paulo: Ática, 2008, p. 89-90. (adaptado)
Então, analise as afirmações:
I. A molécula de água é polar, pois sua geometria é angular; assim, apresenta capacidade de
dissolver substâncias polares, como o sal de cozinha e o óleo utilizados para o cozimento de
macarrão, formando uma mistura heterogênea com duas fases distintas.
II. A água é uma substância simples, formada por elementos com diferentes valores de
eletronegatividade.
III. O compartilhamento de elétrons entre os átomos de hidrogênio e oxigênio na molécula de
água ocorre através de ligações do tipo covalente.
IV. A água apresenta ponto de ebulição (PE) maior que a amônia, pois as forças
intermoleculares na água são maiores que na amônia.
Estão corretas
a) apenas I e II.
b) apenas I e III.
c) apenas II e III.
d) apenas II e IV.
e) apenas III e IV.
66. No quadro a seguir, estão apresentadas as temperaturas de fusão e de ebulição, em C,
sob pressão de 1atm, de diferentes substâncias químicas.
Substância química a 25C e
1atm
Temperatura de fusão
(C)
Temperatura de ebulição
(C)
Oxigênio (O2(g) )
218,8
183
Amônia (NH3(g) )
77,7
33,4
Metanol (CH3OH() )
97
64,7
Acetona (C3H6O() )
94,6
56,5
Mercúrio (Hg() )
38,87
356,9
Alumínio (A(s) )
660
2519
Cloreto de sódio (NaC(s) )
801
1413
Com base nas informações constantes no quadro, analise as afirmações a seguir e marque V
para verdadeiro e F para falso.
(
(
(
) As substâncias metanol e mercúrio, à temperatura de 60C, estarão no estado líquido de
agregação.
) As interações que mantêm unidas, no estado sólido, as moléculas das substâncias
amônia, metanol e acetona são forças do tipo dipolo induzido, as quais formam cristais
moleculares.
) Entre as substâncias listadas, o cloreto de sódio apresenta a maior temperatura de fusão,
o que se justifica em razão de seus íons estarem unidos por interações do tipo dipolo
permanente, formando retículos cristalinos iônicos.
(
) O modelo para a formação do A(s) , no estado sólido, se baseia na interação entre os
(
cátions do metal que se agrupam, formando células unitárias em que as cargas positivas
são estabilizadas por elétrons semilivres, que envolvem a estrutura como uma nuvem
eletrônica
) O gás oxigênio (O2(g) ) apresenta os menores valores de temperaturas de fusão e de
ebulição, pois suas moléculas se mantêm unidas por forças de dipolo induzido, que são
de fraca intensidade.
A sequência correta de preenchimento dos parênteses, de cima para baixo, é:
a) V – F – V – F – F.
b) F – F – V – F – V.
c) V – F – F – V – V.
d) F – V – F – F – V.
e) V – V – F – V – F.
67.
Os protetores solares são formulações que contêm dois componentes básicos: os
ingredientes ativos (filtros solares) e os veículos. Dentre os veículos, os cremes e as loções
emulsionadas são os mais utilizados, por associarem alta proteção à facilidade de
espalhamento sobre a pele. Uma emulsão pode ser obtida a partir da mistura entre óleo e
água, por meio da ação de um agente emulsionante. O laurato de sacarose
(6 O laurato de sacarose), por exemplo, é um agente emulsionante utilizado no preparo de
emulsões.
A ação emulsionante do laurato de sacarose deve-se à presença de
a) grupos hidroxila que fazem ligações de hidrogênio com as moléculas de água.
b) uma longa cadeia carbônica que o torna solúvel em óleo.
c) uma longa cadeia carbônica que o torna solúvel em água.
d) grupos hidrofílicos e lipofílicos que o tornam solúvel nas fases aquosa e oleosa.
e) grupos hidrofóbicos e lipofóbicos que o tornam solúvel nas fases aquosa e oleosa.
68. O segmento empresarial de lavanderias no Brasil tem tido um grande crescimento nas
últimas décadas. Dentre os solventes mais empregados nas lavanderias industriais, destacamse as isoparafinas, I, e o tetracloroetileno, II, conhecido comercialmente como percloro. Um
produto amplamente empregado no setor de lavanderia hospitalar é representado na estrutura
III.
(http://www.freedom.inf.br/revista/hc18/household.asp
http://www.ccih.med.br/Caderno%20E.pdf. Adaptado)
Considerando cada uma das substâncias separadamente, as principais forças intermoleculares
que ocorrem em I, II e III são, correta e respectivamente:
a) dipolo – dipolo, dipolo induzido – dipolo induzido, dipolo – dipolo.
b) dipolo – dipolo; dipolo – dipolo; ligação de hidrogênio.
c) dipolo induzido – dipolo induzido; dipolo induzido – dipolo induzido; ligação de hidrogênio.
d) ligação de hidrogênio; dipolo induzido – dipolo induzido; dipolo induzido – dipolo induzido.
e) ligação de hidrogênio; dipolo – dipolo; ligação de hidrogênio.
69. O dióxido de carbono, ao ser resfriado a uma temperatura inferior a 78C, solidifica-se
transformando-se em ―gelo seco‖. Exposto à temperatura ambiente, sob a pressão atmosférica,
o gelo seco sublima. Essa mudança de estado envolve o rompimento de
a) interações dipolo induzido entre moléculas lineares.
b) ligações de hidrogênio presentes na estrutura do gelo.
c) interações dipolo permanente entre moléculas angulares.
d) interações iônicas entre os átomos de oxigênio e carbono.
e) ligações covalentes entre os átomos de carbono e oxigênio.
70. Uma das substâncias mais estudadas e presente no nosso dia a dia é a água. Baseado
nas suas propriedades, é correto afirmar que a:
a) água é uma substância simples.
b) água é formada por 2 (dois) átomos de oxigênio e 1 (um) de hidrogênio.
c) água possui alto ponto de ebulição devido às ligações de hidrogênio.
d) água é uma molécula apolar.
e) água apresenta ângulo de ligação de 180 entre seus átomos.
Gabarito:
Resposta da questão 1:
[B]
[I] Incorreta. Não apresentam brilho metálico.
[II] Correta. Apresentam elevadas temperaturas de fusão e ebulição devido às forças
eletrostáticas.
[III] Correta. Apresentam boa condutibilidade elétrica quando em solução aquosa ou fundidos.
[IV] Correta. São sólidos nas condições ambiente (25 C e 1atm).
[V] Incorreta. São solúveis em solventes polares como a água, sendo que esta solubilidade
pode variar muito.
Resposta da questão 2:
[D]
n 4 (camada principal
0 (subcamada)
X : m 0
ms 1
2
camada principal: 4
subcamada: s (pois, s 0, p 1, d 2, f 3)
0
10 elétron 1
2
Assim, teremos que o átomo X possui o elétron de diferenciação: 4s2 . Portanto, sua
distribuição eletrônica, será:
1s2 2s2 2p6 3s2 3p6 4s2
nº atômico: 20
pertence ao 4º período da família 2A (metais alcalinos terrosos).
n 5
1
Y:
m0
ms 1
2
camada principal: 5
subcamada: p (pois, s 0, p 1, d 2, f 3)
1
0
1
elétron 1
2
Assim, teremos que o átomo Y possui o elétron de diferenciação 5p5
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p5
nº atômico: 53
pertence ao 5º período da família 7A (família do halogênios).
[A] Incorreta. O elemento X é metal alcalino terroso e Y um halogênio.
[B] Incorreta. Os números atômicos serão 20 e 53, respectivamente.
[C] Incorreta. O elemento X possui 2e na C.V e Y possui 7e na C.V.
[D] Correta. O elemento X pertence a família 2A pode doar 2e e Y, da família 7A, recebe 1e
cada, formando o composto: XZ2 .
Resposta da questão 3:
[B]
A ligação entre o sódio (metal) com o cloro (ametal) é uma ligação iônica.
Resposta da questão 4:
[C]
O composto CaC 2 , é o único que é formado por ligação iônica e os compostos iônicos
possuem interações mais intensas quando comparadas as covalentes, por ser formadas por
íons, sendo assim seus pontos de fusão e ebulição são mais intensos.
Resposta da questão 5:
[D]
[I] O NaC é formado por ligações iônicas, explicando o fato de possuir altos pontos de fusão e
ebulição. (D)
[II] A água é uma substância formada por ligações covalentes do tipo ligações de hidrogênio,
com geometria angular, sendo considerada um solvente universal. (E)
[III] O benzeno (composto aromático) é uma substância apolar (dipolo induzido-dipolo induzido)
e líquido a temperatura ambiente. (C)
[IV] O HC é um gás à temperatura ambiente, possui geometria linear, apresenta ligações
covalentes polares do tipo dipolo-dipolo. (A)
[V] O CO2 é um gás em temperatura ambiente, possui geometria linear, com ligações
covalentes apolares do tipo dipolo-induzido dipolo-induzido. (B)
Resposta da questão 6:
[D]
―Isso se explica pelo fato de a água salgada conter grande quantidade de íons (partículas
carregadas eletricamente), como Na e C , livres para transportar carga elétrica no meio.
Uma maneira de liberar essas partículas é dissolver sal de cozinha em um copo de água.
Nesse processo, os cátions e ânions existentes no sal sofrem dissociação iônica.‖
Resposta da questão 7:
[C]
HNO3(aq) NH4OH(aq) NH4NO3(aq) H2O( )
[A] Incorreta. O nitrato de amônio, formado na reação é solúvel (todos os nitratos são solúveis
em água);
[B] Incorreta. Como o sal formado é derivado de um ácido forte e uma base fraca, o sal
formado, possui caráter ácido;
[C] Correta.
NH4
x 1(4) 1
x 3
NO3
x 6 1
x 5
[D] Incorreta. O ácido nítrico é um ácido volátil, formado por ligações covalentes, portanto,
possui temperatura de ebulição menor que o nitrato de amônio, que é um composto iônico.
[E] Incorreta. O sólido formado é resultado da reação entre o NH4OH e o HNO3 .
Resposta da questão 8:
[C]
[A] Incorreta. O sal formado não apresenta hidrogênio em sua fórmula.
[B] Incorreta. A reação de formação é de dupla troca.
[C] Correta. A ligação entre o sódio e o cloro é do tipo iônica, ou seja, formada entre um cátion
e um anion.
[D] Incorreta. O nox do cloro é 1:
1 1
Na C
[E] Incorreta. O NaC é formado a partir de uma reação de neutralização total.
Resposta da questão 9:
[D]
Teremos:
20 A :
1s2 2s2 2p6 3s2 3p6 4s2 A 2
2
17 B : 1s
2
2s2 2p6 3s2 3p5 B
A B B [A 2 ][B ]2 AB2 (composto iônico)
Resposta da questão 10:
[E]
O tipo de ligação química existente entre o sódio e o flúor é a iônica.
[Na ][F ] NaF
Resposta da questão 11:
[E]
O método considerado viável para tratar a água dura e aumentar seu potencial de utilização é a
reação química com CaO e Na2CO3 , para precipitar esses íons na forma de CaCO3 e
MgCO3 .
Resposta da questão 12:
[C]
[A] Incorreta. O cloreto de sódio é formado pela ligação iônica, que ocorre entre os íons de
sódio (Na ) e o íon cloreto (C ).
[B] Incorreta. A temperatura ambiente o cloreto de sódio encontra-se no estado sólido.
[C] Correta. O soro fisiológico é uma solução aquosa de cloreto de sódio (NaC ) e sacarose
que pode ser utilizado na terapia de suporte contra a desidratação.
[D] Incorreta. Em quantidades acima do recomendado, pode causar vários danos ao nosso
organismo como a hipertensão ou o cálculo renal.
[E] Incorreta. Além da água do mar, pode ser encontrado em menores quantidades em alguns
tipos de rochas.
Resposta da questão 13:
[A]
PbO2
4
HgO
Pb O
Pb 2 O 4
2
Hg2O2
Hg 2 O 2
PbO2
HgO
Resposta da questão 14:
02 + 04 + 08 = 14.
Análise das proposições:
[01] Incorreta. Supondo que o raio atômico do sódio seja X e o raio atômico do cloro seja Y, a
+
distância da ligação química entre Na e C – no cloreto de sódio não será
obrigatoriamente X+Y, pois ocorre uma ligação entre íons.
[02] Correta. O átomo de sódio é maior do que o átomo de cloro, o íon sódio é menor do que o
íon cloro.
11Na
1s2 2s2 2p6 3s1 (maior raio; menor c arga nuclear)
17 C
1s2 2s2 2p6 3s2 3p5 (menor raio; maior c arga nuclear)
11Na
17 C
1s2 2s2 2p6 (menor raio; 2 camadas)
1s2 2s2 2p6 3s2 3p6 (maior raio; 3 camadas)
[04] Correta. A regra do octeto é respeitada nos íons sódio e cloro do NaC, mas não é
respeitada para o boro no BF3, pois nesse caso o boro estabiliza com seis elétrons de
valência.
[08] Correta. Sais formados entre metais alcalinos e halogênios apresentarão, para ambos os
2 6
+
íons, uma camada de valência do tipo s p , exceto o Li .
2
1
3 Li 1s 2s
3 Li
1s2
[16] Incorreta. A quantidade de energia envolvida na segunda ionização do sódio é maior em
relação ao envolvido na primeira ionização devido à diminuição do raio.
Resposta da questão 15:
O dióxido de zircônio é comumente chamado de Zirconia Cubica e apresenta fórmula química
ZrO2. Pelo seu caráter metálico (localiza-se no grupo 4 da tabela periódica), podemos prever a
realização de ligações de caráter iônico com o oxigênio.
Quanto aos alótropos do carbono, além do diamante, há a grafita ou grafite e o fulereno.
Resposta da questão 16:
[B]
Teremos:
I.
II.
III.
IV.
V.
VI.
VII.
VIII.
O3
NaI
KNO3
NH3
Ca(OH)2
HCN
CO2
Li2O
(ligação covalente e dativa)
(ligação iônica)
(ligação iônica)
(ligações covalentes)
(ligação iônica)
(ligações covalentes)
(ligações covalentes)
(ligação iônica)
Resposta da questão 17:
[A]
A: ácido forte.
B: sal solúvel em água.
C: sal praticamente insolúvel em água.
D: hidrogenossal (composto iônico).
E: gás carbônico.
Resposta da questão 18:
[D]
Em I, a lâmpada está acesa devido à movimentação dos íons presentes na solução, já que a
solução é iônica, ou seja, possui íons livres.
Resposta da questão 19:
[D]
Teremos:
Nbx Oy [Nb]5 x [O]2 y [Nb]52 [O]25 Nb2O5
Resposta da questão 20:
[C]
Compostos iônicos conduzem corrente elétrica em solução aquosa, o K (família IA) e o Br
(família VIIA) fazem ligação iônica.
Resposta da questão 21:
[A]
Observe a distribuição eletrônica dos átomos:
17 C
1s2 2s2 2p6 3s2 3p5 . Apresenta tendência a receber 1 elétron para tornar-se estável
( C ).
1s2 2s2 2p6 3s2 3p6 4s2 . Apresenta tendência a doar 2 elétrons para tornar-se estável
+2
(Ca ).
20 Ca
Portanto, a ligação prevista entre Ca e C é do tipo iônica formando CaC 2 , que é um sal.
Resposta da questão 22:
a) A energia potencial (ou potencial de ionização) do flúor é maior em relação ao do lítio.
Essa propriedade periódica aumenta com a diminuição do raio atômico do elemento. Apesar
de ambos os átomos apresentarem duas camadas eletrônicas, o raio do flúor é menor
devido à sua maior carga nuclear que contribui para uma maior atração das camadas
eletrônicas.
b) A eletronegatividade depende de vários fatores, entre eles a carga nuclear e o números de
camadas.
Numa família da tabela periódica, a eletronegatividade cresce de baixo para cima.
Num período da tabela periódica, a eletronegatividade cresce da esquerda para a direita.
Mas esses não são os únicos fatores a serem levados em conta.
A fila de eletronegatividade: F O N C Br I S C P H leva em consideração a
eletronegatividade de Linus Pauling e a posição na tabela periódica:
Teremos: C, Br, N, O, F.
c) A ligação entre o alumínio e o cloro será covalente, pois a diferença de eletronegatividade
entre os elementos alumínio e cloro é de 1,5 (3,0 - 1,5).
Podemos, a partir do estudo da eletronegatividade de Linus Pauling dos elementos
químicos, classificar as ligações químicas.
Observação: a diferença de eletronegatividade entre dois átomos será representada por E .
Ou seja, E Emaior Emenor .
Ligações apolares apresentam E igual a zero.
Ligações polares apresentam E diferente de zero.
Ligações iônicas ou com caráter iônico apresentam E superior a 1,7 (neste caso a atração
em cima do par eletrônico é tão grande que o compartilhamento de elétrons é desfeito e a
ligação se torna reticular, ou seja, ligação iônica).
Com a análise do E (diferença de eletronegatividade) podemos dizer que se esta diferença
for igual ou inferior a 1,6 a ligação terá caráter predominantemente covalente.
Se a diferença de eletronegatividade for igual ou superior a 1,7 a ligação terá caráter
predominante iônico.
Genericamente, teremos:
E 1,6 Caráter covalente
E 1,7 Caráter iônico
E 1,6 Puramente covalente
Resposta da questão 23:
a) Nos compostos iônicos sólidos, os íons (cargas) estão presos na rede cristalina e não se
movimentam.
Nos metais sólidos, os elétrons estão livres na rede cristalina (constituindo bandas
eletrônicas) e se movimentam livremente (corrente elétrica).
b) Numa solução iônica, os cátions e ânions estão livres, logo, podem gerar corrente elétrica.
Resposta da questão 24:
[C]
Análise das alternativas:
a) Incorreta. O cloreto de sódio é um composto iônico que apresenta alta solubilidade em água
e, no estado sólido, não apresenta condutividade elétrica, pois os íons ficam retidos na rede
cristalina.
b) Incorreta. A solução aquosa de sacarose é uma substância molecular que não conduz a
corrente elétrica, pois não ocorre dissociação iônica.
c) Correta. Teremos as seguintes dissociações iônicas do hidróxido de sódio e do cloreto de
sódio em água:
NaOH(aq) Na (aq) OH (aq)
NaC(aq) Na (aq) C (aq)
Os íons são responsáveis pelo transporte de cargas.
d) Incorreta. Não existe a formação de soluções eletrolíticas, em ambas as soluções, pois a
solução de sacarose não sofre dissociação iônica.
e) O ácido carbônico é um diácido instável, sendo considerado como ácido fraco.
Resposta da questão 25:
[D]
Teremos:
13 A
1s2 2s2 2p6 3s2 3p1 A3
2
2
6
2
16 B 1s 2s 2p 3s
[A3 ]2 [B2 ]3 A 2B3
3p4 B2
Resposta da questão 26:
[E]
Soluções de cloreto de sódio e cloreto de sódio fundido apresentam íons livres, logo conduzem
eletricidade.
No cloreto de sódio sólido, os íons ficam retidos no retículo cristalino e o circuito não é fechado.
Resposta da questão 27:
V – F – V – F – V.
As afirmativas apresentam um breve comentário:
VERDADEIRA. As substâncias iônicas são formadas por metais (doadores de elétrons) e
ametais (receptores de elétrons).
FALSA. Íons nunca se ligam de forma covalente, pois são unidos por atração eletrostática.
VERDADEIRA. As substâncias iônicas apresentam alto ponto de fusão devido à intensidade da
força de ligação.
FALSA. Esse modelo de ligação ocorre em compostos metálicos, e não em iônicos.
VERDADEIRA. Em estado fundido seus íons apresentam mobilidade, o que explica sua
característica condutora.
Resposta da questão 28:
[D]
-
Grupo 17: X
2+
Grupo 2: Y
2+
Y
X YX2 (composto iônico)
Resposta da questão 29:
01 + 08 = 09.
[01] Correta. A reação será:
HC H2O H3O C
[02] Incorreta. A fórmula do ácido clorídrico é HC.
[04] Incorreta. O vinagre também é um ácido, para que ocorra a neutralização é necessário o
uso de uma base.
[08] Correta. A reação entre o bicarbonato de sódio e o ácido clorídrico forma um sal, água e o
dióxido de carbono.
HC NaHCO3 NaC H2O CO2
[16] Incorreta. Ao se misturar 40 L de ácido a concentração de íons hidrogênio no meio irá
aumentar, diminuindo assim o valor do pH no córrego.
[32] Incorreta. O ácido clorídrico por ser polar é solúvel em água.(semelhante dissolve
semelhante).
Resposta da questão 30:
[D]
Análise das alternativas:
a) CC 4 , é uma molécula tetraédrica e apolar (vetor momento dipolo elétrico nulo).
b) PBr3 , é uma molécula piramidal e polar (vetor momento dipolo elétrico não nulo).
c) BeF2 , é uma molécula linear e apolar (vetor momento dipolo elétrico nulo).
d) CO2 , é uma molécula linear e apolar (vetor momento dipolo elétrico nulo).
Resposta da questão 31:
[A]
Molécula de oxigênio:
Geometria linear, pois tem dois núcleos alinhados.
A ligação covalente dupla é apolar, pois os átomos ligados são iguais.
A molécula é apolar, pois o vetor momento dipolo elétrico é nulo.
Molécula de ozônio:
Geometria angular, pois tem três nuvens eletrônicas com repulsão máxima.
As ligações covalentes são apolares, pois os átomos ligados são iguais.
Existem controvérsias sobre a molécula de ozônio, mas no geral ela é classificada como polar,
pois a densidade eletrônica é menor no átomo central:
Resposta da questão 32:
[D]
Abaixo, seguem as fórmulas estruturais das moléculas e uma breve explicação sobre a
geometria.
SO2 – Há um efeito de ressonância com um par de elétrons que fica deslocalizado entre os
átomos. A geometria da molécula é angular, pois o elemento centra (enxofre) apresenta par
eletrônico disponível, que repele as ligações formando a estrutura angular.
Abaixo há a representação da molécula:
SOC 2 – O átomo de enxofre realiza uma ligação coordenada com o oxigênio e duas ligações
covalentes comuns com átomos de cloro. Entretanto, possui um par de elétrons livres o que
repele as 3 nuvens abaixo do plano do átomo. Dessa forma, sua geometria é piramidal.
H2SO4 – Nessa molécula o átomo de enxofre aparece ligado a 4 ligantes, ou seja, apresenta 4
nuvens eletrônicas se repelindo. Dessa forma, assume uma geometria tetraédrica.
SO3 – No trióxido de enxofre o átomo de enxofre aparece novamente com 3 nuvens
eletrônicas ligadas a oxigênios. Dessa forma, a molécula apresenta geometria trigonal planar.
O átomo de enxofre realiza duas ligações coordenadas (dativas) e uma ligação covalente
dupla.
H2S – O átomo de enxofre apresenta 4 nuvens eletrônicas, sendo que duas delas livres de
ligantes e outras duas com átomos de hidrogênio. Dessa forma, há uma repulsão entre as
nuvens, fazendo com que a molécula apresente geometria angular.
Resposta da questão 33:
[A]
Teremos:
Resposta da questão 34:
Considerando os dados da tabela, pode-se concluir que o aumento do momento de dipolo de
HX está relacionado com a diminuição da distância entre os átomos na ligação H — X , com o
aumento da intensidade da carga elétrica parcial sobre X que cresce com o aumento da
diferença de eletronegatividade entre os átomos na ligação, o que influi na diminuição de
acidez de HX aq .
Com base nos dados de entalpia média de ligação, a ordem decrescente de acidez de HX aq
é HI HBr HC HF , porque quanto menor a energia de ligação, maior a facilidade com a
qual o átomo de hidrogênio, na ligação H — X , se ioniza em meio aquoso.
Resposta da questão 35:
[D]
A molécula BF3 apresenta geometria trigonal plana, o boro (elemento central) por não
apresentar, par de elétrons livres, seus ligantes irão apresentar a máxima repulsão, formando
ângulos de 120° entre si. O flúor sendo mais eletronegativo que o boro, irá atrair mais o elétron
do compartilhamento, deslocando para si a força da ligação. Pela decomposição das forças
teremos a resultante igual a zero, o que configura uma molécula apolar μr 0.
Resposta da questão 36:
[E]
Resolução:
Neste caso devemos seguir o método da repulsão dos pares eletrônicos da camada de
valência, ou seja:
o
1 .) Esquematizar a estrutura de Lewis e acomodar todos os pares de elétrons de valência no
átomo central.
o
2 .) Determinar o número total de pares de elétrons na camada de valência (número estérico)
do átomo central e orientar estes pares de elétrons de modo que a repulsão entre os eles seja
mínima.
o
3 .) Determinar a quantidade de pares isolados, se eles estiverem presentes na estrutura, e
localiza-los de modo que as repulsões entre eles e os outros pares de elétrons sejam mínimas.
Teremos, então:
Resposta da questão 37:
a) O béquer C contém a solução de sacarose.
A solução de sacarose não conduz corrente elétrica, pois não sofre ionização.
b) Ordem decrescente de eletronegatividade dos elementos químicos presentes na sacarose:
O > C > H.
A interação núcleo-elétrons é maior no oxigênio do que no carbono, apesar destes átomos
apresentarem o mesmo número de camadas, pois a carga nuclear do oxigênio é maior.
Apesar de o hidrogênio apresentar uma camada a menos do que o oxigênio e o carbono, sua
carga nuclear é muito inferior e sua energia de ionização é menor.
Resposta da questão 38:
[A]
Resposta da questão 39:
[C]
Resposta da questão 40:
[D]
Resposta da questão 41:
a) e b)
Resposta da questão 42:
[C]
Resposta da questão 43:
[D]
Resposta da questão 44:
01 + 02 + 08 + 16 = 27
Resposta da questão 45:
01 + 04 = 05
Resposta da questão 46:
[E]
Resposta da questão 47:
A diferença de eletronegatividade entre o flúor e o fósforo é muito maior do que a diferença de
eletronegatividade entre o fósforo e o carbono, portanto para facilitar a explicação o vetor
momento dipolo da ligação entre o fósforo e o carbono será desprezado.
As moléculas têm a forma de uma bipirâmide trigonal
Estrutura I:
°
Três vetores planos e entre eles ângulo de 120 .
Estrutura II:
O vetor resultante é o momento de uma ligação F-P.
Estrutura III:
Como o ângulo á é obtuso o valor de ì1 é menor que ì.
Assim temos:
°
Como o ângulo entre ì e ì1 é 90 , o ângulo reto, a resultante será a hipotenusa do triângulo
retângulo, portanto ìr > ì, ou seja ìr é maior que o momento da ligação F - P.
Em ordem de polaridade temos:
III > II > I
Resposta da questão 48:
[D]
Resposta da questão 49:
[A]
Resposta da questão 50:
[D]
Resposta da questão 51:
07
Resposta da questão 52:
[C]
Resposta da questão 53:
[D]
Resposta da questão 54:
[A]
Resposta da questão 55:
[B]
A pouca solubilidade desse composto em água se deve a grande parte apolar do composto,
porém, como apresenta centros polares, devido à presença do oxigênio, esse composto
apresenta ligação do tipo dipolo-dipolo.
Resposta da questão 56:
a) O ponto de fusão da água é maior do que do ácido sulfídrico, pois a água apresenta o
grupo OH, que faz ligações ou pontes de hidrogênio. Estas interações intermoleculares são
mais intensas do que o dipolo-permanente presente no ácido sulfídrico.
b) Teremos:
1s2 2s2 2p4
2p4
1 0 1
Primeiro elétron: n = 2; 1; m 1; s 1 2.
Segundo elétron: n = 2; 1; m 0; s 1 2.
Terceiro elétron: n = 2; 1; m 1; s 1 2.
Quarto elétron: n = 2; 1; m 1; s 1 2.
c) Composto metálico que contém 42,3% de cromo e 57,7% de cloro:
Cr42,3%C 57,7%
42,3 57,7
52 35,5
0,8 1,6 ( 0,8)
1
2
Fórmula mínima: CrC 2 .
d) Teremos:
H2S 34,08
mH2SO4 17,04 g
T 27 273 300 K
P 1,50 atm
R 0,0820 atm L mol1 K 1
m
P V R T
M
17,04
1,50 V
0,0820 300
34,08
V 8,20 L
Resposta da questão 57:
04 + 08 = 12.
[Resposta do ponto de vista da disciplina de Química]
[01] Incorreta. O átomo de carbono apresenta valência de +4, pois cada átomo de oxigênio
possui valência -2.
[04] Correta. A molécula de oxigênio O2 possui o octeto completo, pois cada átomo de
oxigênio esta localizado na família 6A, sendo assim, possuem 6e- na ultima camada,
faltando dois elétrons para completar o octeto, e ficar semelhante ao gás nobre mais
próximo, o neônio.
[16] Incorreta. As moléculas de CO2 por ser apolar, apresentam interação do tipo dipolo
induzido-dipolo induzido.
[Resposta do ponto de vista da disciplina de Biologia]
[02] Incorreta. As trocas gasosas pela membrana plasmática ocorrem por difusão simples.
[08] Correta. A concentração do gás carbônico é maior no meio intracelular, porque esse é uma
produto contínuo da respiração celular.
Resposta da questão 58:
02 + 08 = 10.
[01] Incorreta. A solidificação do CO2 ocorre devido à alteração de pressão e temperatura.
[02] Correta. A molécula de CO2 é formada por duplas ligações (O C O) .
[04] Incorreta. A força intermolecular que promove a interação entre suas moléculas é do tipo
dipolo induzido-dipolo induzido.
[08] Correta. A ligação química existente entre seus átomos (carbono e oxigênio) é a ligação
covalente.
[16] Incorreta. A geometria das moléculas de CO2 é linear.
Resposta da questão 59:
01 + 02 + 08 + 16 = 27.
[Resposta do ponto de vista da disciplina de Química]
As funções orgânicas presentes nas vitaminas A e E são, respectivamente, álcool, fenol e éter.
As vitaminas A e E, devido as suas estruturas moleculares, são lipossolúveis
(predominantemente apolares).
A vitamina C, também chamada ácido ascórbico, apresenta vários grupos OH, o que faz com
que ela seja solúvel em água devido à facilidade de formar ligações de hidrogênio com a água.
[Resposta do ponto de vista da disciplina de Biologia]
[04] Falsa. As funções orgânicas observadas, respectivamente, presentes na estrutura
molecular das vitaminas A e E são fenol e éter.
Resposta da questão 60:
01 + 02 + 04 = 07.
[01] Correta. O frasco com metanol pode ser identificado através da solubilidade em água, isto
é, o líquido desse frasco, em água, formará uma mistura homogênea.
[02] Correta. O tetracloreto de carbono é insolúvel em água porque é uma substância apolar e
a água é uma substância polar.
[04] Correta. A mistura de tetracloreto de carbono e água pode ser separada através de um
funil de decantação, pois a mistura é heterogênea.
[08] Incorreta. A mistura de água e metanol pode ser separada por destilação fracionada, ou
seja, têm-se dois líquidos com pontos de ebulição diferentes.
[16] Incorreta. O frasco com benzeno pode ser identificado através da densidade e a
solubilidade em água, isto é, o líquido desse frasco é insolúvel em água e na presença da água
ficará na parte superior da mistura, já que sua densidade é menor do que a da água.
Resposta da questão 61:
[E]
3
O benzeno (d = 0,88 g/cm ) é uma substância apolar que se mistura ao iodo, também apolar,
3
formando uma única fase de menor densidade do que a água (d = 1,0 g/cm ) líquida.
Resposta da questão 62:
[E]
HgS(s) O2(g) Hg() SO2(g)
SO2 é angular, polar e solúvel em água.
Resposta da questão 63:
[A]
O sabão possui em sua molécula uma cadeia orgânica apolar e uma extremidade polar. A
cadeia apolar se mistura com a gordura, através de interações de Van der Walls, já a parte
polar da cadeia irá interagir com a água, por ligação de hidrogênio, formando assim, um
sistema água-sabão-gordura, chamada de micela, que permite que a água remova a gordura e
promova a limpeza dos utensílios domésticos.
Resposta da questão 64:
[B]
As moléculas de água (H2O) fazem ligação ou ponte de hidrogênio.
As moléculas de ácido sulfídrico (H2S) fazem dipolo permanente.
Como a ligação de hidrogênio é mais intensa do que o dipolo permanente, conclui-se que a
água tem ponto de ebulição maior do que o ácido sulfídrico.
Resposta da questão 65:
[E]
[I] Incorreta. A molécula de água é polar, portanto, ela não se mistura ao óleo de cozinha, por
se tratar de um composto neutro e apolar.
[II] Incorreta. A água H2O é uma substância composta, formada pelos elementos oxigênio e
hidrogênio.
[III] Correta. A ligação entre o átomo de oxigênio e os átomos de hidrogênio, ocorre por
compartilhamento de elétrons, que são ligações covalentes.
[IV] Correta. Embora ambos os compostos (H2O e NH3 ) apresentem ligações do tipo ―ligações
de hidrogênio‖, esses compostos, possuem ponto de ebulição bastante distintos, devido a 2
razões principais: a primeira diz respeito ao átomo central, o oxigênio da água é mais
eletronegativo que o nitrogênio da amônia, possuindo assim, um momento dipolar maior,
consequentemente sua atração intermolecular será maior e necessita de uma quantidade
de energia também maior para romper suas ligações.
O segundo fator diz respeito a geometria da molécula, a água apresenta geometria angular, o
que facilita a interação entre os átomos; enquanto a amônia possui geometria piramidal, o que
dificulta a interação intermolecular entre seus elementos.
Resposta da questão 66:
[C]
Análise das afirmações:
(V) As substâncias metanol e mercúrio, à temperatura de 60C, estarão no estado líquido de
agregação.
Temperatura de
fusão
(C)
Temperatura de
ebulição
(C)
Substância
química a
25C e
1atm
Sólido
Metanol
(CH3OH() )
Sólido
97
Líquido
60 C
64,7
Gasoso
Mercúrio
(Hg() )
Sólido
38,87
Líquido
60 C
356,9
Gasoso
Líquido
Sólido Líquido
Gasoso
Líquido Gasoso
(F) As interações que mantêm unidas, no estado sólido, as moléculas das substâncias amônia,
metanol e acetona são forças do tipo ligações de hidrogênio (amônia e metanol) e dipolo
permanente (acetona), as quais formam cristais moleculares.
(F) Entre as substâncias listadas, o cloreto de sódio apresenta a maior temperatura de fusão, o
que se justifica em razão de seus íons estarem unidos por ligações iônicas ou eletrovalentes
(forças eletrostáticas), formando retículos cristalinos iônicos.
(V) O modelo para a formação do A(s) , no estado sólido, se baseia na interação entre os
cátions do metal que se agrupam, formando células unitárias em que as cargas positivas
são estabilizadas por elétrons semilivres, que envolvem a estrutura como uma nuvem
eletrônica, ou seja, a ligação metálica.
(V) O gás oxigênio (O2(g) ) apresenta os menores valores de temperaturas de fusão e de
ebulição, pois suas moléculas se mantêm unidas por forças de dipolo induzido, ou van der
waals, que apresentam baixa intensidade.
Resposta da questão 67:
[D]
O laurato de sacarose possui grupos hidrofólicos (fazem ligação ou ponte de hidrogênio) que
são solúveis em água e grupos lipofílicos (fazem dipolo-induzido) que são solúveis em óleo ou
gordura.
Resposta da questão 68:
[C]
Teremos:
[I] Substância apolar, consequentemente faz dipolo induzindo - dipolo induzido (van der waals).
[II] Substância apolar, consequentemente faz dipolo induzindo - dipolo induzido (van der
waals).
[III] Substância polar, devido à presença da hidroxila faz ligações ou pontes de hidrogênio.
Resposta da questão 69:
[A]
O dióxido de carbono é um composto que apresenta moléculas lineares e apolares.
A sublimação do dióxido de carbono sólido envolve o rompimento de interações do tipo dipolo
induzido.
Resposta da questão 70:
[C]
[A] Incorreta. A água é uma substância composta, formada por 2 elementos químicos: oxigênio
e hidrogênio.
[B] Incorreta. A água H2O é formada por 2 (dois) átomos de hidrogênio e 1 (um) de oxigênio.
[C] Correta. A ligação de hidrogênio presente na molécula de água, por ser um tipo de
interação forte, eleva o ponto de ebulição da água.
[D] Incorreta. A água é uma molécula polar, pois o átomo central apresenta pares de elétrons
disponíveis.
[E] Incorreta. O ângulo formado entre os átomos de hidrogênio, provocada pela repulsão dos
pares de elétrons é de 104,5.