Organic Chemistry
4th Edition
Paula Yurkanis Bruice
Aula 1
Estrutura Eletrônica
e
Ligação Química
Ácidos e Bases
Irene Lee
Case Western Reserve University
Cleveland, OH
©2004, Prentice Hall
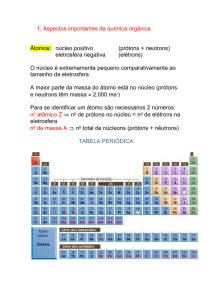
Química Orgânica
• Compostos orgânicos contêm carbono
• O carbono não ganha nem cede elétrons
• O carbono compartilha elétrons com outros átomos
de carbono, bem como com outros átomos diferentes
1
A Distribuição dos Elétrons
• A mecânica quântica usa uma equação matemática ondulatória
para caracterizar o movimento dos elétrons ao redor do núcleo
• Funções de onda ou orbitais informam sobre a energia dos elétrons
e o volume espacial em torno do núcleo, onde os elétrons têm maior
probabilidade de serem encontrados
• O orbital atômico mais próximo do núcleo tem menor energia
• Orbitais degenerados têm a mesma energia
• Princípio de Aufbau: elétrons ocupam primeiramente os orbitais de
mais baixa energia
• Princípio de exclusão de Pauli: somente dois elétrons podem ocupar
o mesmo orbital atômico, com spins opostos
• Regra de Hund: elétrons ocupam primeiro os orbitais vazios e
degenerados, antes de emparelhar
Compostos Iônicos
• Compostos iônicos são formados quando um elemento
eletropositivo transfere elétron(s) para um elemento
eletronegativo
Colocar números que indicam se a ligação é iônica ou covalente
2
Compostos Covalentes
• Compartilhamento igual de elétrons: ligação covalente
apolar (ex., H2)
• Compartilhamento de elétrons entre átomos com
eletronegatividades diferentes: ligação covalente polar
(ex., HF)
Estrutura de Lewis
Carga formal = número de elétrons de valência –
(número elétrons desemparelhados +1/2 número de elétrons
ligantes)
3
Números de ligações importantes
Uma ligação
Duas ligações
H
F
Cl
Br
I
O
Três ligações
N
C
Quatro ligações
O Dipolo
• Uma ligação polar tem lados positivos e negativos
Momento de dipolo (D) = µ = e x d
(e) : carga no átomo
(d) : distância entre duas cargas
4
Mapas Potenciais Eletrostáticos
O Orbital s
5
O Orbital p
Orbitais Moleculares (OM)
• Os OMs pertencem a molécula inteira
• ligação σ: formada pela sobreposição de dois orbitais s
• Força de ligação/dissociação de ligação: energia
requerida para quebrar a ligação ou energia liberada
em sua quebra
6
Sobreposição em fase forma um OM, uma sobreposição
fora de fase forma um OM antiligante
7
A ligação sigma (σ) é formada também através da
sobreposição frontal de dois orbitais p
A ligação pi (π) é formada através da sobreposição
lateral de dois orbitais p paralelos
Uma ligação σ é mais forte que uma π
8
Ligação no Metano e no Etano:
Ligação Simples
Hibridização de orbitais:
Os orbitais usados na formação da ligação determinam
os ângulos da ligação
• Ângulo de ligação tetrahedral: 109,5°
• Os pares de elétrons espalham-se no espaço o mais
distante possível um dos outros
9
Ligação C-C do Etano
Um Carbono Hibridizado sp2
• O ângulo de ligação no carbono sp2 é 120°
• O carbono sp2 é trigonal plano
10
Ligação C-C no Eteno: Ligação Dupla
Ligação no Etino: Ligação Tripla
• Uma ligação tripla consiste em uma ligação σ e duas π
• Ângulo de ligação do carbono sp: 180°
11
Ligação na Água
Ligação na Amônia e Amônio
12
Ligação em Haletos de Hidrogênio
Momento de Dipolo Molecular
A soma de todos os vetores individuais de dipolo determina o
momento de dipolo resultante da molécula
13
Resumo
• Uma ligação π é mais fraca que uma ligação σ
• Quanto maior a densidade de elétrons na região de
sobreposição dos orbitais, mais forte a ligação
• Quanto maior o caráter s, mais curta e mais forte a
ligação
• Quanto maior o caráter s, maior é o ângulo de ligação
Ácidos e Bases de Brønsted–Lowry
• Ácidos doam prótons
• Bases recebem prótons
• Fortes reagem para dar fracos
• Quanto mais fraca a base, mais forte o ácido conjugado
• Ácidos (bases) estáveis são fracos
14
Ácidos e Bases de Lewis
• Ácido de Lewis: substância que aceita um par de elétrons
• Base de Lewis: substância que doa um par de elétrons
Um Equilíbrio Ácido/Base
H2O + HA
H3O+ + A-
[H3O+][A-]
Ka =
[H2O][HA]
pKa = -log Ka
Ka: Constante de dissociação do ácido
15
• Quando os átomos têm o mesmo tamanho, o ácido
mais forte terá o seu próton ligado ao átomo mais
eletronegativo (variação no mesmo período)
• Quando os átomos têm tamanhos muito diferentes, o
ácido mais forte é aquele em que o próton liga-se ao
maior átomo (variação na mesma família)
16
• O efeito indutivo sacador de elétrons aumenta a acidez
de um ácido conjugado
• Ácido acético é mais ácido do que etanol
O
CH3COH
CH3CH2OH
pKa = 4.76
acetic acid
pKa = 15.9
ethanol
• A deslocalização de elétrons no ácido acético, através
de ressonância, estabiliza a base conjugada
O
O
CH3C
CH3C
O
O
Acidez do Hidrogênio Ligado à Carbonos
com Diferentes Hibridizações
HC
pKa = 25
CH
H2C
pKa = 44
CH2 CH3CH3
pKa = 50
17