Compostos naturais
biologicamente ativos
Marcia Pletschi
Universidade Federal de Alagoas
CCEN - Departamento de Química
Laboratório de Biotecnologia de Produtos Naturais
A aplicação da biotecnologia à produção de compostos naturais biologicamente ativos
m composto é biologicamente ativo quando exerce
uma ação específica sobre
um determinado ser vivo,
seja ele animal, vegetal ou
microrganismo. Uma vasta
gama de compostos orgânicos naturais de
origem vegetal, produtos do metabolismo
primário e secundário, é biologicamente
ativa, isto é, tem ação tranqüilizante, analgésica, antiinflamatória, citotóxica, anticoncepcional, antimicrobiana, antiviral,
fungicida, inseticida etc. Estes compostos
são usados para as mais diversas finalidades, tanto na terapêutica médica, para
prevenir ou curar doenças, como na indústria de cosméticos e de alimentos,
servindo como aromatizantes, flavorizantes
ou antioxidantes.
Os produtos naturais vegetais pertencem a cinco grandes classes químicas: os
carboidratos, os lipídios, os compostos
nitrogenados (aminoácidos, peptídios, proteínas e glicosidios cianogênicos e
alcalóides), os terpenóides e os
fenilpropanóides. Entre estes incontáveis
produtos, destacam-se centenas de princípios ativos: segundo o Phytochemical
Dictionary (Harborne & Baxter, 1993), o
número de compostos com atividade biológica bem caracterizada totaliza 2.793.
Este artigo tem por objetivo mostrar
como a biotecnologia pode contribuir
para a produção de compostos vegetais
úteis, com ênfase especial naqueles que
apresentam propriedades medicinais.
A importância das plantas na
medicina naturalista e moderna
A maioria das pessoas definiria planta medicinal como sendo aquela erva
colhida no fundo do quintal ou no campo,
com a qual pode-se fazer um chá, uma
tintura ou uma pomada. A utilização de
plantas no tratamento das doenças é considerada "natural" e faz parte da prática da
medicina herborística, com origem nas
tradições milenares da China e Índia. Esta
12
Biotecnologia Ciência & Desenvolvimento
forma de tratamento é usada no mundo
inteiro, principalmente pela população rural e mais carente.
Paralelamente, existe a medicina moderna surgida nos laboratórios das companhias farmacêuticas, a qual, ao contrário
do que muitos pensam, não é totalmente
sintética. Atualmente, metade dos 25 medicamentos mais vendidos no mundo tem
sua origem em produtos naturais de plantas
(incluindo os fungos). Assim, as companhias farmacêuticas, da mesma maneira
que os herboristas, dependem parcialmente da natureza para produzir as drogas que
são vendidas nas farmácias. Um exemplo
que ilustra bem esta dependência é o taxol,
um complexo diterpeno isolado originalmente da casca da árvore Taxus brevifolia,
o qual apresenta potentes propriedades
anticancerígenas. Esta substância está presente na árvore em diminutas quantidades
(cerca de 100mg/kg de casca seca), de
modo que para a produção de um grama
de taxol são necessárias três árvores. O
crescimento vagoroso, a baixa estatura, a
casca fina e a escassa distribuição das
árvores são outros fatores que limitam a
disponibilidade de taxol, além do que a
remoção da casca resulta na morte da
planta. Para contornar todos estes problemas, fontes alternativas de taxol e métodos
para sua síntese total vêm sendo investigados intensivamente. A síntese total do taxol
representou um verdadeiro desafio para os
químicos nos últimos anos, devido à complexidade da molécula, sendo que recentemente foram publicados dois métodos diferentes, cuja aplicação industrial está longe de ser viável por causa das inúmeras
etapas de reação e do alto custo de produção. O taxol também pode ser sintetizado a
partir de substâncias análogas extraídas de
outras espécies de Taxus mais abundantes
(síntese parcial) e, possivelmente, no futuro, esta metodologia substituirá o processo
extrativo da casca da T. brevifolia, usado
no momento pela indústria (Theodoridis &
Verpoorte, 1996).
Muitas pessoas acreditam que as dro-
gas sintéticas, devido ao fato de não serem
retiradas da natureza, podem provocar no
organismo reações adversas. Convém lembrar, entretanto, que muitas drogas não são
produtos da invenção dos químicos, mas
imitações da estrutura ou do modo de ação
de um composto encontrado numa planta.
A lista de substâncias sintéticas baseadas
em substâncias naturais é longa, mas o
exemplo mais familiar é o caso da aspirina
(analgésico e antitérmico), cujo princípio
ativo, o ácido acetilsalicílico, era originalmente obtido da Filipendula ulmaria (antigamente conhecida como Spiraea
filipendula, daí o nome aspirina).
Resumindo, a medicina herborística
emprega a planta inteira, partes da planta,
ou uma mistura de extratos vegetais oriundos de diferentes plantas, enquanto que a
medicina moderna emprega um composto
puro, com propriedades químicas e biológicas bem definidas.
Os processos de produção das
drogas modernas
A tecnologia apropriada para a obtenção de drogas depende do tipo de substância química desejada. Generalizando, nós
podemos dizer que existem quatro processos de produção de compostos naturais de
plantas: a síntese química total, a extração
e purificação de plantas silvestres ou cultivadas, os processos biotecnológicos e os
processos combinados de técnicas. Portanto, a biotecnologia representa uma alternativa de produção e, por isso, deve ser
entendida dentro de um contexto global,
no qual ela tem um papel de destaque
devido à sofisticação das técnicas utilizadas.
A síntese química total só é viável
economicamente quando o composto de
interesse possui uma estrutura simples,
com nenhum ou poucos centros quirais, o
que não é o caso de muitos produtos
naturais. As reservas vegetais nativas, apesar de serem a única opção para certas
drogas como o taxol, não são inesgotáveis
e o extrativismo puro e simples tem conseqüências nefastas no que diz respeito à
conservação das espécies de interesse.
Muitos princípios ativos valiosos são obtidos de plantas cultivadas, como por exemplo a morfina (analgésico, narcótico e
sedativo potente) e a codeína (usado contra a tosse), que provêm das plantações de
Papaver somniferum (Papaveraceae) da
Austrália; a digoxina (usada no tratamento
de doenças cardíacas), que provém da
Digitalis lanata (Scrophulariaceae), cultivada principalmente na Holanda; a pilocarpina
(usada no tratamento do glaucoma) que se
origina das plantações de Pilocarpus
microphyllus (Rutaceae) no Brasil; e a
vincristina e vinblastina (usada no tratamento da leucemia) são extraídas da planta
ornamental
Catharanthus
roseus
(Apocynaceae), cultivada na Tanzânia e
Estados
Unidos.
Os
processos
biotecnológicos utilizam técnicas in vitro,
rigorosamente controladas, para a cultura
de células, tecidos e órgãos vegetais ou de
plantas íntegras, técnicas estas que são
usadas durante todo o processo de produção ou durante certos estágios de produção. Finalmente, as mais variadas combinações dos processos descritos podem ser
usadas para a obtenção de drogas mais
elaboradas. Por exemplo, os esteróides
antiinflamatórios e anticoncepcionais são
derivados semi-sintéticos de precursores
(alcalóides esteroidais) extraídos de espécies de Dioscorea; o etoposídeo (usado no
tratamento do câncer de pulmão e da
leucemia mielocítica) é derivado da
podofilotoxina, obtida do Podophyllum
peltatum, uma espécie ameaçada de extinção
nos Estados Unidos e Himalaia.
A contribuição da biotecnologia à
produção de metabólitos
secundários bioativos
A biotecnologia oferece três estratégias para a produção de compostos bioativos:
os processos fermentativos, no qual o
crescimento da biomassa e a biossíntese do
produto ocorrem em biorreatores; a
micropropagação, através da qual clones
selecionados pelas suas características
fenotípicas e livres de patógenos são propagados em condições assépticas e rigorosamente controladas; e a engenharia genética, que objetiva a alteração do genoma
das células através da introdução de novos
genes e a conseqüente obtenção de células, órgãos e plantas transgênicas com
características bioquímicas alteradas.
Processos fermentativos
Há duas décadas, aproximadamente,
supunha-se que as células derivadas de
uma determinada espécie vegetal e mantidas
no estado não-organizado (cultura in vitro
de células) poderiam produzir os mesmos
compostos que a planta-mãe, e que esta
forma de cultivo poderia substituir as fontes tradicionais. Acreditava-se que este tipo
de tecnologia asseguraria aos países ricos o
suprimento constante de certos produtos
naturais de alto valor comercial, cuja disponibilidade é limitada pelas dificuldades
políticas ou geográficas dos países fornecedores. No entanto, verificou-se que as
culturas de células não produzem muitos
dos compostos de interesse, ou, se produzem, normalmente as quantidades são inferiores àquelas encontradas na planta íntegra. Isso acontece porque a produção de
metabólitos secundários é conseqüência
de processos bioquímicos altamente regulados e inter-relacionados, ou seja, é resultado da integração dos processos de
biossíntese, degradação, transporte e acumulação do produto. Para que um determinado composto seja acumulado é preciso
que os tecidos que o produzem contenham os precursores metabólicos deste
composto, as enzimas adequadas para
convertê-los no produto e as estruturas
onde o mesmo ficará armazenado e, quando este último requisito não for atendido, o
composto em questão deve ser transportado a órgãos específicos.
Certos monoterpenóides importantes
comercialmente, como por exemplo 1,8cineol e mentona, são sintetizados a partir
do mevalonato e acumulados nos pêlos
glandulares que existem na superfície das
folhas de várias espécies de Pelargonium
(Geraniaceae), mas não são detectados em
culturas de células não-organizadas (calos
e suspensões celulares). Embora o genoma
destas células seja o mesmo das células dos
tecidos da planta que os originaram, os
genes que codificam a síntese das enzimas
da rota terpenóide encontram-se inativos,
isto é, não são expressos. A ausência de
estruturas de acumulação nos calos, ou
seja, os pêlos glandulares, é outra razão
para
a
não-acumulação
destes
monoterpenóides. Ao contrário, quando as
células são regeneradas em brotos folhares,
estes acumulam 1,8-cineol e mentona em
quantidades semelhantes às folhas da planta
normal, porque nos mesmos ocorre a expressão dos genes envolvidos na biossíntese
dos referidos compostos e as estruturas de
acumulação estão presentes (Charlwood
and Moustou, 1988).
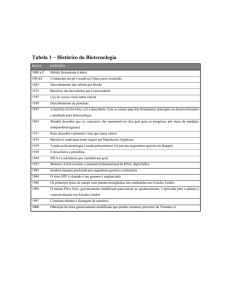
Existem inúmeros exemplos de compostos produzidos por culturas de células,
como mostra a tabela 1, porém a aplicação
desta tecnologia em escala comercial não é
viável na maioria dos casos. Os dois únicos
exemplos de compostos produzidos comercialmente através de fermentação são o
alcalóide isoquinolínico berberina (pigmento vermelho com propriedades bactericidas
usado principalmente nos cremes dentais)
e a naftoquinona shikonina (pigmento vermelho usado em cosméticos). Ambos são
produzidos industrialmente no Japão por
culturas de células selecionadas de Coptis
japonica e Lithospermum erythrorhizon,
respectivamente.
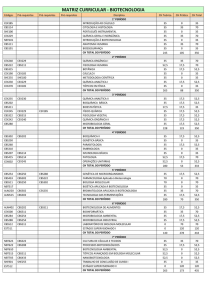
As culturas de brotos folhares e raízes
possibilitam a produção de substâncias
que são sintetizadas e acumuladas nestes
órgãos, sendo que dentro da segunda
categoria destaca-se a cultura de raízes
transformadas pela Agrobacterium
rhizogenes (as tabelas 2 e 3 mostram exemplos de compostos acumulados em tais
culturas). Esta bactéria é um organismo
patogênico que provoca a formação de
tumores (raízes) nos sítios de infecção. Os
mecanismos responsáveis pela formação
destas raízes não serão discutidos em detalhes neste artigo, mas podemos dizer, resumidamente, que os mesmos ocorrem devido à transferência de um segmento de
DNA, da bactéria para a planta. Este segmento de DNA contém vários genes, entre
os quais aqueles responsáveis pela síntese
de aminoácidos essenciais para a bactéria
(opinas) e outros responsáveis pela síntese
de enzimas envolvidas na formação de
auxinas ativas (indevidamente denominadas fito-hormônios), as quais atuam no
processo de rizogênese. As culturas de
raízes transformadas pela A. rhizogenes
apresentam muitas vantagens sobre as culturas de células e de raízes normais nãotransformadas, como maior estabilidade
genética, crescimento mais rápido e, em
muitos casos, produtividade aumentada de
metabólitos secundários. Uma revisão completa sobre o potencial biotecnológico das
raízes transformadas será publicado brevemente por integrantes da nossa equipe
(Argôlo et al., 1997).
A tecnologia de fermentação para os
tipos de culturas mencionados acima evoluiu a partir dos reatores para microrganismos, e biorreatores mais apropriados para
células e órgãos vegetais foram desenvolvidos (para maiores informações sugerimos
consultar Scragg, 1993-Plant Cell Bioreactors,
em Plant Cell and Tissue Culture). As principais desvantagens deste processo são o
alto custo de investimento necessário para
a instalação dos equipamentos industriais,
a manutenção da mão-de-obra especializada e a manutenção das condições de
produção que exigem controle rígido de
temperatura e luminosidade, bem como
meios de cultura balanceados em termos
de sais minerais, vitaminas e reguladores de
crescimento. No caso das raízes transformadas, os biorreatores são mais simples e
as condições de cultura menos exigentes, o
que amplia as possibilidades de exploração industrial deste tipo de cultura.
Micropropagação
Outra estratégia para a produção de
compostos biologicamente ativos é a seleção de clones altamente produtores e sua
propagação in vitro. A micropropagação
Biotecnologia Ciência & Desenvolvimento
13
oferece muitas vantagens para a prática
agrícola, como a maior rapidez na obtenção de um grande número de mudas e a
erradicação das pragas e doenças da cultura, principais responsáveis pela baixa produtividade da planta. A clonagem in vitro é
particularmente útil para a conservação de
espécies ameaçadas e a propagação de
espécies recalcitrantes ou de ciclo de vida
longo.
Um exemplo de planta medicinal cuja
micropropagação em escala comercial resultaria em enorme benefício social é
Artemisia annua, uma planta de origem
chinesa, que produz o sesquiterpenóide
artemisinina. Esta é uma das mais potentes
drogas antimalariais conhecidas e recomendada pela Organização Mundial da
Saúde para o tratamento dos casos de
malária cerebral, cujo agente, o Plasmodium
falciparum, se tornou resistente às drogas
derivadas da quinina. A artemisinina é
normalmente encontrada nas folhas e
inflorescências da planta em quantidades
muito baixas (aproximadamente 0,5% do
peso seco), mas que podem ser aumentadas quando plantas selecionadas dentro de
uma população são microclonadas in vitro.
(Jain et al., 1996; Gupta et al., 1996). A
necessidade de artemisinina é muito grande devido à vasta distribuição geográfica
da malária e à gravidade dos casos, os
quais aumentaram assustadoramente nos
últimos anos. Porém, como a fonte principal desta droga ainda é a planta íntegra, a
mesma não se encontra facilmente disponível no mercado, além de ser bastante
cara.
Entre outros exemplos de plantas medicinais que podem ser facilmente
micropropagadas e posteriormente
aclimatizadas, podemos citar: Coleus
forskohlii (Sharma et al., 1991), fonte de
forskolina (atividade cardiovascular); Aloe
vera (Roy e Sarkar, 1991), fonte de um gel
14
Biotecnologia Ciência & Desenvolvimento
muito rico em água, polissacarídeos e
antraquinonas com propriedades laxativas
e cicatrizantes (muito usado como hidratante
em produtos cosméticos); Camptotheca
acuminata (Jain e Nessler, 1996), fonte de
camptotecina (atividade anticâncer e antiretroviral); e Valeriana edulis ssp. procera
(Enciso-Rodrigues, 1997), fonte de
valepotriatos (propriedades sedativa, tranqüilizante e antidepressiva).
Como se pode ver, a micropropagação
também pode ser aplicada às espécies
vegetais produtoras de princípios ativos
úteis e ser explorada economicamente, da
mesma forma que a micropropagação de
espécies leguminosas, frutíferas, florestais
e ornamentais.
Engenharia Genética
A mais interessante e promissora área
da biotecnologia vegetal, na qual existe
muito interesse atualmente, é o melhoramento genético através da transferência de
genes e a conseqüente obtenção de plantas
transgênicas com características fenotípicas,
fisiológicas ou bioquímicas alteradas, mais
vantajosas sob o ponto de vista
socioeconômico.
As técnicas usadas pela engenharia
genética foram abordadas anteriormente
nesta revista (Gander e Marcellino, 1997) e,
por esta razão, concentraremos nossa atenção apenas na sua aplicação. Através desta
tecnologia é possível:
a) aumentar a atividade de uma enzima
reguladora numa rota biossintética já existente na planta e, desta forma, regular
positivamente a produção de um determinado composto (sobreexpressão de genes
constitutivos);
b) introduzir uma nova rota
biossintética na planta (expressão de genes
não-existentes normalmente);
c) suprimir parcialmente ou completa-
mente a produção de compostos
indesejados, através da inibição da(s)
enzima(s) catalisadora(s) de uma determinada porção de uma rota (supressão da
transcrição do gene ou antisense RNA).
A inserção de genes que codificam
enzimas reguladoras de rotas metabólicas
(no sentido normal de transcrição ou no
sentido inverso) nos permite estimular ou
bloquear o fluxo de carbono (precursores)
ao longo das intrincadas ramificações do
metabolismo.
Um dos exemplos mais ilustrativos de
engenharia metabólica foi a transferência,
para protoplastos de tabaco (Nicotiana
tabacum), de uma seqüência de DNA obtida do amendoim (Arachis hypogaea) que
codifica uma das enzimas (estilbeno sintase)
responsável pela formação da fitoalexina
resveratrol (composto envolvido no mecanismo de defesa da planta contra o ataque
de fungos). As plantas transgênicas de
tabaco regeneradas dos protoplastos passaram a produzir resveratrol, a partir de
dois substratos muitos comuns (p-coumaril
Coenzima A e malonato), toda vez que
eram atacadas pelo fungo Botrytis cinerea.
Este trabalho, realizado por Hain e colaboradores (1990), provou ser possível armar
uma determinada planta com mecanismos
químicos naturais de defesa, através da
introdução de uma rota metabólica até
então inexistente nesta planta. Outro exemplo foi a introdução na Atropa belladonna
de cópias extras da seqüência de DNA que
codifica a enzima hiosciamina-6-bhidroxilase, obtida de Hyoscyamus niger
(Yun et al., 1992). Esta manipulação resultou em plantas que convertem praticamente toda hiosciamina (um alcalóide com
atividade anticolinérgica, mas que provoca
efeitos colaterais indesejáveis) em
escopolamina, a qual é mais potente do
que a hiosciamina, porém bem mais tolerável. O aumento da produção de
escopolamina nas plantas transgênicas de
A. belladonna foi aproximadamente 24
vezes maior que nas plantas nãotransgênicas. Finalizando, nós gostaríamos
de mencionar o trabalho que nossa equipe
vem desenvolvendo com a A. annua, o
qual objetiva melhorar a produção de
artemisinina na planta. Recentemente, obteve-se calos transgênicos de A. annua
capazes de produzir este sesquiterpenóide
numa quantidade cinco vezes maior que as
células das culturas de calos originais,
através da inserção de cópias extras do
gene para a 3-metil-glutaril Coenzima A
redutase (HMGR), uma das enzimas reguladoras da rota terpenóide (Vergawe et al.,
1997). Atualmente, estamos trabalhando no
sentido de obtermos plantas de A. annua
transgênicas para HMGR, capazes de produzir artemisinina em quantidades superiores àquelas normalmente encontradas.
Os casos descritos acima mostram
como as rotas biossintéticas podem ser
reguladas através da manipulação das suas
enzimas, com implicações positivas para a
produção de determinados compostos medicinalmente valiosos. Atualmente, consegue-se manipular apenas parte das rotas
metabólicas, através da inserção de um ou
dois genes ao mesmo tempo, mas provavelmente num futuro próximo seremos
capazes de modificá-las completamente.
Conclusão e perspectivas futuras
Acima foram discutidos o estado de
arte na produção biotecnológica de produtos naturais e a viabilidade da aplicação
deste processo em escala comercial. Após
esta breve análise, resta-nos perguntar quais
são as perspectivas futuras para esta
tecnologia e qual é a estratégia política e
econômica mais adequada para o Brasil
com relação a esta questão. A resposta para
a primeira pergunta é que a produção
industrial de compostos secundários é presentemente uma área de intensa atividade
e continuará assim nos próximos anos,
devido à crescente demanda por novos
produtos naturais. A engenharia genética
abriu novos caminhos para a obtenção de
variedades diferentes de plantas com características bioquímicas superiores àquelas das variedades existentes, e esta
tecnologia é igualmente aplicável à manipulação de plantas que acumulam
metabólitos secundários. Quanto à segunda questão, esta deve ser examinada com
base nos recursos florestais e agrícolas do
nosso país. Estima-se que das 500 mil
espécies de plantas existentes no planeta,
16% encontram-se na Região Amazônica
brasileira, menos de 10% foram estudadas
quimicamente e apenas um pequeno número teve suas propriedades biológicas
caracterizadas. Isto significa que uma grande quantidade de compostos bioativos
ainda não foi descoberta e, possivelmente,
nunca será, porque este magnífico recurso
está se esgotando rapidamente por conta
da abertura de novas áreas agrícolas. A
agricultura brasileira sempre teve por objetivo a obtenção de produtos primários,
principalmente cereais, mas como demonstrado pelos exemplos acima, existem grandes possibilidades para uma agricultura
alternativa baseada na produção de compostos naturais de alto valor no mercado
internacional. O Brasil, naturalmente, tem a
dupla vantagem de contar com uma flora
exuberante e uma extensa superfície fértil e
arável.
Cabe às autoridades brasileiras atuar
mais efetivamente nesta área, promovendo
e incentivando a produção e
comercialização de compostos secundários valiosos. Com o advento das modernas
técnicas da biotecnologia, abriu-se uma
janela de oportunidade para o Brasil obter
a liderança no mercado de produtos naturais. Qualquer que seja a política do governo com relação à pesquisa em biotecnologia,
esta deve levar em consideração a necessidade de se melhorar os conhecimentos
sobre os valiosos princípios ativos escondidos na flora brasileira e também a necessidade de se preservar aquelas espécies que,
aparentemente, não têm valor no momento, mas que podem muito bem ter valor no
futuro.
Biotecnologia Ciência & Desenvolvimento
15