QUÍMICA ORGÂNICA
Teoria Geral
Tipos de Carbono
Dependendo do número de ligações que o átomo de carbono faz com outros carbonos, podemos
classificá-los como:
•! Primário: ligado diretamente a, no máximo, um átomo de carbono (C1);
•! Secundário: ligado diretamente a dois átomos de carbono (C2);
•! Terciário: ligado diretamente a três átomos de carbono (C3);
•! Quaternário: ligado diretamente a quatro átomos de carbono (C4).
Exemplo:
C1: A, B, D, G, H, I
C 2: E
C 3: C
C 4: F
Classificação das cadeias carbônicas
I. CADEIA ABERTA (ALIFÁTICA)
•! Quanto à sequência carbônica:
LINEAR NORMAL
Apresenta uma cadeia com duas extremidades de carbono.
RAMIFICADA
Quando a sequência carbônica apresenta mais que duas
extremidades. Em geral com carbono terciário e/ou
quaternário.
•! Quanto ao tipo de ligação entre átomos de carbono:
SATURADA
Apresenta somente ligações simples entre carbonos.
INSATURDA
Apresente pelo menos uma ligação dupla e/ou uma ligação
tripla.
Observação: Para uma cadeia ser insaturada a insaturação deve estar entre átomos de carbono, assim as
estruturas como! H2C=O, HC≡N! não configuram cadeias carbônicas insaturadas.
•
Quanto à presença de átomos diferentes no meio da sequência carbônica:
HOMOGÊNEA
Não apresenta nenhum elemento diferente do
carbono entre dois carbonos.
HETEROGÊNEA
Apresenta pelo menos um elemento diferente
do carbono entre dois carbonos. Esse átomo é
chamado de heteroátomo.
Classificação das cadeias carbônicas
II. CADEIA FECHADA (CÍCLICA)
• Quanto à presença de anel aromático:
Alicíclica - Cadeia cíclica constituída por compostos que não apresentam o anel aromático
(benzênico) em sua estrutura.
Aromática – Cadeia constituída por compostos que apresentam o anel benzênico em sua estrutura.
As cadeias cíclicas também podem ser classificadas como homogêneas ou heterogêneas e saturadas ou
insaturadas.
Exemplos:
Estrutura I – cíclica, aromática, insaturada e homogênea.
Estrutura II – aberta, ramificada, saturada e heterogênea.
Estrutura III – cíclica, alicíclica, saturada e homogênea.
Estrutura IV – aberta, normal, insaturada e homogênea.
Grupos Funcionais
Devido ao imenso número de compostos orgânicos existentes e por esses
apresentarem certas similaridades estruturais e de comportamento químico, uma
prática comum é agrupá-los de acordo com suas características.
Funções Orgânicas
Hidrocarbonetos
Alcanos
Alcanos são hidrocarbonetos de cadeia aberta que apresentam apenas ligações simples. O alcano mais simples é o
metano, CH4 (gás natural). Exemplos: metano, etano, propano, butano.
Fórmula geral: CnH2n+2 , em que n = número de átomos de carbono, e 2n+2 = número de átomos de hidrogênio.
Alcenos
São hidrocarbonetos insaturados de cadeia aberta, ou seja, apresenta uma ligação dupla entre carbonos. Exemplos: etileno
(eteno), propileno (propeno).
Fórmula geral: CnH2n
Alcinos
São hidrocarbonetos insaturados de cadeia aberta, ou seja, apresenta uma ligação tripla entre carbonos. Exemplo:
acetileno (etino).
Fórmula geral: CnH2n-2
Ciclo – alcanos
São hidrocarbonetos saturados que apresentam cadeia fechada. Nesse caso, o representante mais simples deverá ter no
mínimo três carbonos. Exemplos: ciclo – propano, ciclo – butano, ciclo – pentano, ciclo – hexano.
Ciclo – alcenos
São hidrocarbonetos de cadeia fechada que apresentam uma ligação dupla entre carbonos. Exemplos: ciclo – penteno,
ciclo – hexeno.
Aromáticos
Constituem um tipo de hidrocarbonetos especiais, do qual o representante mais simples é o benzeno, isto é, as ligações
entre os carbonos devem alternar entre simples e dupla, formando o anel aromático. Exemplos: tolueno, naftaleno,
antraceno.
Funções Orgânicas Oxigenadas
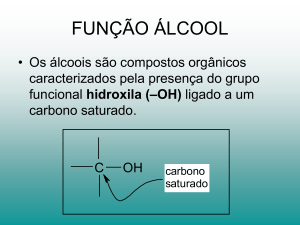
•Álcoois - presença de hidroxila (
)
! Quando um ou mais grupos hidroxilas estiverem ligados diretamente a carbonos saturados, dizemos tratarse de um álcool. O representante mais simples dessa classe de compostos é o metanol, porém o importante,
economicamente, é o álcool etílico.
! Os alcoóis podem ser classificados de acordo com o carbono qual a hidroxila está ligada. Se for a um
carbono primário, o álcool é considerado primário; se for a um carbono secundário, o álcool é secundário, e se
for a um carbono terciário, o álcool é considerado terciário.
! Não existe álcool com hidroxila ligada a carbono quaternário, pois esse tipo de carbono pela própria
definição está ligado a quatro carbonos, não tendo, portanto, ligação disponível para qualquer outro elemento
químico.
Funções Orgânicas Oxigenadas
•Fenois - presença de hidroxila (
)
! Fenóis são substâncias que trazem o grupo hidroxila ligado diretamente a um anel aromático. Com raras
exceções, a função fenol aparece junto com outras funções, formando uma função mista.
Funções Orgânicas Oxigenadas
•Aldeído - presença de carbonila
! Quando a carbonila estiver em alguma extremidade da cadeia carbônica, então estaremos diante de um
aldeído.
•Cetona
! Quando a carbonila estiver localizada no meio da cadeia carbônica a função passará a ser identificada
como cetona; sendo assim, uma cetona deverá ter, no mínimo, três carbonos. A mais simples das cetonas é
propanona, cujo nome comercial é acetona, produto muito usado como solvente de esmaltes e tintas.
Funções Orgânicas Oxigenadas
•Éteres
! São compostos que apresentam o oxigênio situado entre carbono formando uma cadeia carbônica
heterogênea. Os éteres costumam representados por R- O - R', em que R e R' são substituintes orgânicos.
•Ácidos Carboxílicos - presença de carboxila
! Quando um grupo carbonila aparece ligado a uma hidroxila, temos, então, outro tipo de grupo funcional,
chamado carboxila.
! A presença desse grupo funcional mostra-nos que a molécula pertence à outra função, a dos ácidos
carboxílicos. Essa classe de compostos tem o ácido fórmico (ácido metanoico) como seu representante mais
simples.
Funções Orgânicas Oxigenadas
•Ésteres ! Podemos considerar um éster como um derivado do ácido carboxílico, em que o hidrogênio ionizável foi
substituído por um grupamento orgânico.
Funções Orgânicas Nitrogenadas
•Aminas
! A amina pode ser entendida como um derivado da amônia na qual o(s) hidrogênio(s) foi (foram) trocado(s)
por grupamento(s) carbônico(s).
! Havendo a troca de um hidrogênio da amônia por um substituinte orgânico, a substância obtida será
classificada como amina primária; a troca de dois hidrogênios da amônia por grupamentos carbônicos produz
uma amina secundária, e, por fim, a substituição dos três hidrogênios da amônia por grupamentos carbônicos
forma uma amina terciária.
Funções Orgânicas Nitrogenadas
•Aminas
! A amina mais simples que existe é a metil-amina. Há outras mais complexas e tão Importantes quanto,
como, por exemplo: a anfetamma, que age como um estimulante; a trimetil-amina, que é responsável pelo
odor de peixe podre e que também é secretada pelo coiote e pelos cães e a putrescina, responsável pelo
cheiro desagradável de carne apodrecida.
! Uma característica muito importante das aminas é a presença de um par de elétrons livres no nitrogênio.
Esse par de elétrons pode se coordenar com outras espécies formando uma ligação. Quando isso acontece
temos a formação de sais de amônio.
Funções Orgânicas Nitrogenadas
•Amidas
São compostos que apresentam o grupo funcional:
A amida mais conhecida é a ureia, primeiro composto orgânico sintetizado em laboratório, cuja obtenção foi responsável
por mudanças conceituais em Química Orgânica.
Grupos Funcionais
!"#$%&'(#)*+%),+&'
!
Funções Orgânicas
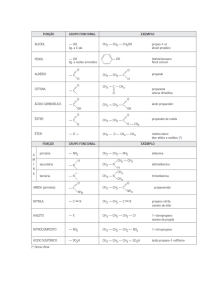
Devido ao imenso número de compostos orgânicos existentes e por esses apresentarem certas similaridades
estruturais e de comportamento químico, uma prática comum é agrupá-los de acordo com suas características.
Função
!"#$%&'()*+,#-./'(
Grupo Funcional
Representante
Uso/Características
!
3*4&-.! (.! &%*5/.! 56%*,.! -*! '.%7./8./! .,+95&'./! *:&/8*58*/! *! 7.,! *//*/! (7,*/*58(,*%! '*,8(/! /&%&;(,&-(-*/!
*/8,#8#,(&/!*!-*!'.%7.,8(%*58.!2#$%&'.<!#%(!7,=8&'(!'.%#%!>!(+,#7=?;./!-*!('.,-.!'.%!/#(/!'(,('8*,$/8&'(/1!
Como solvente e
!
É composto por apenas CXHY derivados do
Hidrocarboneto
combustível, dentre
!
carbono e hidrogênio.
petróleo
outros.
!"#$%&'
()"*&'!"#+,&#-.'
/0*)010#2-#20'
31&145-)-+20)612,+-1'
@!'.%7./8.!7.,!
D.%.!/.;4*58*!*!
DEFG!-*,&4(-./!-.!
7,8)&+-)9&#02&'
(7*5(/!'(,A.5.!*!
'.%A#/8$4*;<!-*58,*!
Como solvente,
7*8,H;*.!
B&-,.+C5&.!
.#8,./1! e
combustível
CH3CH2OH álcool
D.%.!/.;4*58*<!
Álcool
componente de
etílico (etanol)
'.%A#/8$4*;!*!
bebidas
alcoólicas,
Hidroxila
DFKDFLMF!=;'..;!
OH IB&-,.:&;(J!
:.+&&.'
'.%7.5*58*!-*!
dentre outros.
*8$;&'.!I*8(5.;J!
A*A&-(/!(;'.H;&'(/<!
-*58,*!.#8,./1!
O
Em mistura aquosa,
O
O
O%!%&/8#,(!(2#./(<!
(formol)
é usado para
Aldeído
H C
I'(,A.5&;(J!
conservar peças
IP.,%.;J!>!#/(-.!7(,(!
H
H
O
;.8068&'
NH CH
anatômicas.
'.5/*,4(,!7*Q(/!
H
H
Carbonila
Formaldeído
(5(8R%&'(/1!
N.,%(;-*$-.!
O
I'(,A.5&;(J!
Cetona
502&#-'
Como
solvente.
D.%.!/.;4*58*!
O
H3C
Carbonila
O
CH3
S'*8.5(!
Acetona
O
O
Grupos Funcionais
O
H
O
O
H
O
H
H
O
H
H
Função
Grupo Funcional
Representante
Uso/Características
O
O
CH3
O H3C
O
H C
CH3
CH3H
CH
CH
O
CH
2 - 3O - CH
2
3
H33C
C
CHO
3 analgésico e
3
Como
O
Éter
H3C
CH3
solvente.
O
O
Oxigênio como
Éter
Etílico
heteroátomo
O
Éster
O
O
O
O
O
HH
C
C
3C
3C
H3C C
O
O
O
O
O
O
HO3C CH2
H3C
CH2
H
CH2
Acetato de
3C Etila
O
Como solvente e
aromatizante.
O
OH
O
H3C
O
O
Em solução aquosa
O
OH
H
3C H C
OH
Ácido
Carboxílico
(vinagre),
é usado
no
3
OH OH
preparo de alimentos.
OH NOH
Carboxila
Ácido
acético
N
N
CH
3NH
O 2
Em
geral
apresenta
H
C
O
O
O
3
H3C
cheiro agradável.
Ligado,
pelo menos, a
Metilamina
NH CH3
N
H3C
H
um carbono
O
O
O
O
O
OH
OH
HOH
C
H
C
3
3 O
Como
adoçante,
NH CH
NH
H3C
N
N
3 CH3
Amida
analgésico
e sedativo,
H
H
NH CH
dentre outros.
Metil-acetamida
Amina
O
Regras para Nomenclatura
a cadeia principal
•Determinar
Quando a cadeia for ramificada devemos achar a cadeia principal. Para se determinar a cadeia principal:
1-!Se saturada (só ligações simples) a cadeia deverá conter a maior sequência de carbonos.
Observação: havendo
mais de uma sequência a cadeia principal deverá conter o maior número de radicais.
2-!S e a cadeia for insaturada (ligações duplas e/ou triplas) a cadeia principal deverá conter as
insaturações.
3-! Se a cadeia apresenta grupos funcionais, eles deverão estar na cadeia principal.
CH3
P
H3C
P
P
P
H2C
P
P
CH3
P
H3C
CH3
P
P
P
P
H3C
P
CH3
P
P
CH3
P
P
HO
3
3
H3C
CH3
CH3
P
P
CH3
HO
Regras para Nomenclatura
P
P
HO
para
numerar
a
cadeia
•Regras
1-!Se
saturada inicia-se pela extremidade mais próxima do radical.
HH33CC 22
CH33
CH
11
2 3
H3C
1
H33C
C
H
44 CH3
3
4 55
66
5
H3C
6
CH
CH3
77 3
CH3
2-!Se insaturada inicia-se a numeração pela extremidade mais
7
próxima da insaturação.
CH
CH33
CH3
H C 2
H22C1
2
2
H21C
1
3
3
3
CH3
4CH3
CH
4 3
4
mais
3-!Caso
exista
um
grupo
funcional,
o
carbono
da
extremidade
próxima a ele deverá ser o número um.
H3C
HH33CC
2
3
HO
HHOO
1
11
2
33
4
44
CH3
5
CH
3
CH
5 5 3
4-!Ocorrência
de heteroátomo na cadeia.
Observação:
a insaturação tem preferência sobre o radical na numeração, e o grupo funcional tem
preferência
sobre a insaturação.
Regras para Nomenclatura
•
Regras para numerar a cadeias cíclicas
1-!Se
cadeia for ramificada inicia-se a numeração pelo carbono que possuir o menor radical,
sendo que
a
os
demais
radicais devem receber a menor numeração possível. Exemplo:
CHCH
3
CH3 3
4
4
5 CH
3
45 3 3
56 6 32
2
14 1
6
5 1 23
2-etil
- 1,4-dimetil
2-etil
- 1,4-dimetil- -ciclohexano
ciclohexano
2-etil - 1,4-dimetil - ciclohexano
2-etil - 1,4-dimetil - ciclohexano
6
2
CH
1 CH
3 3 CHCH
3 3
CH3 pelo carbono da insaturação.
2-!
3
Se a
cadeia for insaturada CH
numera-se
44
CH3
CH3
5 5 4
33
5 4
3
6
22
56
3
1
1
6
2
6
1 2
H3C 1 5 5tem
3-!Se
a
cadeia
for
ramificada
e
insaturada,
a
insaturação
H3C
4
6 preferência.
H3C 4 5 6
H3C 4 3 5
61
43
6
2 1
2
3
1
3
1
H22C2
CH
2
H2C
CH2
4-!
S
e houver uma cadeia fechada
ela será como um
radical.
HH2H
CC CH
CH
CH
CH2 CH3
2C2
22
CH
CH2 CH3
H2C
H
H
C
CH
CH
CH
CH
CH
2C
2
2 2 CH
3 3
3
1
2
2
H2C
H
2C
CH
Regras para Nomenclatura
CH
2
2
CH
CH
para
numerar
a
cadeias
cíclicas
CH
CH
•Regras
H2C
H2C
CH
CH
2
2
3
3
5-
C
Ciclos
de
carbono
maiores
do que
a fórmula
geral
chamados
x
nHn ou
nHn+1 são
C
[x]anulenos,
carbonos
Anulenos
de
de
representa
o
número
de
anel.
número
ímpar
átomos
carbono são
no
com
um
ainda
caracterizadas pelo símbolo H para o sinal presença de um átomo de hidrogênio especial chamado
‘hidrogênio
indicado’. Este símbolo é inseparável do prefixo.
8
1
Exemplos:
8
1
5
5
33
44
1
1
7
7
1
1
2
2
66
66
33
55
22
7
7
2
66
33
55
44
2
44
[8]anuleno
1H-[7]anuleno
[8]anuleno
benzeno
1H-[7]anuleno
ciclohexano
benzeno
ciclohexano
Anumeração
Hidrocarbonetos
monocíclicos
não
é fixa,
como
qualquer
átomo
de
carbono
dos
pode
receber
o número ‘1’. Prefixos não destacáveis têm prioridade para os mais baixos números, e se este é o
"hidrogênio
indicado" deve receber o número ‘1’. A importância da presença de um ‘hidrogênio indicado’ é
evidente
nos anéis substituídos.
Exemplos:
CH3
11
66
11
55
77
2
3
3
44
etilbenzeno
etilbenzeno
CH
CH33
22
66
33
55
44
2-metil-1H-[7]anuleno
2-metil-1H-[7]anuleno
Regras para Nomenclatura
•Regras para numerar a cadeias cíclicas
6- Ocorrência de heteroátomo na cadeia.
4
4
3
5
3
5
2
4
2
5
O
N
H
1
4
3
2
S
1
5
3
6
2
N
1
1
H3C
Regras para Nomenclatura
Prefixos que informam o número de
carbonos
Nº de C Nome do Nº de C Nome do
prefixo
prefixo
1
met
7
hept
2
et
8
oct
3
prop
9
non
4
but
10
dec
5
pent
11
undec
6
hex
12
dodec
Tipos de ligação entre carbonos
Simples
Dupla
Tripla
an
(alcanos)
en
(alcenos, enol)
in
(alcinos)
Terminação (sufixo) que indica a
função orgânica
Hidrocarboneto - o
Ácidos carboxílicos oico
Álcool - ol
Ésteres - oato + ila
Aldeído - al
Amina - amina
Cetona - ona
Amida - amida
HH
3C
3CCH
H
C
3
2
H3C CH2
H
C
CH
CH2
3
2
H
C CH2 CH2
3
CH
H
C
CH
3
3
H
3C CH CH3
1
Regras para Nomenclatura
Principais
Radicais
H2C
CH2
H2C
CH2
CH
Grupo
Nome
Grupo
Nome
CH
2
2
2
H C CH
CH2
CH
2
3
2
CH
CH
H
C
CH
2
3
Terc-butil
H3C2 C 2CH3
H3CH C
Metil
3
ou t-butil
CH
H
C
C
3
3
CH
3 3CH3
H3CH3C
CH CCH
H3CH CCHCH
2
3
2
CH3
CH
C CH CH
Sec-butil
CH
H3CH3CCH
CH
CH
CH
3
2 2
2 2 Etil
H3C CH CH2 CH3 ou s-butil
H
C
CH2 CH3
H
CH
CHCH
3C
H3CH3
C 3CHCH
3 3
H3H
C C CH2
CH
H
C
CH
CH
3H C
CH2
CH
3
3
Propil
H3C CH2 CH2
H3C
CH CH2
Isobutil
HH
C
CH
3 C
2
CH
C CH
CH
CH
H3C2 H2CH
2 3 2
H3CH
C 3 CH CH3
3
H3C CH2 CH2
H3C CH CH3
CH
H3C H2CCHCHCH
CH
Isopropil
Fenil
2 3
H3C CH CH
CH3
CHCH
H
C
CH
CH
H
C
CH
2
2
H3C 3 CH2 2CH2 2 CH2 2
CH
H3C CH
CH
CH2
CH2
H3C CH2 CH2 CH2 Ciclopropil
Benzil
CH
CH
H3C
CH CH CH3
H3CH3CC CCH3 3
H
CH
H
C
C
H
H3C 3CH CH3 CH3
3
H
C
C
H3C CH2 CH
CH
2
2 3 CH2
CH
CH3 CH
H2C C
H3C CH
2
3
H
CH
CH
H3HC3C CH
CH
C CHCH
2 2 CH3 3
H
C
CH
H3C 3 CH 2 CH 2
23
Butil
Vinil (Etinil)
H 2C C
CH2
H3C CH
CH
H
C
CH
2
H3C3 CHCH3 CH
2
H C
CH
CH CH
CH
Regras para Nomenclatura
para nomear a cadeia
•Regras
Sequência para a nomenclatura: posição do radical – tipo do radical – posição da insaturação – prefixo
≡) – grupo funcional.
(número de átomos de carbono na cadeia principal) – tipo de ligação (−/=/
Hidrocarbonetos
Cadeias não ramificadas
• Cadeias abertas: número de carbonos + ligação predominante + terminação o
I-! But + an + o → Butano
II-! Et + in + o → Etino
•
Cadeias fechadas: ciclo + número de carbonos + ligação predominante + terminação o
III-! Ciclo + hex + en + o → Ciclo – hexeno (cicloexeno)
Cadeias ramificadas
• Cadeias abertas: localização – tipo de ramificação – números de carbonos + ligação predominante + o
IV-! 2 – metil – but + an + o → 2 – metil – butano
V-! 4 – metil – pent – 1 – eno (4 – metil – 1 – pentano)
•
Cadeias fechadas: localização – tipo de ramificação – ciclo – números de carbonos + ligação
predominante + o
VI- ! etil – ciclo – butano
Cadeias ramificadas derivadas do benzeno
VII-! localização – tipo de ramificação + benzeno
Demais funções orgânicas: É dado seguindo os mesmos critérios dos hidrocarbonetos, mas levando
em consideração a posição do grupo funcional correspondente.
• Para mais apresentações, teoria, exercícios, experiências e novidades sobre Química, acesse:
www.quimicasemsegredos.com
Produção: Gabriel A. Vilella
Copyright © Química Sem Segredos