GENÉTICA E CÂNCER
23/11/13 18:21
GENÉTICA E CÂNCER
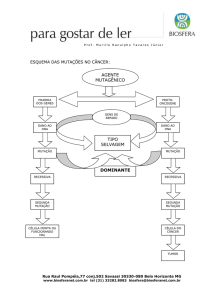
O câncer é uma doença genética, independentemente de ocorrer de forma esporádica ou
hereditária, pois a carcinogênese sempre inicia com danos no DNA. Geralmente, esses danos
são potencializados por agentes químicos, físicos ou virais. Qualquer célula normal pode ser
sítio de origem de um processo neoplásico, mas para que este aconteça é necessária uma
série de eventos, acumulados com o passar dos anos. A formação das neoplasias se dá pelo
desequilíbrio entre a proliferação celular (ciclo celular) e a apoptose (morte celular
programada). Esses eventos são regulados por uma grande quantidade de genes, que, ao
sofrerem mutações, podem ter seus produtos expressos de maneira alterada, iniciando a
formação de um tumor. Portanto, o câncer é uma doença de múltiplas etiologias. Entender
quais são os eventos relacionados ao câncer é indispensável para o desenvolvimento de
tratamentos mais eficazes e, até mesmo, para serem tomadas medidas profiláticas nos
indivíduos mais suscetíveis à doença.
Uma vez danificado o DNA, há três processos que podem ocorrer na célula: a morte
celular pelo erro em si ou pela ativação da apoptose; o reconhecimento e reparo do dano; ou,
mais raramente, a transmissão do dano para as células descendentes por falhas nos outros
mecanismos. Mesmo que isto ocorra, pode não haver conseqüências importantes para a célula;
no entanto, em alguns casos, danos ao DNA provocam uma alteração celular morfológica e
funcional chamada displasia. A displasia confere vantagem à célula, pois ela passa a
potencializar seu metabolismo anaeróbico, ficando menos susceptível a hipóxia. A displasia
pode ser diagnosticada por estudo anatomopatológico do tecido acometido e tratada
precocemente. Se isso não ocorrer, mais danos no DNA serão acumulados, e a displasia passa
a ser severa, podendo logo evoluir para um tumor maligno.
Para que a carcinogênese ocorra são necessárias algumas condições, entre elas:
-
Ocorrência de mutação não-letal que confira algum tipo de vantagem à célula (por
exemplo, vantagem proliferativa);
-
Ocorrência de outras mutações em outros genes da mesma célula que também
confiram vantagens e que não sejam letais;
-
Existência de uma instabilidade genética (acúmulo de mutações gênicas por defeitos
no reparo do DNA e/ou instabilidade cromossômica), isto é, deve haver uma
diminuição dos mecanismos de controle celular sobre as mutações. Todavia, essa
instabilidade não pode ser muito intensa a ponto de ativar o mecanismo de apoptose
celular.
Existem, basicamente, duas categorias de genes envolvidos nas formações neoplásicas:
os oncogenes e os genes supressores tumorais.
1. PROTO-ONCOGENES:
O controle das atividades celulares normais é feito por muitos tipos de genes, entre eles
http://genetica.ufcspa.edu.br/revisaogenecan.htm
Página 1 de 6
GENÉTICA E CÂNCER
23/11/13 18:21
os proto-oncogenes. Os oncogenes são proto-oncogenes que sofreram mutações ativadoras,
ou seja, que passaram a ter ganho de função ou hiperexpressão. Uma característica importante
dos oncogenes é que eles têm efeito dominante na célula, ou seja, um único alelo mutado é
suficiente para alterar o fenótipo de uma célula normal para maligna. Esses genes são
responsáveis por aumentar a proliferação celular, ao mesmo tempo em que inibem a apoptose,
eventos que podem dar início a uma neoplasia.
As mutações formadoras de oncogenes são adquiridas, uma vez que, se ocorrerem na
linhagem germinativa (mutações herdadas), são letais para o embrião. São vários os tipos de
mutações que formam oncogenes:
1.
MUTAÇÕES GÊNICAS: as formas mais comuns são as mutações
pontuais, ou seja, troca de um par de bases na fita dupla de DNA. Muito
freqüentemente são causados por agentes químicos. Um exemplo disso
é a mutação do gene RAS que será apresentada adiante.
2.
MUTAÇÕES CROMOSSÔMICAS: um mecanismo importante envolvido
na carcinogênese é a translocação cromossômica. Um exemplo clássico
desse tipo de alteração é o cromossomo Philadelphia (translocação entre
os cromossomos 9 e 22), responsável por modificar a expressão da
proteína codificada pelo gene ABL. O cromossomo Philadelphia é o
responsável pela leucemia mielóide crônica.
3.
AMPLIFICAÇÃO GÊNICA: é a existência de múltiplas cópias de um protooncogene potencializando a sua função. Pode ser encontrado em muitos
tipos tumorais, mas um exemplo importante é a amplificação do N-MYC,
gene envolvido na etiologia do neuroblastoma.
4.
SUPEREXPRESSÃO GÊNICA: é o aumento da função de um gene,
mesmo não ocorrendo aumento do número de cópias. Um exemplo é a
superexpressão do gene HER2.
Alguns exemplos de oncogenes ativados estão listados abaixo, com suas respectivas
funções na célula:
Gene RAS: foi um dos primeiros genes mutantes descoberto. O gene RAS normal codifica
as proteínas G, que se ligam ao GTP para ativar ou inibir a proliferação celular. Quando
mutado, codifica proteína anormal que não mais depende da presença de GTP ligado
para sinalizar e estimular a proliferação celular. Geralmente, a mutação que ocorre nesse
gene é a troca de apenas um par de bases (mutação de ponto).
Genes ABL / BCR: a translocação do proto-oncogene ABL do cromossomo 9 para o 22
(cromossomo Philadelphia) faz com que ele fique em justaposição ao gene BCR,
formando o gene quimérico BCR/ABL. A proteína de fusão bcr/abl, resultante da
translocação, provoca o aumento da atividade tirosina quinase normalmente
desempenhada pela abl. A presença de uma proteína abl hiperfuncional é fator
desencadeante para a leucemia mielóide crônica.
Gene MYC: algumas vezes, este gene sofre uma translocação do cromossomo 8 para o
14, ficando posicionado sob o controle dos elementos regulatórios do gene que codifica a
cadeia pesada das imunoglobulinas. Esse rearranjo provoca uma ativação transcricional
exagerada do gene MYC, desregulando totalmente a sua função. A proteína myc atua
como fator de transcrição e na expressão da telomerase; portanto, estes eventos se darão
http://genetica.ufcspa.edu.br/revisaogenecan.htm
Página 2 de 6
GENÉTICA E CÂNCER
23/11/13 18:21
de forma desordenada se a proteína estiver mutada. Esse oncogene é responsável por
um tipo importante de câncer: o linfoma de Burkitt. Como esta translocação geralmente é
balanceada, não provoca alterações evidentes no portador e pode ser transmitida a outras
gerações subseqüentes.
Gene HER2: é um proto-oncogene responsável por codificar receptores de fatores de
crescimento. Se transformado em oncogene, produz um número maior de receptores
muito sensíveis, mas pouco específicos, ou seja, responderão a qualquer estímulo
iniciando a proliferação celular. Esse gene está muito relacionado ao câncer de mama em
ambos os sexos.
Gene BCL2: responsável por regular a apoptose. A translocação entre os cromossomos
14 e 18 coloca o gene BCL2 sob o controle do enhancer do gene da cadeia pesada das
imunoglobulinas, que é extremamente ativo nos linfócitos B. Dessa forma, o gene BCL2
passa a ter uma alta taxa de expressão, codificando intensamente uma proteína com
efeitos antiapoptóticos nas células B, mecanismo que origina o linfoma de células B
folicular em 80% dos pacientes.
Genes MET e RET: são proto-oncogenes que expressam receptores de fatores de
crescimento. Quando mutados desencadeiam uma série de eventos, que, em combinação
com outros fatores, provocam o carcinoma papilar renal e o carcinoma medular da
tireóide. Esses são praticamente os únicos exemplos conhecidos de cânceres hereditários
causados por proto-oncogenes.
Genes que codificam a telomerase: são responsáveis pela fabricação da enzima de
mesmo nome, que mantém um número suficiente de repetições do tipo TTAGGG na
extremidade dos cromossomos. A reposição das repetições pela telomerase garante a
integridade dos telômeros, impedindo a destruição da célula. Porém, tal reposição é
normalmente limitada, fazendo com que a célula, com o passar do tempo, perca
telômeros, envelheça e seja eliminada. Esse é um processo importante no controle da
qualidade das células do organismo. Mutações nos genes que codificam a telomerase
podem fazer com que esta seja expressa de forma desregulada, perpetuando as células
em que atua ou, então, passe a ser expressa em células cuja atividade deveria se manter
suprimida. Esta alteração contribui para a imortalidade celular e, conseqüentemente, para
o surgimento do processo neoplásico.
2. GENES SUPRESSORES TUMORAIS:
São genes que expressam produtos que regulam negativamente o ciclo celular. Quando
mutados deixam de exercer seus papéis através de processos específicos para cada gene, que
serão vistos adiante. Apesar do meio mais comum de perda de função desses genes se dar
através de mutação na estrutura do DNA, em alguns casos, pode ocorrer silenciamento do
gene por um processo epigenético (não altera a estrutura do DNA), como a hipermetilação do
DNA, que é transmitida de maneira estável por mitose.
Hoje existem dois modelos para explicar a carcinogênese envolvendo genes supressores
tumorais. O primeiro e mais difundido é a HIPÓTESE DE KNUDSON, em que mutações devem
provocar perda de função dos dois alelos. Essas mutações têm caráter recessivo, uma vez que
um único alelo mutado não é capaz de induzir uma neoplasia. O segundo é o MODELO DA
HAPLOINSUFICIÊNCIA, em que apenas um alelo mutado, associado a eventos adicionais
promotores de tumor, seria capaz de induzir a carcinogênese, mesmo com o outro alelo
expressando-se normalmente.
http://genetica.ufcspa.edu.br/revisaogenecan.htm
Página 3 de 6
GENÉTICA E CÂNCER
23/11/13 18:21
A Hipótese dos Dois Eventos, elaborada por Alfred Knudson, em 1971, leva em
consideração que duas mutações devem ocorrer, uma em cada alelo, para desenvolver a
doença. Nos tumores de caráter hereditário, uma mutação é herdada na linhagem germinativa
e outra mutação, desta vez somática, é adquirida ao longo da vida. Nos tumores esporádicos,
as duas mutações são somáticas e adquiridas ao longo da vida. Isso explica como alguns tipos
de câncer podem ser tanto esporádicos quanto hereditários, como a polipose adenomatosa
familiar, o câncer de mama e o retinoblastoma. Essa hipótese esclarece também como algumas
doenças hereditárias não se manifestam em todos os indivíduos da família, uma vez que a
segunda mutação ocorre ao acaso.
O Modelo da Haploinsuficiência está baseado em estudos que demonstraram a
ocorrência de câncer por alteração de genes supressores tumorais, mesmo estando presente
somente um alelo mutado. A manutenção de um alelo selvagem não suporta o efeito do alelo
mutado, quer seja por produção de proteína em níveis insuficientes, quer seja por um efeito
dominante negativo, em que o alelo mutado bloqueia a atividade da proteína normal. O defeito
na expressão de um alelo contribui para a formação de tumor por conferir vantagem
proliferativa à célula (por mutação nos genes gatekeepers) ou por causar instabilidade genética
(por mutação nos genes caretakers). A haploinsuficiência não resulta diretamente em um
determinado fenótipo neoplásico, necessitando de outros eventos promotores de tumor, como
mutação oncogênica, alteração de outro gene supressor tumoral ou alterações epigenéticas.
Como já citado, os genes supressores tumorais são divididos em dois grandes grupos:
os Gatekeepers e os Caretakers.
1) GATEKEEPERS OU GENES PROTETORES: regulam diretamente o ciclo celular. São genes
de suscetibilidade para câncer.
Gene p53: presente no cromossomo 17, este gene está mutado em cerca de 2/3 dos
casos de câncer. Ele é responsável pela interrupção do ciclo celular na fase G1 quando
há qualquer alteração na seqüência de DNA, a fim de que o dano seja reparado. Se o
reparo não for feito, o gene induzirá a ativação do mecanismo de apoptose. A disfunção
desse gene faz com que o ciclo celular prossiga mesmo que haja uma mutação no DNA,
permitindo sua transmissão às células descendentes e iniciando um processo neoplásico.
Um exemplo de doença causada por alterações no p53 é a Síndrome de Li-Fraumeni,
condição em que ocorre predisposição a desenvolver câncer em vários locais, como
mama, ossos, cólon, pâncreas, entre outros.
Gene RB1: situado no cromossomo 13, produz uma proteína que bloqueia o ciclo celular
quando hipofosforilada. Nesta forma, a proteína pRB se liga ao fator de transcrição E2F,
que estimula a síntese de várias outras proteínas necessárias à continuidade do ciclo
celular. Quando o RB1 está mutado, seu produto encontra-se permanentemente
hiperfosforilado, permitindo a progressão do ciclo e dando início a um processo
neoplásico. Apesar desse gene se expressar em vários tecidos além da retina, sua
mutação resulta geralmente em retinoblastoma, hereditário (em 40% dos casos) e
esporádico (em 60% casos).
Gene APC: está localizado no cromossomo 5 e produz a proteína apc,que regula a
quantidade de b-catenina livre no citoplasma. Em condições normais, quando a célula não
precisa se multiplicar, a b-catenina se encontra ligada a E-caderina, inibindo a progressão
do ciclo celular. Se o gene APC estiver mutado, produzirá uma proteína truncada,
responsável por um aumento da porção livre de b-catenina, que é transportada para o
núcleo, ativando a transcrição de genes de proliferação celular, incluindo o MYC.
Mutações no APC provocam polipose intestinal adenomatosa de caráter familiar ou
http://genetica.ufcspa.edu.br/revisaogenecan.htm
Página 4 de 6
GENÉTICA E CÂNCER
23/11/13 18:21
esporádico e síndromes que envolvem câncer colorretal, como a síndrome de Gardner.
2) CARETAKERS OU GENES DE MANUTENÇÃO: atuam reparando danos no DNA, mantendo
a integridade genômica e evitando a instabilidade genética. Sozinhos não induzem a formação
de neoplasia, pois alterações nesses genes não conferem vantagens proliferativas à célula,
mas facilitam a ocorrência de mutações nos genes gatekeepers, as quais darão início à
carcinogênese.
·
Genes BRCA1 e BRCA2: estão presentes nos cromossomos 17 e 13, respectivamente.
São ativados nas fases G1 e S do ciclo celular. Os produtos dos dois genes estão em um
mesmo complexo multiprotéico e são responsáveis pela resposta celular às quebras do
DNA que ocorrem normalmente na recombinação homóloga ou de forma anormal
quando há danos na estrutura do DNA. Se mutados, predispõem ao aparecimento de
câncer de mama e de ovário, que tanto podem ter caráter esporádico quanto hereditário.
·
Genes MMR: são genes responsáveis por reparar erros de pareamento do DNA
(mismatch repair genes). Há inúmeros genes de reparo existentes, mas somente alguns
já foram identificados como causadores de tumores como: MLH1, MSH2, PMSL1,
PMSL2 e MSH6. Mutações nesses genes provocam aumento da incidência de mutações
de ponto no DNA e tendência à instabilidade dos microssatélites. Essa instabilidade é
chamada de fenótipo Erro de Replicação Positivo (RER+), que ocorre em vários tipos de
tumores. Alterações nos genes de reparo provocam, mais freqüentemente, câncer
colorretal hereditário sem polipose, mas também são responsáveis por cânceres
intestinais esporádicos.
Muitas descobertas acerca da origem do câncer já foram feitas; todavia, ainda se fazem
necessários estudos mais aprofundados sobre o assunto. Hoje se sabe que a base da doença
é genética e que a chance de desenvolvê-la aumenta ao herdar mutações ou ao se expor a
agentes químicos, físicos e virais que provocam mutações e alterações epigenéticas no DNA.
Especial atenção deve ser dada às chamadas síndromes de câncer hereditário. As
síndromes de câncer hereditário são afecções genéticas nas quais neoplasias malignas
parecem se aglomerar em certas famílias. Apenas uma pequena parcela dos cânceres
relatados pode ser considerada parte de uma síndrome de câncer hereditário. A maior parte
resulta de defeitos na replicação do DNA, em seus mecanismos de controle, ou da ação de
agentes carcinógenos. Algumas das características clínicas associadas ao câncer hereditário
incluem idade precoce ao diagnóstico; múltiplas neoplasias em um mesmo indivíduo; múltiplos
membros de uma mesma família apresentando a mesma neoplasia ou neoplasias relacionadas;
e múltiplas gerações acometidas.
A identificação de indivíduos em risco para câncer hereditário é importante por várias
razões. Primeiro, porque indivíduos afetados apresentam risco cumulativo vital muito superior
ao da população em geral para vários tipos de câncer. Segundo, porque outros familiares de
um indivíduo afetado podem estar em risco para o câncer hereditário (como a maioria dessas
doenças genéticas segue herança autossômica dominante, 50% dos irmãos e 50% dos filhos
de um afetado podem ser portadores da mesma mutação que está levando ao câncer).
Terceiro, porque medidas de rastreamento intensivo e intervenções preventivas (cirurgias
profiláticas e quimioprofilaxia) se mostraram eficazes em reduzir significativamente o risco de
câncer em portadores de tais mutações.
Os conhecimentos adquiridos já estão sendo usados no tratamento das neoplasias, mas no
http://genetica.ufcspa.edu.br/revisaogenecan.htm
Página 5 de 6
GENÉTICA E CÂNCER
23/11/13 18:21
futuro a doença será combatida com muito mais sucesso e precisão. A escolha do tratamento
será feita com base em estudos moleculares individuais para cada paciente. Além disso, o
avanço nos estudos sobre o câncer tornará possível não só tratar a doença, mas preveni-la.
http://genetica.ufcspa.edu.br/revisaogenecan.htm
Página 6 de 6