Lista de Termoquímica – Prof. Paulo Carollo
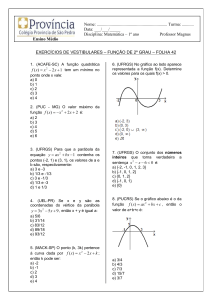
1. (UFRGS) Considerando a reação representada
bromo ao alceno, representada pela equação.
pela equação termoquímica
N‚ (g) + 3H‚ (g) ë 2NHƒ (g) ÐH= -22kcal
são feitas as seguintes afirmações.
I - A quantidade de energia liberada será maior se o
produto obtido for dois mols de NHƒ no estado
líquido.
II - A decomposição de 6,8 g de NHƒ(g) absorve 4,4
kcal.
III -
A entalpia de formação da amônia é de
-11kcal.mol−¢.
a) - 23 kcal.
b) + 23 kcal.
c) - 43 kcal.
d) - 401 kcal.
e) + 401 kcal.
Quais são corretas?
3. (UFRGS) Dadas as equações termoquímicas, a 1
a) Apenas I.
atm e 25°C.
b) Apenas I e II.
c) Apenas I e III.
1 - CH„(g) + 2 O‚(g) ë CO‚(g) + 2 H‚O(Ø)
d) Apenas II e III.
ÐH =
-888 kJ/mol
e) I, II e III.
2. (UFRGS) Dadas as energias de ligação em
kcal.mol−¢
2 - C‚H†O(Ø) + 3 O‚(g) ë 2 CO‚(g) + 3H‚O(Ø)
ÐH‚
= -1373 kJ/mol
3 - CˆHˆ(Ø)+25/2 O‚(g) ë 8 CO‚(g)+9 H‚O(g)
C = C ë 143
ÐHƒ = -5110 kJ/mol
C - H ë 99
C - Br ë 66
4 - H‚(g) + 1/2 O‚(g) ë H‚O(Ø)
Br - Br ë 46
ÐH„ = -286
kJ/mol
C - C ë 80
A variação de entalpia da reação de adição de
www.ativacao.com
é igual a
3344-2700
5 - C(grafite) + O‚(g) ë CO‚(g)
ÐH… = -393,5
pag.1
Lista de Termoquímica – Prof. Paulo Carollo
kJ/mol
e) 1/ ÐH° ‚‰ˆ
o combustível que libera a maior quantidade de
6. (UFRGS) O calor de formação do CO‚(g) na
calor, por grama consumido é
temperatura de 25°C é ÐH°‚‰ˆ=-393,5kJ/mol. A
partir desse dado, pode-se afirmar que o efeito
a) CH„ (g)
térmico, ÐH°‚‰ˆ, resultante da combustão de 1
b) C‚H†O (Ø)
grama de carbono, é igual a
c) CˆHˆ (Ø)
Dado: C = 12 u
d) H‚ (g)
a) - 393,5 kJ
e) C (grafite)
b) - 32,8 kJ
c) 32,8 kJ
4. (UFRGS) A reação de neutralização entre um
d) 131,2 kJ
ácido forte e uma base forte libera uma quantidade
e) 393,5 kJ
de calor constante e igual a 58kJ por mol de H‚O
formado. Das reações representadas a seguir,
7. (UFRGS) Dentre as alternativas abaixo, assinale
apresenta ÐH=-58kJ/mol a reação:
aquela que contém a reação cuja variação de
entalpia deve ser, necessariamente, medida por via
a) NH„OH + HCØ ë NH„CØ + H‚O
indireta, utilizando-se a Lei de Hess e alguns valores
b) H‚S + NaOH ë NaHS + H‚O
experimentais de entalpia de formação e de entalpia
c) KOH + HCØ ë KCØ + H‚O
de combustão.
d) H‚SO„ + Ca(OH)‚ ë CaSO„ + 2H‚O
e) HCN + CuOH ë CuCN + H‚O
a) C (grafite) + O‚(g) ë CO‚(g)
5. (UFRGS) Se o efeito térmico da reação A + B ë
b) H‚(g) + 1/2 O‚(g) ë H‚O(Ø)
R + S é ÐH°‚‰ˆ, o efeito térmico da reação química
2R+2Së2A+2B é igual a
c) 1/2 H‚(g) + 1/2 CØ‚(g) ë HCØ(g)
a) - ÐH° ‚‰ˆ
d) C (grafite) + 2 H‚(g) ë CH„(g)
b) - 1/2 ÐH° ‚‰ˆ
c) - 2 ÐH° ‚‰ˆ
e) 1/2 N‚(g) + 3/2 H‚(g) ë NHƒ(g)
d) ÐH° ‚‰ˆ
www.ativacao.com
3344-2700
pag.2
Lista de Termoquímica – Prof. Paulo Carollo
8. (UFRGS) Os valores de energia de ligação entre
alguns átomos são fornecidos no quadro abaixo.
a) a zero.
b) ao calor de vaporização da água.
c) ao calor de fusão do gelo.
d) ao calor de condensação do vapor de água.
e) ao calor de solidificação da água.
10.
(UFRGS)
Considere
as
equações
termoquímicas a seguir.
Utilizando as equações da figura 1, pode-se deduzir
o valor de ÐH° para a reação de formação de
radicais hidroxila, segundo a reação representada
Considerando a reação representada por
pela equação da figura 2.
CH„(g) + 2 O‚(g) ë CO‚(g) + 2 H‚O(v)
o valor aproximado de ÐH, em kJ, é de
a) -820
b) -360
c) +106
d) +360
e) +820
9. (UFRGS) Considere as seguintes reações, na
O valor de ÐH° assim obtido é de
temperatura de 25 °C.
a) +65,8 kJ.
H‚(g) + 1/2 O‚(g) ë H‚O(Ø)
(ÐH)
H‚(g) + 1/2 O‚(g) ë H‚O(s)
(ÐH)‚
b) -111,9 kJ.
c) +104,8 kJ.
d) -150,9 kJ.
A diferença entre os efeitos térmicos, (ÐH) - (ÐH)‚,
e) +267,9 kJ.
é igual
www.ativacao.com
3344-2700
pag.3
Lista de Termoquímica – Prof. Paulo Carollo
11. (UFRGS) O gás natural veicular (GNV) é um
energia) ou exotérmicos (liberam energia). Assinale
combustível alternativo, menos poluente, de menor
a alternativa que contém apenas fenômenos
custo por quilômetro, onde o metano (CH„) é o
exotérmicos ou apenas fenômenos endotérmicos.
componente predominante. Sabe-se que um mol de
a) explosão de fogos de artifício - combustão em
metano libera cerca de 890 kJ/mol, em uma
motores de automóveis - formação de geada
combustão completa. A energia liberada, em kJ, na
b) secagem de roupas - formação de nuvens -
combustão total de 800 g de metano no motor de um
queima de carvão
automóvel movido por GNV é de, aproximadamente,
c) combustão em motores de automóveis - formação
a) 2 700.
de geada - evaporação dos lagos
b) 12 800.
d) evaporação de água dos lagos - secagem de
c) 14 240.
roupas - explosão de fogos de artifício
d) 44 500.
e) queima de carvão - formação de geada -
e) 712 000.
derretimento de gelo
12.
(UFRGS)
Em
nosso
cotidiano
ocorrem
processos que podem ser endotérmicos (absorvem
www.ativacao.com
3344-2700
pag.4
Lista de Termoquímica – Prof. Paulo Carollo
GABARITO
1. [E]
2. [A]
3. [D]
4. [C]
5. [C]
6. [B]
7. [D]
8. [A]
9. [C]
10. [B]
11. [D]
12. [A]
www.ativacao.com
3344-2700
pag.5