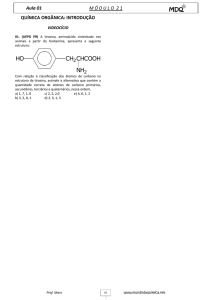
Universidade Federal Rural do Semi­Árido ­ UFERSA 1. Isomeria Espacial ou Geométrica Quando a ligação entre dois átomos de carbono permite que haja rotação entre eles, a posição que os ligantes de um átomo de carbono assumem em relação aos ligantes do outro átomo de carbono no espaço não é relevante. Isso ocorre quando dois átomos de carbono fazem apenas ligações sigma. Observe a figura abaixo: H
H
H
C
Cl
C
H
H
H
Cl
H
C
C
Cl
H
Cl
H
H
Cl
C
C
Cl
H
H
As moléculas acima representam o mesmo composto, apenas os átomos de carbono fizeram uma rotação em torno do eixo da ligação sigma carbono‐carbono. Entretanto, quando a ligação entre os átomos de carbono é “rígida” e não permite a rotação, a posição que os ligantes de átomo de carbono assumem em relação aos ligantes do outro carbono no espaço adquirem uma importância fundamental, pois dá origem a compostos diferentes. A Isomeria Espacial estuda a ocorrência desse fenômeno e pode ser dividida em dois casos: a) Compostos de Cadeia Acíclica (aberta) b) Compostos de Cadeia Cíclica (fechada) a) Compostos de Cadeia Acíclica (aberta) Como os dois orbitais p que formam a ligação π devem estar paralelos para se encontrarem em sobreposição máxima, a rotação livre da ligação dupla não ocorre. Se a rotação ocorresse, os dois orbitais p poderiam não apresentar sobreposição perfeita e a ligação π poderia se quebrar. 1 Prof. Ms. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido ­ UFERSA Figura 1: Mostra a perfeita sobreposição lateral perfeita dos orbitais p, necessária para a formação da ligação π. Para poder haver a rotação entorno da ligação dupla deve‐se aplicar quantidade de energia de 63 kcal/mol o que é muito maior do que a energia necessária para se rotacionar uma molécula entorno de uma ligação simples carbono‐carbono, que é de apenas 2,9 kcal/mol. Devido a esta impossibilidade de rotacionar uma molécula em torno da ligação dupla carbono‐carbono, um alceno como, por exemplo, o 2‐buteno pode existir sob duas formas distintas: os hidrogênios ligados aos carbonos sp2 podem estar ligados do mesmo lado ou de lados opostos à ligação dupla. O isômero que apresenta os hidrogênios no mesmo lado da ligação dupla é chamado isômero cis, e o isômero com os hidrogênios em lados opostos na ligação dupla é chamado isômero trans. Um par de isômeros como cis‐2‐buteno e trans‐2‐buteno são chamados isômeros cis­trans ou isômeros geométricos. Os isômeros cis‐trans têm a mesma fórmula molecular, tem a mesma conectividade, mas diferem na forma como os átomos são arranjados no espaço, por isso também comumente são chamados isômeros espaciais. Em outras palavras, quando dois átomos de carbono fazem uma ligação dupla, impossibilitando a rotação da ligação carbono‐carbono. Qualquer tentativa de rotação entre os átomos de carbono ocasiona o rompimento da ligação. Assim, a ligação dupla é considerada uma ligação “rígida”. Deste modo, a configuração genérica abaixo exemplifica bem o fenômeno da isomeria geométrica. 2 Prof. Ms. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido ­ UFERSA a
a
a
C
b
C
C
b
b
b
cis
onde a é diferente de b
C
trans
a
Exemplo 1: Isomerismo cis e trans para o 2‐buteno. H
H
C
H
C
H3C
CH3
C
CH3
C
H3C
cis‐2‐buteno
H
trans‐2‐buteno
Exemplo 2: Isomerismo cis e trans para o 1,2‐Dicloroeteno H
H
C
Cl
H
Cl
C
C
Cl
Cl
cis‐1,2‐Dicloroeteno
C
H
trans‐1,2‐Dicloroeteno Se em um dos carbonos sp2 da ligação dupla ligação estiver ligado a dois substituintes iguais, só existe uma estrutura possível para o alceno. Em outras palavras, isômeros cis e trans não são possíveis para alcenos que apresentam substituintes idênticos ligados a um dos carbonos da ligação dupla. 3 Prof. Ms. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido ­ UFERSA isômeros cis e trans não são possíveis para estas substâncias
porque dois grupos no mesmo carbono são iguais
H
CH3
C
H2CH3C
C
H
CH3
C
H
C
H3 C
2‐propeno
CH3
2,3‐dimetilpent‐2‐eno
Isômeros cis e trans apresentam propriedades físicas, como ponto de ebulição e momentos dipolos diferentes. Sendo assim, estes isômeros podem ser separados um do outro. Note que o trans‐2‐buteno e o trans‐1,2‐dicloroeteno possuem momentos dipolo (µ) igual a zero porque os momentos dipolares das ligações se cancelam, veja abaixo: H3 C
CH3
C
H
H3C
H
C
C
H
cis‐2‐buteno
PE = 3,7 oC
m = 0,33 D
H
Cl
Cl
C
C
CH3
trans‐2‐buteno
PE = 0,9 oC
m =0D
H
Cl
C
H
C
H
cis‐1,2‐dicloroeteno
PE = 60,3 oC
m = 2,95 D
H
C
Cl
trans‐1,2‐dicloroeteno
PE = 47,5 oC
m= 0D
b) Compostos de Cadeia Cíclica (fechada) Quando átomos de carbono estiverem ligados formando uma cadeia cíclica, eles jamais poderão fazer uma rotação completa entorno de seus eixos sem que haja o rompimento de ligações. Assim, uma estrutura cíclica é uma espécie de estrutura “rígida”. Deste modo, traçando uma linha imaginária no sentido da ligação dos átomos de carbono que possuem ligantes diferentes, se dois grupos idênticos estão do mesmo lado de uma ligação do anel, o composto pode ser designado como cis; se eles estiverem em lados opostos, poderá ser designado como trans. 4 Prof. Ms. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido ­ UFERSA Exemplo 1: Isomerismo cis e trans para o 1,2‐Dimetilciclopentano H2
C
H2
C
H2C
C
H3 C
CH2
H2 C
CH2
C
C
CH3
H
H3C
H
C
H
H
CH3
trans‐1,2‐Dimetilciclopentano cis‐1,2‐Dimetilciclopentano
Exemplo 2: Isomerismo cis e trans para o 1,2‐dibromociclopentano Br
Br
H
H
cis‐1,2‐dibromociclopentano
Br
H
H
Br
trans‐1,2‐dibromociclopentano Exemplo 3: Isomerismo cis e trans para o 1,4‐dimetilciclopentano H
H
H
H3 C
CH3
CH3
H
tran‐1,4‐dimetilcicloexano
H3C
cis‐1,4‐dimetilcicloexano
5 Prof. Ms. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido ­ UFERSA 1.1.1 Isomeria E­Z Os termos cis e trans podem se tornar ambíguos se forem aplicados a alcenos cujos átomos de carbono da dupla possuam, em conjunto, mais que dois ligantes diferentes. Os isômeros E­Z, assim como os cis‐trans, podem também ocorrer nos casos em a molécula é uma cadeia fechada. a
C
b
a
a
c
C
C
C
b
c
d onde a b c d O sistema de nomenclatura E­Z foi proposto pelos químicos Cahn‐Ingold‐
Prelong. No qual, se baseia nos números atômicos dos ligantes, onde o ligante que tiver o maior número atômico terá maior prioridade. Se os grupos de maior prioridade estiverem no mesmo lado da ligação dupla, o isômero tem a configuração Z (a letra Z vem da palavra alemã zusammen, que significa “junto”). Caso os grupos de maior prioridade estejam em lados opostos da ligação dupla, o isômero tem configuração E (a letra E vem da palavra alemã entgegen, que significa “oposto”). menor prioridade
menor prioridade
C
C
maior prioridade
maior prioridade
isômero Z
menor prioridade
maior prioridade
C
C
menor prioridade
maior prioridade
isômero E
6 Prof. Ms. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido ­ UFERSA a) Isomerismo E­Z em Compostos Acíclicos As prioridades relativas para os grupos ligados aos carbonos sp2 são determinadas com a utilização das seguintes regras: •
Regra 1: As prioridades relativas dos dois grupos ligados a um carbono sp2 dependem do número atômico dos átomos que estão ligados diretamente ao carbono sp2. O maior número atômico é o de maior prioridade. Vamos analisar o exemplo do 2‐bromo‐1‐cloro‐prop‐2‐eno. maior prioridade
maior prioridade
Cl
C
H
Cl
Br
CH3
C
C
CH3
H
C
Br
Em um dos átomos de carbono sp2 o Br, como tem número atômico maior do que o H, apresenta maior prioridade. O outro carbono sp2 está ligado a Cl e a C. O Cl tem maior número atômico do que C (observe que você pode usar o número atômico do carbono, mas não a massa do grupo CH3 porque as prioridades estão baseadas nos número atômicos, e não nas massas dos grupos). O isômero da esquerda tem os grupos de maior prioridade (Br e Cl) no mesmo lado da dupla ligação, assim, este é o isômero Z. O isômero da direita tem os grupos de maior prioridade em lados opostos da ligação dupla; desse modo, este é o isômero E. •
Regra 2: Caso os dois substituintes ligados ao carbono sp2 se iniciem com o mesmo átomo ligado ao carbono da dupla ligação (há um empate), deve‐se continuar o movimento para “fora” no sentido dos átomos que estão ligados ao carbono “empatado”, observando o número atômico destes átomos adjacentes. 7 Prof. Ms. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido ­ UFERSA CH3
ClH2C
CH3
CHCH3
C
Cl
C
CHCH3
C
Cl
CH2OH
C
ClH2C
Z‐3,4‐dicloro‐2‐isopropilpent‐2‐en‐1‐ol
CH2OH
E‐3,4‐dicloro‐2‐isopropilpent‐2‐en‐1‐ol
Em um dos átomos de carbono sp2 temos o Cloro, que apresenta maior número atômico do que o carbono. Assim, o grupo Cl apresenta maior prioridade. Ambos os átomos ligados ao outro carbono sp2 são C (do CH2OH e do CH(CH3)2), de modo que há um empate neste ponto. O C do CH2OH está ligado a O, a H e a outro H. Já o C do grupo CH(CH3)2 está ligado a C, a outro C e a H. Desses seis átomos, o O tem o maior número atômico. Sendo assim, o grupo CH2OH apresenta maior prioridade que o grupo CH(CH3)2 (observe que não se pode somar os números atômicos; deve‐se apenas usar o átomo que possua maior número atômico). Exemplo: Isomerismo E‐Z para o 3‐Metilpent‐2‐eno H3C
H2C
C
H
CH3
C
CH3
C
CH3
Z‐3‐Metilpent‐2‐eno
•
H3 C
H
C
H2 C
CH3
E‐3‐Metilpent‐2‐eno
Regra 3: Se um átomo está ligado duplamente com outro átomo, o sistema de prioridades trata como se estivesse usando ligações simples a outros dois átomos do mesmo elemento. Caso um átomo esteja ligado triplamente com outro átomo, o sistema de prioridades trata como se ele estivesse ligado a três átomos do mesmo elemento. Por exemplo, um dos carbonos sp2 no seguinte par de isômeros está ligado ao grupo CH2CH3 e ao grupo CH=CH2: 8 Prof. Ms. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido ­ UFERSA HOH2C
HC
C
H3C
CH2
C
H3C
HC
C
CH2CH3
Z‐3‐etil‐2‐metilpent‐2,4‐dien‐1‐ol
HOH2C
CH2
C
CH2CH3
E‐3‐etil‐2‐metilpent‐2,4‐dien‐1‐ol Uma vez que os átomos ligados aos carbono sp2 são ambos C, há um empate. O primeiro carbono do grupo CH2CH3 está ligado C, a H e a outro H. Oprimeiro carbono do grupo CH=CH2 está ligado a H e ligado duplamente a C. Assim, é considerado como se estivesse ligado a C, a outro C e a H. Um carbono é cancelado nos dois grupos, restando dois H no grupo CH2CH3 e um C e um H no grupo CH=CH2. O C tem maior prioridade do que H; logo, CH=CH2 apresenta maior prioridade do que CH2CH3. Os dois átomos que estão ligados ao outro carbono sp2 são C, havendo outro empate. O C esta ligado a três hidrogênios no grupo CH3. Já o outro C está ligado a dois hidrogênios e um oxigênio. Como o oxigênio tem maior prioridade, então o grupo CH2OH apresenta maior prioridade. b) Isomerismo E­Z em Compostos Cíclicos Os isômero E­Z para os compostos cíclicos seguem as mesmas regras estudadas para os compostos de cadeia aberta com a diferença que os carbonos a serem analisados são hibridizados em sp3 e são membros integrantes do anel. Exemplo: Isomerismo E‐Z para o 1‐Cloro‐1‐etil‐2‐metilciclobutano Cl
H2 C
C
CH2
C
CH3
H3C
C
H
H2
Z‐1‐Cloro‐1‐etil‐2‐metilciclobutano
H3 C
H2H2C
C
C
Cl
CH2
C
CH3
H
E‐1‐Cloro‐1‐etil‐2‐metilciclobutano 9 Prof. Ms. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido ­ UFERSA Exemplo: Isomerismo E‐Z para o 1‐Cloro‐1‐metil‐2‐metilcicloexano H3C
Cl H
CH3
Z‐1‐Cloro‐1‐metil‐2‐metilcicloexano
H3C
Cl CH3 H
E‐1‐Cloro‐1‐metil‐2‐metilcicloexano 2. Referências 1. SOLOMONS, T. W.; GRAHAM; CRAIG FRYHLE. Química Orgânica. 8. ed. Rio de Janeiro: LTC, 2005. 1 e 2 v. 2. BRUICE, P. Y. Química Orgânica. 4. ed. São Paulo: Pearson, 2006 3. ALLINGER, N. L. Química Orgânica. 2. ed. Rio de Janeiro: Guanabara, 1978. 10 Prof. Ms. Zilvam Melo – Química Orgânica