Universidade do Estado de Santa Catarina
Lista de exercícios sobre estruturas cristalinas
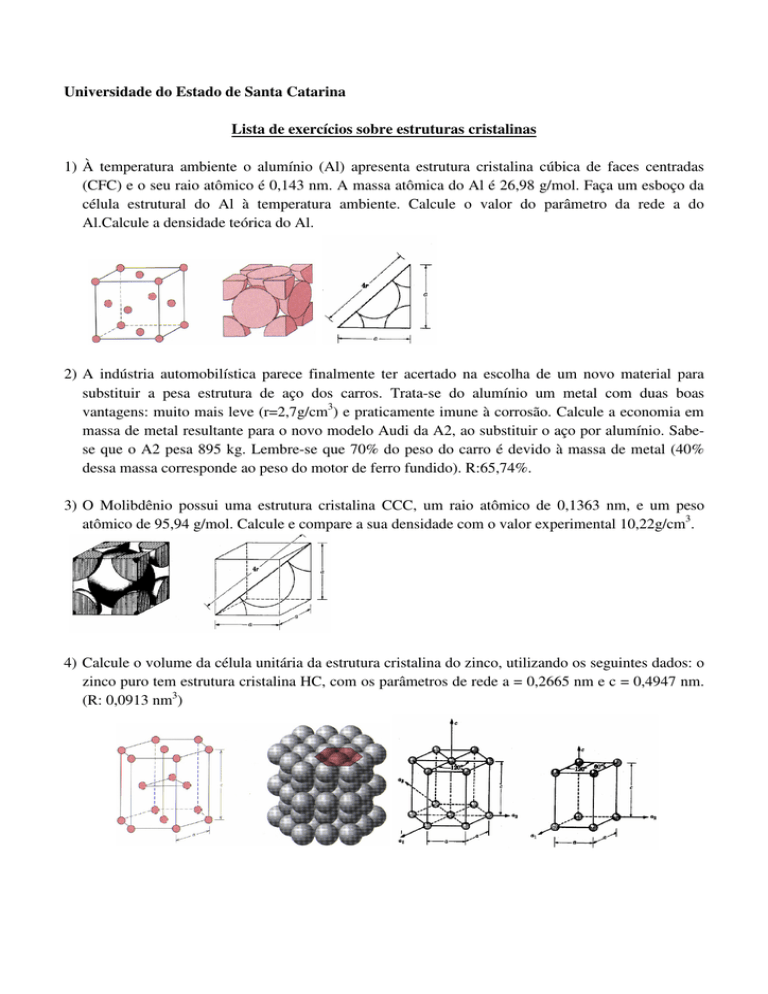
1) À temperatura ambiente o alumínio (Al) apresenta estrutura cristalina cúbica de faces centradas
(CFC) e o seu raio atômico é 0,143 nm. A massa atômica do Al é 26,98 g/mol. Faça um esboço da
célula estrutural do Al à temperatura ambiente. Calcule o valor do parâmetro da rede a do
Al.Calcule a densidade teórica do Al.
2) A indústria automobilística parece finalmente ter acertado na escolha de um novo material para
substituir a pesa estrutura de aço dos carros. Trata-se do alumínio um metal com duas boas
vantagens: muito mais leve (r=2,7g/cm3) e praticamente imune à corrosão. Calcule a economia em
massa de metal resultante para o novo modelo Audi da A2, ao substituir o aço por alumínio. Sabese que o A2 pesa 895 kg. Lembre-se que 70% do peso do carro é devido à massa de metal (40%
dessa massa corresponde ao peso do motor de ferro fundido). R:65,74%.
3) O Molibdênio possui uma estrutura cristalina CCC, um raio atômico de 0,1363 nm, e um peso
atômico de 95,94 g/mol. Calcule e compare a sua densidade com o valor experimental 10,22g/cm3.
4) Calcule o volume da célula unitária da estrutura cristalina do zinco, utilizando os seguintes dados: o
zinco puro tem estrutura cristalina HC, com os parâmetros de rede a = 0,2665 nm e c = 0,4947 nm.
(R: 0,0913 nm3)
Lista de exercícios sobre Teoria do orbital molecular
3.45) Desenhe um diagrama de níveis de energia dos orbitais moleculares e determine a ordem de
ligação esperada para cada uma das seguintes espécies: (a) Li2 (b) Li2+ (c) Li2-. Decida se cada
molécula ou íon tem caráter paramagnético ou diamagnético. No caso de ser paramagnético, dê o
numero de elétrons não-emparelhados.
3.47) (a) Escreva, com base na configuração da molécula neutra O2, a configuração dos orbitais
moleculares de Valencia de (1) O2-, (2) O2+, (3) O22- (b) Dê a ordem de ligação esperada para cada
espécie. (c) Quais dessas espécies são paramagnéticas, se houver alguma? (d) O orbital ocupado de
mais alta energia tem caratês sigma ou pi?
Lista de exercícios sobre oxidação-redução e eletroquímica
1) Diga se a reação é catódica ou anôdica:
a) Fe++ + 2e Feo
b) Cuo Cu++ + 2e
2) Complete as reações abaixo, indique e explique, pela posição na tabela de potenciais de eletrodo,
quais são as possíveis e as impossíveis:
Exemplo: Zno + Fe2+ A reação é possível pois o Eoxid. do Zn > Eoxid. Fe.
a) Fe2+ + Cu b) 2Li + Sn2+ c) Ti + Ni2+ d) Ag+ + Au e) 2Al + 3Cu2+ f) Mg2+ + Fe g) Zn + Cu2+ h) H2 + Mn2+ i) Ca2+ + 2Na 3) Calcular o potencial das pilhas galvânicas formadas em condições padrões
materiais, indicando as semi-reações do ânodo e do cátodo.
Exemplo:
a) Al e Fe
Alo Al3+ + 3e (x 2)
Fe2+ + 2e Feo (x 3)
2Alo 2Al3+ + 6e (anodo)
3Fe2+ + 6e 3Feo (cátodo)
2Alo + 3Fe2+ 2Al3+ + 3Feo
Eo = Ecatodo - Eânodo
Eo = (-0,44) – ( - 1,66) = 1,22 V
pelos seguintes
b) Mg e Fe
c) Zn e Fe
d) Fe e Cu
e) Al e Cu
f) Zn e Mg
g) Ni e Ag
h) Cd e Ni
i) Cu e Ag
4) Calcular o potencial de eletrodo dos seguintes materiais nas respectivas concentrações usando a
equação de Nersnt:
a) Fe imerso em solução 0,1M de Fe2+
b) Zn imerso em solução 0,01M de Zn2+
c) Fe imerso em solução 10 M de Fe2+
d) Cu imerso em solução 0,001M de Cu2+
e) Ag imerso em solução 0,5M de Ag+
5) Qual o potencial desenvolvido quando se constrói uma pilha constituída por:
a) Zn/Zn2+ (0,01M)//Cu2+(0,1M)/Cu
b) Zn/Zn2+ (0,001M)//Fe2+(0,01M)/Fe
c) Ti/Ti2+ (0,2M)//Sn2+(1M)/Sn
d) Cu/Cu2+ (0,5M)//Au3+(0,1M)/Au
6) Calcule o potencial das pilhas de concentração diferencial abaixo e indique onde será o ânodo e o
cátodo:
a) Eletrodos de Fe em contato com soluções de Fe2+ com 0,01M e 0,1M
b) Eletrodos de Zn em contato com soluções de Zn2+ com 0,01M e 0,1M
c) Eletrodos de Cu em contato com soluções de Cu+ com 0,0001M e 0,01M
d) Eletrodos de Ni em contato com soluções de Ni2+ com 0,02M e 0,2M
7) Temos uma pilha formada por eletrodos de Zn imersos em soluções 0,1M de Zn2+. Indique a
influência da temperatura quando um dos eletrodos é mantido a 25oC e o outro é aquecido a 30oC,
depois a 37oC e finalmente a 67oC. Qual dos eletrodos sofrerá corrosão?
Lista de exercícios estequiometria
1 - A partir dos valores das massas atômicas, calcule as massas dos compostos representados a seguir:
Massas atômicas: Na=23 C=12 O=16 P=31 S=32 Al=27 K=39 Mn=55 Br=80 Ca=40 H=1
Cu=63,5.
a) Na2CO3
b) H3PO4
c) H2SO3
d) H2C2O4
e) H2S2O3
2 - Um composto Al2(XO4)3 apresenta massa molecular igual a 342 uma. Determine a massa atômica
do elemento X. R:32
3 - Na combustão do cicloexano (C6H12), qual a quantidade em mols de oxigênio (O2) consumida, para
um mol de cicloexano queimado, conforme a equação: (R = 9 mols)
C6H12 + O2 CO2 + H2O?
4 - Qual o volume, em m3, de gás oxigênio, nas CNTP, necessário para queimar totalmente 1200 kg de
carvão, com 90% de pureza, conforme a equação: R: 2016m3
C + O2 CO2
5 - A nave estelar Enterprise, de Jornada nas estrelas, usou B5H9 e O2 como mistura combustível. As
duas substâncias reagem de acordo com a seguinte equação: B5H9 + O2 B2O3 + H2O. Se um tanque
contém 126 kg de B5H9 e o outro 240 kg de O2, qual tanque esvaziará primeiro? Mostre com cálculos.
Quanta água terá sido formada (em kg) quando um dos reagentes tiver sido completamente
consumido? R:101,25 kg
6 - Um dos processos de obtenção de éter hospitalar (C4H10O) consiste na desidratação de álcool
etílico (C2H5OH), conforme a reação: C2H5OH C4H10O + H2O. Pede-se para determinar o
rendimento desse processo, se quando desidratamos 184g de álcool, obtêm-se 111g de éter. R:75%
7 - Um funileiro usa um maçarico de acetileno para soldar uma panela. O gás acetileno (C2H2) é obtido
na hora, através da seguinte reação química: CaC2 + H2O Ca(OH)2 + C2H2. Qual a massa
aproximada de carbureto de cálcio (CaC2) que será necessária para se obter 50 L de acetileno nas
CNTP? R:142,8
8 - Uma vela de parafina queima-se, no ar ambiente, para formar água e dióxido de carbono. A
parafina é composta por moléculas de vários tamanhos, mas utilizaremos para ela a fórmula C25H52.
Tal reação representa-se pela equação: C25H52 + O2 H2O + CO2. Responda:
a)Quantos mols de oxigênio são necessários para queimar um mol de parafina?
b)Quanto pesa esse oxigênio?
R: a) 38 b) 1216g
9 - Quantas moléculas de gás oxigênio reagem com 6 mols de monóxido de carbono, conforme a
equação: CO + O2 CO2 ?
R: 1,806x1024
10 - A combustão do metanol (CH3OH) pode ser representada pela equação não balanceada:
CH3OH + O2 CO2 + H2O. Quando se utilizam 5,0 mols de metanol nessa reação, quantos molsde
gás carbônico são produzidos?
R:5
11 - Qual é o número de átomos de cobre existente em 10-8 grama desse metal ? (R = 9,48x1013
átomos)
12 - A densidade da água a 25°C é 1.0 g/mL. Qual o número aproximado de átomos de hidrogênio
contidos em uma gota de água de volume igual a 0.05 mL? (3,34x1021 átomos de H)
13 - A tabela abaixo apresenta a massa molar de várias substâncias:
Substância
Au
HCl
O3
C5H12
H2 O
M (g.mol-1)
197
36,5
48,0
72,0
18,0
Comparando massas iguais dessas substâncias, qual é a que apresenta maior número de partículas ?
H2O
14 - A abundância de alguns metais na crosta terrestre é:
Metal
% em massa
Massa molar
(em g/mol)
ferro
4,7
55,8
cálcio
3,4
40,1
sódio
2,6
23,0
potássio
2,3
39,1
magnésio
1,9
24,3
Considerando apenas esses metais, podemos afirmar que existe na crosta terrestre maior número de
átomos de
a) ferro
b) cálcio
c) sódio
d) potássio
e) magnésio
15 - Muitas espécies de animais têm órgãos olfativos de notável sensibilidade. Por exemplo, certo tipo
de salmão é capaz de perceber a presença, na água, de 2-feniletanol (C6H5CH2CH2OH) em
concentração tão baixa quanto 3,66 g em 100 trilhões (1 x 1014) de litros de água. Qual o número de
moléculas de 2-feniletanol por litro de água ? (1,81x108 mol/L)
16 - Um frasco contém uma mistura de 16 g de O2 e 55 g de CO2. Qual é o número total de moléculas
dos dois gases no frasco ? (1,05x1024 moléculas)
17 - O ferro (massa atômica 56) é essencial à vida do homem porque está presente, na forma iônica, no
glóbulo vermelho do sangue e transporta oxigenio para os tecidos. No sangue de um adulto há 2,9 g de
ferro, que estão contidos em cerca de 2,6 x 1013 glóbulos vermelhos. Qual é o número de átomos de
ferro em cada glóbulo vermelho ? (1,2x109 átomos)
18 - Qual a quantidade de carbonato de cálcio que pode ser preparada a partir da mistura de 2 mols de
carbonato de sódio e 3 mols de cloreto de cálcio? (2 mols de CaCO3)
19 - Uma amostra de um minério de carbonato de cálcio pesando 2,0 g, ao ser tratada com ácido
clorídrico em excesso, produziu 1,5 x 10-2 mol de dióxido de carbono. Equacione a reação química
correspondente e calcule a porcentagem, em massa, de carbonato de cálcio. (75%)
20 - A hematita (Fe2O3) é um dos minerais de ferro de maior importância industrial. Em sua reação
com monóxido de carbono (CO), obtemos ferro metálico:
Fe2O3 + 3 CO → 2 Fe + 3 CO2
Se utilizarmos 1 kg de hematita com de pureza 80%, quanto obteremos de ferro? (559,4g)
21 - 0,5 mol de Ca3P2 reage com água, produzindo Ca(OH)2 e desprendendo PH3. Este último reage
completamente com oxigênio atmosférico, formando H3PO4. Quantos mols de água e quantos mols de
oxigênio são gastos? (são gastos 3 mols de água e 2 mols de oxigênio)
22 - Em 1990 foram consumidos, em nosso país, cerca de 164 bilhões (164 x 109) de cigarros. A massa
de um cigarro que é queimada corresponde a aproximadamente 0,85 g. Considerando que 40% da
massa do cigarro seja do elemento carbono, quantas toneladas de dióxido de carbono (CO2) os
fumantes lançaram na atmosfera em 1990, no Brasil ? C + O2 CO2
(2,05x1011 g de CO2 = 205000 toneladas)
23 - Segundo notícia publicada no jornal Correio Popular (Campinas) de 23/11/88, um caminhão
tanque tombou nas proximidades de Itanhaém, causando um vazamento de 20 toneladas (2 x 107 g) de
ácido sulfúrico concentrado (H2SO4). A equipe de atendimento de acidentes usou cal extinta
(Ca(OH)2) para neutralizar o ácido. Admitindo-se que o H2SO4 é 98%, calcule a massa mínima de
Ca(OH)2 necessária para a neutralização total do ácido derramado. (1,48x107 g)
24 - Polietileno pode ser obtido do etanol pela sequência de reações abaixo equacionadas:
C2H5OH → C2H4 + H2O
nC2H4 → (C2H4)n
Quantos milhares de litros de etanol são necessários para a produção de 5,6 ton de polietileno?
Suponha reações com 100% de rendimento. (densidade do etanol = 0,8 kg/L)(11,5x103L)
25 - A obtenção de etanol, a partir de sacarose (açúcar) por fermentação, pode ser representada pela
seguinte equação:
C12H22O11 + H2O → 4 C2H5OH + 4 CO2
Admitindo-se que o processo tenha rendimento de 100% e que o etanol seja anidro (puro), calcule a
massa (em kg) de açúcar necessária para produzir 50 litros de etanol, suficiente para encher o tanque
de um automóvel. (densidade do etanol = 0,8 g/cm3)
(74,3x103g ou 74,3 Kg)
26 - Certos solos, por razões várias, costumam apresentar uma acidez relativamente elevada. A
diminuição desta acidez pode ser feita pela adição ao solo de carbonato de cálcio, CaCO3, ou de
hidróxido de cálcio, Ca(OH)2, ocorrendo uma das reações abaixo representadas:
CaCO3 + 2 H+ → Ca2+ + CO2 + H2O
Ca(OH)2 + 2 H+ → Ca2+ + H2O
Um fazendeiro recebeu uma oferta de fornecimento de carbonato de cálcio ou de hidróxido de cálcio,
ambos a um mesmo preço por quilograma. Qual dos dois seria mais vantajoso, em termos de menor
custo, para adicionar à mesma extensão de terra? Justifique. Ca(OH)2
27 - Calcule a massa de enxofre de 96% de pureza necessária à obtenção de 490 kg de H2SO4 de 80%
em massa (pureza), pelo processo abaixo equacionado, sabendo-se que o rendimento do processo é
igual a 60%.
S + O2 → SO2
2 SO2 + O2 → 2 SO3
SO3 + H2O → H2SO4
(166Kg)
28 - Durante as batalhas navais da 2a. Guerra Mundial, produzia-se cortinas de fumaça ao se
pulverizar, no ar úmido, tetracloreto de titânio. A reação que ocorria pode ser descrita pela seguinte
equação não balanceada:
TiCl4 + H2O → TiO2 + HCl
A densa fumaça era causada pela formação de TiO2.
(a) Balanceie a equação química dada;
(b) Quantos mol de H2O são necessários para reagir com 6,50 mol de TiCl4 ? (13 mols de H2O)
(c) Quantos quilos de HCl são formados quando 100,0 kg de TiCl4 com 85% de pureza reagem ?
(65,4Kg)
(d) Quantos gramas de TiO2 são formados a partir de 14, 4 mol de TiCl4 ? (1,15x103 Kg)
29 - A concentração de íons fluoreto em uma água de uso doméstico é de 5,0.10-5 mol/L. Se uma
pessoa tomar 3,0 L dessa água por dia, ao fim de um dia qual a massa de fluoreto, em mg, que essa
pessoa ingeriu ? (2,85mg)
30 - Um aluno deseja preparar 1.500 mL de solução 1,4 M de ácido clorídrico diluindo uma solução
2,8 M do mesmo ácido.
a) Que volume da solução mais concentrada deve ser usado ? (750mL)
b) Que volume de água é necessário para esta diluição (750mL)
31 - Para evitar a propagação de doenças como a cólera, a água para beber é desinfetada pela adição de
cloro (Cl2) à razão mínima de 0,20 mg/kg de água. Para obter essa água clorada, quantas moléculas de
água são necessárias, aproximadamente, para cada molécula de cloro ? (1,96x107 moléculas)
32 - O eletrólito empregado em baterias de automóvel é uma solução aquosa de ácido sulfúrico. Uma
amostra de 7,50 mL da solução de uma bateria requer 40,0 mL de hidróxido de sódio 0,75 M para sua
neutralização completa. Calcule a concentração molar do ácido na solução da bateria. (2mol/L)
33
- A hidrazina, N2H4, e o peróxido de hidrogênio, H2O2, são usados como propelentes de
foguetes. Na reação entre ambos são formados ácido nítrico, HNO3, e água, H2O.
a. Quantos mols de HNO3 serão formados a partir de 0,025 mol de N2H4 ? (0,05 mol)
b. Quantos mols de H2O2 serão requeridos para reagir com 220 g de N2H4 ? (48,2 mol)
c. Quantos gramas de H2O2 serão necessários para produzir 45,8 g de HNO3 ? (86,5 mol)
34 - Em um frasco de aço de 1 litro, são colocados 12,25 gramas de clorato de potássio. O frasco é
fechado e é feito vácuo no interior do mesmo. A seguir, o frasco é aquecido até provocar a
decomposição completa do sal. O frasco é, então, resfriado até 300K. Qual a pressão no interior do
frasco, nesta temperatura, desprezando-se o volume ocupado pelo produto sólido da reação? Qual a
massa de KCl(s) produzida?
KClO3(s) → KCl(s) + 3½O2(g)
Dados: Massas atômicas: K=39; Cl=35,5 e O=16.
35 – Um carvão apresenta a seguinte composição elementar: 79%C; 5,1%H, 3,6%O, 1,5%S, 1,3%N e
9,4% de cinzas. Este carvão é queimado completamente com ar em excesso de 50%. Calcule:
a)
b)
c)
d)
O peso de ar prático: Resposta: 16,278Kg/Kg de carvão
O volume de ar prático: Resposta 12,481m3 ar CNTP/Kg carvão
O peso dos gases úmidos de combustão: Resposta 17,184 Kg de fumos/Kg de carvão
O volume dos gases úmidos de combustão, nas CNTP: Resposta 12,8026m3/Kg
36 – Metanol (CH4O) é queimado completamento com ar em excesso de 10%. Calcule:
a)
b)
c)
d)
O peso de ar prático: Resposta 7,174 Kg de ar/Kg de metanol
O volume de ar prático: Resposta 5,5m3 de ar nas CNTP/Kg de metanol
O peso de gases úmidos de combustão: Resposta: 8,174Kg de fumos/Kg de metanol
O volume dos gases úmidos de combustão a 300K e 0,9atm: Resposta 8m3/Kg de metanol
37 – Uma gasolina é composta por 20% de etanol (C2H6O) e o restante considere como tendo fórmula
C8H18. Faz-se a combustão completa da mesma com oxigênio puro em excesso de 10%. Calcule:
a) O peso de oxigênio prático: Resposta: 3,5464Kg de O2/Kg de gasolina
b) O volume de oxigênio prático: Resposta: 2,486m3 de O2 nas CNTP/Kg de gasolina
c) O volume dos gases de combustão a 300K e 1 atm. Resposta: 3,7183m3/Kg de gasolina
d) O peso dos gases úmidos de combustão: Resposta: 4,5474Kg de fumos/Kg de gasolina
38 – Uma mistura gasosa é composta por, em % volumétrica: 20% CH4, 10%C2H6, 10% N2, 15%CO,
30%H2, 15% CO2. Este gás é queimado completamente com ar em excesso de 20%. Calcule:
a) O volume de ar prático: Resposta: 5,571 m3 de ar/m3 de gás
b) O volume dos gases úmidos de combustão: Resposta: 6,3963m3 de fumos/m3 de gás
39 – Faz-se a combustão completa de um gás com a seguinte composição volumétrica: 75% CH4,
10%C2H6, 10%C3H8 e 5%H2, com ar em excesso de 10%. Calcule:
a) O volume de ar prático: Resposta: 12,44m3/m3 de gás
b) O volume dos gases úmidos de combustão. Resposta: 13,565 m3/m3 de gás
40 – Um gás pobre de carvão betuminoso é queimado com ar em excesso de 20%. A composição do
gás pobre é: 3%CH4, 14%H2, 27% CO, 4,5% CO2, 50,9%N2 e 0,6% de O2. Calcule:
a) A relação ar/combustível em m3 de ar/m3 de gás pobre. Resposta: 1,476m3/m3 de gás pobre.
b) O volume dos gases úmidos de combustão. Resposta: 2,275 m3/m3 de gás pobre.