Química Solucionada
9.9999.0111 / 9.8750.0050 / 9.9400. / 9.8126.0630
Título: Pilhas comerciais
Data:
/
/ 2016
QS.2
nos equipamentos eletrônicos atuais, possui as
seguintes semi-reações:
–
–
Cd(OH)2(s) + 2e Cd(s) + 2OH (aq)
Eº = –0,81 V
–
–
Ni(OH)3(s) + e Ni(OH)2(s) + OH (aq) Eº = ?
Sabendo-se que a força eletromotriz (FEM) da reação
global é igual a + 1,30 V, é correto afirmar que o valor
do potencial padrão (Eº) da semi-célula de Níquel é:
a) + 0,81 V
b) –2, 60V
c) + 1,30 V
d) –0,49 V
e) + 0,49 V
EXERCÍCIOS DE FIXAÇÃO
01 - (UEPG PR)
As baterias de chumbo utilizadas nos automóveis
fornecem corrente elétrica a partir da reação
representada abaixo.
+
Pb(s) + PbO2(s) + 4H (aq) + 2 SO 24 (aq) 2 PbSO4(s) + 2 H2O(l)
Nesse contexto, assinale o que for correto.
01. No óxido de chumbo presente na reação, o Pb tem
nox igual a –2.
02. Para cada mol de Pb(s) oxidado são necessários 2
elétrons.
04. Cada mol de ácido sulfúrico presente na bateria
+
fornece 2 mols de íons H reagente.
08. A reação do chumbo em meio ácido só ocorre
devido à hidrólise da água.
16. O nox do Pb varia de zero no Pb (s) para + 2 no
PbSO4 (s).
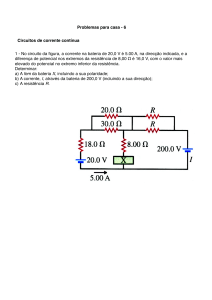
02 - (UFSC)
Uma pilha a combustível é um dispositivo eletroquímico
no qual a reação de um combustível com oxigênio
produz energia elétrica. Esse tipo de pilha tem por base
as semi-reações apresentadas na tabela abaixo:
A figura a seguir mostra o esquema de uma pilha a
combustível.
02 - (UDESC SC)
As baterias classificadas como células secundárias são
aquelas em que a reação química é reversível,
possibilitando a recarga da bateria. Até pouco tempo
atrás, a célula secundária mais comum foi a bateria de
chumbo/ácido, que ainda é empregada em carros e
outros veículos. As semirreações padrões que ocorrem
nesta bateria são descritas abaixo:
–
2–
I. PbSO4(s) + 2e Pb(s) + SO4 (aq) Eº = –0,36 V
+
2–
–
II. PbO2(s) + 4H (aq) + SO4 (aq) + 2e PbSO4(s) +
2H2O() Eº = +1,69 V
Considerando a reação de célula espontânea, assinale
a alternativa que apresenta a direção da semirreação I e
seu eletrodo; a direção da semirreação II e seu eletrodo;
e o potencial-padrão da bateria, respectivamente.
a) direção direta no ânodo; direção inversa no cátodo;
+1,33 V
b) direção inversa no ânodo; direção direta no cátodo;
+2,05V
c) direção inversa no cátodo; direção direta no ânodo;
+2,05 V
d) direção direta no ânodo; direção inversa no cátodo;
+2,05 V
e) direção inversa no ânodo; direção direta no cátodo;
+1,33V
03 - (Unimontes MG)
A bateria de óxido de prata é um dispositivo usado,
atualmente, em relógios de pulso e calculadoras. Ela tem
a vantagem de gerar uma voltagem relativamente alta,
em torno de 1,5 V. A reação geral que ocorre na célula é
De acordo com as informações do enunciado e da figura
acima, assinale a(s) proposição(ões) CORRETA(S).
01. O gás hidrogênio atua na pilha como agente
oxidante.
02. A diferença de potencial elétrico padrão da pilha é +
1,23 V.
04. O oxigênio sofre redução.
08. A obtenção de energia elétrica neste dispositivo é
um processo espontâneo.
16. A equação global da pilha no estado padrão é 2 H2
(g) + O2 (g) 2 H2O(l).
32. A diferença de potencial elétrico padrão da pilha é +
0,43 V.
GABARITO:
1) Gab: 20; 2) Gab: 30
04 - (UFG GO)
A bateria recarregável mais comum, utilizada atualmente
em automóveis, é a bateria de chumbo. Esta bateria
pode ser representada pelas seguintes semireações de
redução:
1
2
Trabalhando em casa
01 - (UEPA)
A bateria de Níquel–Cádmio, a qual é muito utilizada
www.quimicasolucionada.com.br
dada pela equação: Zn(s) + Ag2O(s) + H2O(l)
Zn(OH)2(s) + 2 Ag(s)
De acordo com a equação dada, sobre o anodo da pilha,
é INCORRETO afirmar que
a) o hidróxido de zinco é formado no anodo.
b) o eletrodo é constituído de zinco metálico.
c) a prata metálica é depositada nesse eletrodo.
d) os elétrons são transferidos para o óxido de prata.
–
PbSO4(s) + 1e
SO 24
1
2
Pb(s) +
1
2
SO 24 (aq)
E = –0,356 V
–
(aq) + 4H + 2e PbSO4(s) + 2H2O E =
+1,689 V
Considerando o exposto, para se gerar um potencial de
aproximadamente 12 V, deve-se utilizar
a) 5 células galvânicas ligadas de forma mista.
PbO2(s) +
+
[email protected] 1
Química Solucionada
b) 6 células galvânicas ligadas em paralelo.
c) 6 células galvânicas ligadas em série.
d) 9 células galvânicas ligadas em paralelo.
e) 9 células galvânicas ligadas em série.
05 - (ENEM)
Iniciativas do poder público para prevenir o uso de
bebidas alcoólicas por motoristas, causa de muitos
acidentes nas estradas do país, trouxeram à ordem do
dia, não sem suscitar polêmica, o instrumento
popularmente conhecido como bafômetro. Do ponto de
vista de detecção e medição, os instrumentos
normalmente usados pelas polícias rodoviárias do Brasil
e de outros países utilizam o ar que os “suspeitos”
sopram para dentro do aparelho, através de um tubo
descartável, para promover a oxidação do etanol a
etanal. O método baseia-se no princípio da pilha de
combustível: o etanol é oxidado em meio ácido sobre
um disco plástico poroso coberto com pó de platina
(catalisador) e umedecido com ácido sulfúrico, sendo
um eletrodo conectado a cada lado desse disco poroso.
A corrente elétrica produzida, proporcional à
concentração de álcool no ar expirado dos pulmões da
pessoa testada, é lida numa escala que é proporcional
ao teor de álcool no sangue. O esquema de
funcionamento desse detector de etanol pode ser visto
na figura.
As reações eletroquímicas envolvidas no processo são:
Eletrodo A:
+
–
CH3CH2OH (g) CH3CHO (g) + 2 H (aq) + 2 e
Eletrodo B:
+
–
½ O2 (g) + 2 H (aq) + 2 e H2O (l)
No estudo das pilhas, empregam-se códigos e
nomenclaturas próprias da Química, visando
caracterizar os materiais, as reações e os processos
envolvidos. Nesse contexto, a pilha que compõe o
bafômetro apresenta o
a) eletrodo A como cátodo.
b) etanol como agente oxidante.
c) eletrodo B como polo positivo.
d) gás oxigênio como agente redutor.
e) fluxo de elétrons do eletrodo B para o eletrodo A.
06 - (UFT TO)
Uma célula a combustível é um tipo de pilha que gera
energia elétrica a partir da reação química entre os
gases hidrogênio e oxigênio, como exemplificadas nas
reações redox a seguir.
–
0
Ânodo: 2H2(g) + 4OH (aq) 4H2O(l) + 4e E = 0,83 V
–
–
0
Cátodo: O2(g) + 2H2O(l) + 4e 4OH (aq) E = 0,40 V
Qual a força eletromotriz da célula de combustível
apresentada?
a) 2,46 V.
b) 0,43 V.
c) –0,43 V.
d) 1,23 V.
e) –0,83 V.
07 - (UERN)
A figura representa o esquema de uma célula a
combustível hidrogênio/oxigênio.
Considerando o esquema abaixo, marque o
INCORRETO.
www.quimicasolucionada.com.br
9.9999.0111 / 9.8750.0050 / 9.9400. / 9.8126.0630
a)
b)
c)
d)
O hidrogênio é oxidado.
Há uma transformação de energia química em
energia elétrica.
Os prótons formados no anodo são transportados
para o catodo.
A reação que ocorre no eletrodo que reduz é: H2O
+
–
½ O2 + 2H + 2e .
08 - (UDESC SC)
Um dos mais promissores sistemas de células de
combustível envolve a reação entre o gás hidrogênio e o
gás oxigênio para formar água como único produto.
Estas pilhas geram eletricidade duas vezes mais
eficientes que o melhor motor de combustão interna. As
semirreações envolvidas na célula de combustível de
hidrogênio e os seus respectivos potenciais padrões de
redução são:
–
–
(I) 4e + O2(g) + 2H2O(l) 4OH (aq)
Eº = +0,40
V
–
–
(II) 4H2 O(l) + 4e 2H2(g) + 4OH (aq) Eº = –0,83 V
Assinale a alternativa correta em relação as
semirreações (I) e (II).
a) A força eletromotriz da célula é de -1,23V; a
semirreação (I) ocorre no ânodo e a semirreação
(II) ocorre no cátodo.
b) A força eletromotriz da célula é de -0,43 V; a
semirreação (I) ocorre no cátodo e a semirreação
(II) ocorre no ânodo.
c) A força eletromotriz da célula é de +1,23 V; a
semirreação (I) ocorre no cátodo e a semirreação
(II) ocorre no ânodo.
d) A força eletromotriz da célula é de +1,23 V; a
semirreação (I) ocorre no ânodo e a semirreação
(II) ocorre no cátodo.
e) A força eletromotriz da célula é de -0,43 V; a
semirreação (I) ocorre no ânodo e a semirreação
(II) ocorre no cátodo.
09 - (UFAL)
Uma bateria de carro é, basicamente, constituída de
placas de chumbo metálico e placas de chumbo
recobertas com óxido de chumbo (IV) em uma solução
de H2SO4. A reação global de descarga dessa bateria
+
pode ser representada por: PbO2(s) + Pb(s) + 2 H
−
(aq) + 2 HSO4 (aq) 2 PbSO4(s) + 2 H2O(l)
A partir da análise dessa equação, é correto afirmar que:
a) o pH da solução de uma bateria que está
descarregando diminui.
b) o íon chumbo no PbO2 sofre oxidação e, portanto, é
o ânodo.
c) o chumbo metálico é o agente oxidante.
d) 1 mol de Pb(s) libera 2 mol de elétrons.
e) há transferência de elétrons do PbO2(s) para o
Pb(s).
GABARITO:
1) Gab: E; 2) Gab: B; 3) Gab: C; 4) Gab: C; 5) Gab: C; 6) Gab: D
7) Gab: D; 8) Gab: C; 9) Gab: D.
[email protected] 2