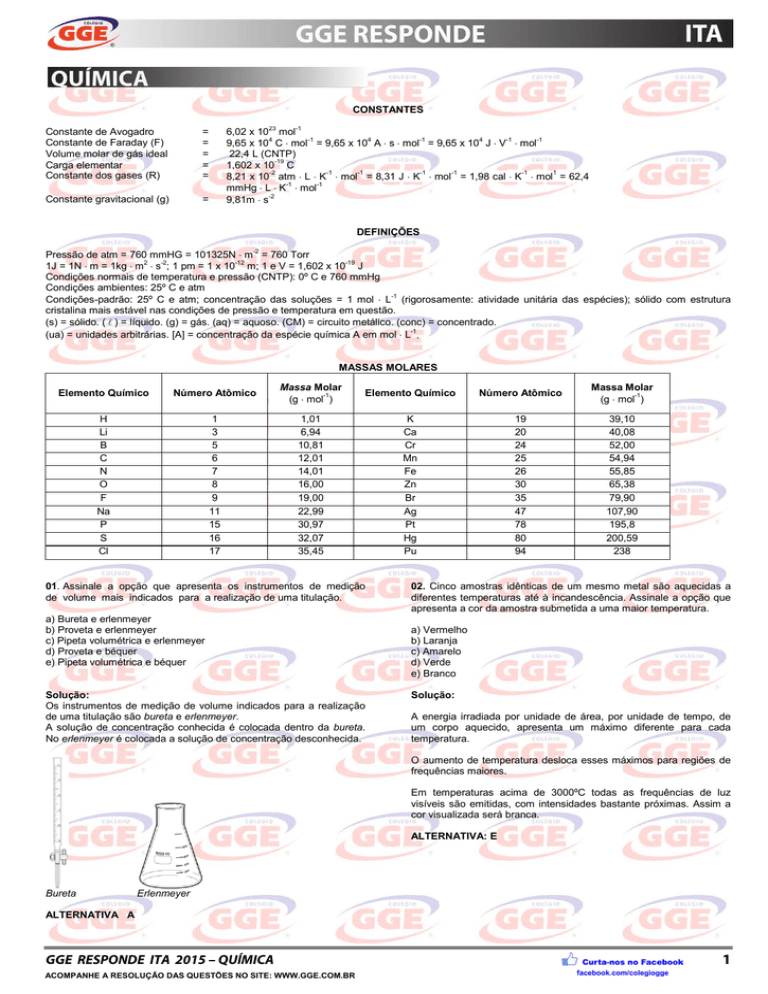
CONSTANTES
Constante de Avogadro
Constante de Faraday (F)
Volume molar de gás ideal
Carga elementar
Constante dos gases (R)
=
=
=
=
=
Constante gravitacional (g)
=
6,02 x 1023 mol-1
9,65 x 104 C ⋅ mol-1 = 9,65 x 104 A ⋅ s ⋅ mol-1 = 9,65 x 104 J ⋅ V-1 ⋅ mol-1
22,4 L (CNTP)
1,602 x 10-19 C
8,21 x 10-2 atm ⋅ L ⋅ K-1 ⋅ mol-1 = 8,31 J ⋅ K-1 ⋅ mol-1 = 1,98 cal ⋅ K-1 ⋅ mol1 = 62,4
mmHg ⋅ L ⋅ K-1 ⋅ mol-1
9,81m ⋅ s-2
DEFINIÇÕES
Pressão de atm = 760 mmHG = 101325N ⋅ m-2 = 760 Torr
1J = 1N ⋅ m = 1kg ⋅ m2 ⋅ s-2; 1 pm = 1 x 10-12 m; 1 e V = 1,602 x 10-19 J
Condições normais de temperatura e pressão (CNTP): 0º C e 760 mmHg
Condições ambientes: 25º C e atm
Condições-padrão: 25º C e atm; concentração das soluções = 1 mol ⋅ L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura
cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. ( ) = líquido. (g) = gás. (aq) = aquoso. (CM) = circuito metálico. (conc) = concentrado.
(ua) = unidades arbitrárias. [A] = concentração da espécie química A em mol ⋅ L-1.
MASSAS MOLARES
Elemento Químico
Número Atômico
Massa Molar
(g ⋅ mol-1)
Elemento Químico
Número Atômico
Massa Molar
(g ⋅ mol-1)
H
Li
B
C
N
O
F
Na
P
S
Cl
1
3
5
6
7
8
9
11
15
16
17
1,01
6,94
10,81
12,01
14,01
16,00
19,00
22,99
30,97
32,07
35,45
K
Ca
Cr
Mn
Fe
Zn
Br
Ag
Pt
Hg
Pu
19
20
24
25
26
30
35
47
78
80
94
39,10
40,08
52,00
54,94
55,85
65,38
79,90
107,90
195,8
200,59
238
01. Assinale a opção que apresenta os instrumentos de medição
de volume mais indicados para a realização de uma titulação.
a) Bureta e erlenmeyer
b) Proveta e erlenmeyer
c) Pipeta volumétrica e erlenmeyer
d) Proveta e béquer
e) Pipeta volumétrica e béquer
Solução:
Os instrumentos de medição de volume indicados para a realização
de uma titulação são bureta e erlenmeyer.
A solução de concentração conhecida é colocada dentro da bureta.
No erlenmeyer é colocada a solução de concentração desconhecida.
02. Cinco amostras idênticas de um mesmo metal são aquecidas a
diferentes temperaturas até à incandescência. Assinale a opção que
apresenta a cor da amostra submetida a uma maior temperatura.
a) Vermelho
b) Laranja
c) Amarelo
d) Verde
e) Branco
Solução:
A energia irradiada por unidade de área, por unidade de tempo, de
um corpo aquecido, apresenta um máximo diferente para cada
temperatura.
O aumento de temperatura desloca esses máximos para regiões de
frequências maiores.
Em temperaturas acima de 3000ºC todas as frequências de luz
visíveis são emitidas, com intensidades bastante próximas. Assim a
cor visualizada será branca.
ALTERNATIVA: E
Bureta
Erlenmeyer
ALTERNATIVA A
GGE RESPONDE ITA 2015 – QUÍMICA
1
ACOMPANHE A RESOLUÇÃO DAS QUESTÕES NO SITE: WWW.GGE.COM.BR
1
03. O elemento Plutônio-238 é utilizado para a geração de
eletricidade em sondas espaciais.
Fundamenta-se essa utilização porque esse isótopo tem
a) longo tempo de meia-vida e é emissor de partículas beta.
b) longo tempo de meia-vida e é emissor de partículas gama.
c) longo tempo de meia-vida e é emissor de partículas alfa.
d) longo tempo de meia-vida e é emissor de partículas delta.
e) tempo de meia-vida curto e é emissor de partículas alfa.
Solução:
II. V. 2°ordem:
1
−
1
[X] [X]0
= Kt
→
1
=
1
[X] [X]0
+ Kt
III. V. v=k[x] (1° ordem)
IV. V. v=k[x]2 (2° ordem)
ALTERNATIVA: E
06. Considere as seguintes comparações entre as respectivas
temperaturas de fusão dos polímeros
representados pelas suas unidades repetitivas:
O isótopo 238 Pu sofre decaimento por emissão de partículas α
segundo a reação:
238
→ 234
Pu
U + 24 α
92
94
t1/ 2 = 87,7 anos
Sua utilização em geradores termoelétricos de radioisótopos é
indicada por ter tempo de meia-vida longo e não liberar radiações
mais penetrantes ( β , γ ).
ALTERNATIVA: C
04. Sendo o pK do NH4 OH igual a4,74, o pH de uma solução
aquosa0,10mol L−1 em NH4 C é
a) 1,00.
b) 3,74.
c) 4,74.
d) 5,13.
e) 8,87.
Solução:
Nesse caso, ocorre hidrólise do íon NH+4
NH+4 + H2 O ↔ NH3 + H3 OH + K h =
Kw
10 −14
⇒ K h = − 4,74 = 10 − 9,26
Kb
10
Como a hidrólise é muito fraca, podemos dizer que:
[NH3 ] = [H3 O + ]
e
[NH+4 ] ≅ 0,1 M
Solução:
I. O anel Benzênico do segundo polímero fez com que o monômero
do segundo polímero ocupe mais espaço que o monômero do
primeiro de forma a haver mais interações no primeiro, além de
facilitar o emaranhado do primeiro – verdadeiro
II. O segundo monômero possui dipolo permanente, enquanto que o
primeiro é apolar, de forma ao segundo possuir interações mais
[NH3 ][fortes.
H3 O + ] Falso− 9,26
⇒ Kh =
= 10
III.
[NH+4 ] Similar ao item I, o segundo polímero apresenta maior facilidade
de empacotamento. Falso
IV. O primeiro polímero tem ponto de fusão maior, pois possui cadeia
carbônica maior que o segundo. Isso permite que a interação entre
as suas moléculas seja mais intensa.
[H3 O + ] 2
= 10 − 9,26 ⇒ [H3 O + ] = 10 −10,26 ⇒ [H3 O + ] = 10M− 5,13
0,1
[
Assinale a opção que apresenta a(s) comparação(ões) ERRADA(S).
A ( ) Apenas I
B ( ) Apenas I e IV
C ( ) Apenas I!e III
D ( ) Apenas III e IV
E ( ) Apenas IV
]
pH = −l log H3 O + = 5,13
ALTERNATIVA: D
05. Considere uma reação química hipotética representada pela
equação X → Produtos. São feitas as seguintes proposições
relativas a essa reação:
ALTERNATIVA: C
07. Considere a reação química hipotética realizada em sistema
fechado a pressão e temperatura constantes representada pela
equação X + Y W + Z. Supondo que no início da reação haja
apenas os reagentes X e Y, e considerando um intervalo de tempo
que se estende de t = O até um instante t após o equilíbrio ter sido
atingido, assinale a opção que apresenta a variação da energia livre
de Gibbs.
I. Se o gráfico de [X] em função do tempo for uma curva linear, a lei
de velocidade da reação dependerá somente da constante de
velocidade.
1
II. Se o gráfico de
em função do tempo for uma curva linear, a
[X]
ordem de reação será 2.
III. Se o gráfico da velocidade da reação em função de [X] for uma
curva linear, a ordem de reação será 1.
IV. Se o gráfico da velocidade de reação em função de [X]2 for uma
curva linear, a ordem de reação será 2.
Das proposições acima, está(ão) CORRETA(S)
A ( ) apenas I
B ( ) apenas I e II.
C ( ) apenas I, llI e IV.
D ( ) apenas lll.
E ( ) todas.
Solução:
I. V. reação de ordem zero: v = K
GGE RESPONDE ITA 2015 – QUÍMICA
2
ACOMPANHE A RESOLUÇÃO DAS QUESTÕES NO SITE: WWW.GGE.COM.BR
Solução:
Toda reação espontânea ocorre por diminuição da energia livre até
alcançar o equilíbrio onde o mínimo de G é alcançado.
2
tendo sido vaporizados 2,0 g de MX4( ). Sabendo que a massa
molar desse composto é 200 gmorl-1 assinale a opção que apresenta
a entalpia molar de vaporização em kJmorl-1 ,a 80 °C.
ALTERNATIVA: E
08. Borbulha-se gás cloro em solução aquosa diluída de hidróxido
de sódio a 25 °C. Assinale a opção que contém apenas produtos
clorados resultantes.
a) Cl − ,ClO3−
−
−
b)
OCl ,Cl
d) ClO3− , OCl −
e) ClO4− ,ClO3−
Solução:
O gás cloro sofre hidrólise segundo a reação:
4,1
8,1
81
405
810
Solução:
P= V.i = 30 x 0,9 = 27w
E = P ⋅ ∆t = 27 J x 30s = 810J
s
c) ClO3− , ClO4− , Cl −
Cl2(g) + H 2O()
A()
B()
C()
D()
E()
HCl(aq) + HOCl(aq)
A presença do hidróxido de sódio desloca o equilíbrio para a direita, e
a reação ocorre até o fim.
A solução resultante irá conter os sais dos ácidos hipocloroso e
clorídrico::
HCl(aq) + HOCl(aq) + 2NaOH (aq) → NaCl(aq) + NaOCl(aq) + 2H2O()
ALTERNATIVA: B
09. O grau de dissociação, α, do ácido acético em solução aquosa
0,10molL-1 é 100 vezes menor que o do ácido clorídrico também em
solução aquosa 0,10molL-1 . Com base nestas informações, pode-se
afirmar que o PH da solução aquosa do ácido acético 0,10molL-1 é
Foram vaporizadas 2g:
2g
n=
= 0,01 mol
200g / mol
810J
Q VAP =
= 81 KJ / mol
0,01mol
ALTERNATIVA: C
11. Os óxidos de metais de transição podem ter caráter ácido, básico
ou anfótero. Assinale a opção que apresenta o caráter dos seguintes
óxidos: CrO, Cr2O3 e CrO3•
a) Ácido, anfótero, básico
b) Ácido, básico, anfótero
c) Anfótero, ácido, básico
d) Básico, ácido, anfótero
e) Básico, anfótero, ácido
Solução:
O caráter ácido-base dos óxidos de metais de transição pode ser
associado ao número de oxidação (Nox) do metal.
Números de oxidação +1 e +2 estão associados a óxidos básicos; +3
e +4 a óxidos anfóteros e a partir de +5 a óxidos ácidos.
a) Zero
b) Um
c) Dois
d) Três
e) Quatro
Assim,
Cr+2O
Básico
Cr2+3O3
Anfótero
Cr+6O3
Ácido
Solução:
ALTERNATIVA: E
αHCl
αCH3 00H =
100
12. Considere as seguintes reações químicas e respectivas
constantes de equilíbrio.
Como HCl é um ácido muito forte, temos que αCl=100%
100
Logo, αCH3C00H=
=1% ou 0,01
100
Temos a dissociação do CH3C00H:
CH3 C00H → CH3 C00 −
0,1
0
0,1(1 − α )
0,1.α
H+
0 → início
0,1.α → Fim
PH= -log [H+]= -log[0,1.0,01]=3
ALTERNATIVA: D
N2 (g
2NO
NO 2
10. Para determinar a entalpia de vaporização do composto
hipotético MX4 ( ), o mesmo foi colocado num recipiente equipado
com uma serpentina de aquecimento resistivo, a 80 °C e sob pressão
de 1,0 bar. Para a manutenção da temperatura, foi utilizada uma
fonte de 30 V com passagem de corrente de 900 mA durante 30s,
GGE RESPONDE ITA 2015 – QUÍMICA
3
ACOMPANHE A RESOLUÇÃO DAS QUESTÕES NO SITE: WWW.GGE.COM.BR
Então, K 3 é igual a
a)
1
.
K1K 2
b)
1
.
2K1K 2
c)
1
.
4K1K 2
3
1
d)
K1K 2
1
2
2
1
.
e)
K1K 2
.
E = E° −
0,64 = 0,76 −
Solução:
2NO( g) + O2( g)
NO2( g)
(PNO )2
PN2 ⋅ PO2
K2 =
K3 =
2NO( g)
K1
2NO2( g)
1
N2( g) + O2( g)
2
K2
( )2 =
⇒ PN2
1
)
(
2
0,64 = 0,76 −
K3
PNO
(PO2 ) ⋅ ( )
(PNO2 )2 ⇒ (P
1
2
(PN2 )
O2
[ ]
log H(+aq)
1
)2
=
PNO2
1
PNO ⋅ (K 2 ) 2
PNO2
(PO2 )2 ⋅ (K1)2 ⋅ PNO2
1
1
=
( )2
PNO ⋅ PO2
PNO ⋅ PO2
1
1
(K1)2 ⋅ PNO2
1
1
PNO ⋅ (K1 ) 2 (K 2 ) 2 ⋅ PNO 2
=
1
1
=
K1 ⋅ K 2 K1 ⋅ K 2
−2
[ ]
[ ]
0,0592
⋅ ( −2) ⋅ log H(+aq)
2
− 0,12
=
≅ −2 ∴ H(+aq) = 10 − 2 M
0,0592
14. Uma mistura de metanol e água a 25 °C apresenta o volume
parcial molar de água igual a 17,8cm3 mol-1 e o volume parcial molar
do metanol igual a 38,4cm3 mol-1 · Com base nestas informações e
sendo a massa específica do metanol de O,791 g cm-3 e a da água
igual a 1,000 g cm-3, assinale a opção CORRETA do volume total
(em cm3) quando se adicionam 15cm3 de metanol em 250cm3 de
água nessa temperatura.
a) 250
b) 255
c) 262
d) 270
e) 280
⋅ PO2
PNO ⋅ PO2
[ ]
0,0592
⋅ log H(+aq)
2
ALTERNATIVA: D
De (2):
K3 =
[ ]
( 2)
De (1):
K3 =
[ ]
0,0592
(1 ) ⋅ ( 1 )
⋅ log
2
2
H+
− 0,12 = −
(1)
1
K1 2
PNO2
⇒ PO2 =
PO2 (PNO )
(PNO )2 ⋅ K 2
1
2
]
( aq)
N2( g) + O2( g)
K1 =
[
+
Zn(2aq
) ⋅ PH2( g )
0,0592
0,0592
⋅ log Q ∴ E = E° −
⋅ log
2
n
n
H(+aq )
1
2
Solução:
Componentes puros:
VMETANOL = 15cm3 ⇒ mMETANOL = 15 x0,791 = 11,865g
VÁGUA = 250cm3 ⇒ m ÁGUA = 250g
ALTERNATIVA D
13. . É de 0,76 V a força eletromotriz padrão, E°, de uma célula
eletroquímica, conforme a reação
Zn(s) + 2H+(aq) → Zn2+(aq) + H2(g).
Na concentração da espécie de Zn2+ igual a 1,0 molL-1 e pressão de
H2 de 1,0 bar, a 25 °C, foi verificado que a força eletromotriz da
célula eletroquímica é de 0,64 V. Nestas condições, assinale a
concentração de íons H+ em molL-1.
A ( ) 1,0 x 10-12
B ( ) 4, 2 x 10-4
-2
1, 0 x 10
E ( ) 2, 0 x 10-2
C ( ) 1,0 x 10-4
D( )
Solução:
+
Zn(s ) + 2H(+aq) → Zn(2aq
) + H2( g) ; E° = 0,76 V
O quociente de reação para a reação acima é:
Q=
[Zn ]⋅ P
[H ]
2+
( aq)
Podemos então calcular o número de mols para determinar o volume
parcial de cada componente na mistura:
11,865g
= 0,37 mol ⇒ VPARCIAL 1 = 14,208cm3
nMETANOL =
32g / mol
n ÁGUA = 13,88 mols ⇒ VPARCIAL 2 = 247,06cm3
VTOTAL = 261,3cm3
ALTERNATIVA C
15. Para uma molécula diatômica,a energia potencial em função da
distância internuclear é representada pela figura ao lado. As linhas
horizontais representam os níveis de energia vibracional
quanticamnetepermitidos para uma molécula diatômica.Uma amostra
contendo um mol de moléculas diatômicas idênticas, na forma de um
sólido cristalino, pode ser modelada como um conjunto de
osciladores para os quais a energia potencial também pode ser
representada qualitativamente pela figura. Em relação a este sólido
cristalino, são feitas as seguintes proposições:
H 2( g )
2
+
( aq)
De acordo com a equação de NERNST:
I. à temperatura de 0 K, a maioria dos osciladores estará no estado
vibracional fundamental, cujo número quântico vibracional, n, é igual
a zero.
II. à temperatura de 0 K, todos os osciladores estarão no estado
vibracional fundamental, cujo número quântico vibracional, n, é igual
a zero.
III. O movimento vibracional cessa a 0 K.
IV. O movimento vibracional não cessa a 0 K.
V. O principio de incerteza de Heisenberg será violado se o
movimento vibracional cessar.
Das afirmações acima, está(ão) CORRETA(S) apenas
a) apenas I e III.
b) apenas II e III.
GGE RESPONDE ITA 2015 – QUÍMICA
4
ACOMPANHE A RESOLUÇÃO DAS QUESTÕES NO SITE: WWW.GGE.COM.BR
4
c) apenas I, IV e V..
d) apenas II, IV e V.
e) apenas II, III e V.
II. A capacidade calorífica do bromo é menor que a do tetracloreto de
carbono.
III. A capacidade calorífica do metanol é menor que a do mercúrio.
Solução:
Assinale a opção
CORRETA(S):
I.
II.
III.
IV.
V.
(falso) À temperatura de 0K todos os osciladores estarão no
estado fundamental, que corresponde ao n igual à zero.
(verdade) Mesmo motivo do item I.
(falso) a energia do oscilador harmônico é da forma
1
E n = n + hf , logo no estado fundamental (n = 0), há energia
2
residual que implica existência de vibração.
(verdade) Ver o item III.
(verdade) Pois se o movimento cessar a incerteza do movimento
linear seria nula (∆p = 0) e a incerteza da posição seria nula (∆x =
0), e isso iria violar tal princípio.
ALTERNATIVA
que
representa
a(s)
comparação(ões)
a) apenas I
b) apenas I e II
c) apenas II
d) apenas II e III
e) apenas III
Solução:
I. (verdadeiro) O peróxido de hidrogênio (H2O2) possui mais ligações
em sua estrutura, logo menor grau de liberdade e,
consequentemente, maior capacidade calorífica.
II. (verdadeiro) O tetracloreto tem maior quantidade de ligações, logo,
maior número de arranjos. Assim, maior capacidade calorífica.
D
16. Dois béqueres, denominados ”X”e “Y”, encontram-se dentro de
um recipiente hermeticamente fechado, à pressão de 1 bar e
temperatura de 298 K.o béquer ”X” contém 100 mL de uma solução
III. (falso) Em geral, os metais apresentam uma capacidade calorífica
elevada.
aquosa de cloreto de sódio cuja concentração é 0,3 mol L−1 . O béquer
“Y” contém 100mL de uma solução aquosa de cloreto de sódio cuja
ALTERNATIVA B
−1
concentração é 0,1mol L . Se o recipiente for mantido fechado e em
repouso até alcançar o equilíbrio termodinâmico, assinale o volume
final (em mL) da solução no béquer “Y”.
a) 25
d) 150
b) 50
e) 200
19. A figura mostra a variação da massa específica de uma
substância pura com a temperatura à pressão 1 bar.
Então, é CORRETO afirmar que Tx pode representar a temperatura
de
c) 100
Solução:
X
Y
X → v = 100mL = 0,1L
MNaC( x ) = 0,3mol / L
Y → v = 100mL = 0,1L
MNaC( y ) = 0,1mol / L
nNaC( x ) = 0,03mol
nNaC( y ) = 0,1mol
Após o equilíbrio termodinâmico, teremos:
MNaC( x ) = m Nac( y )
nNaC( x )
v f(x)
=
nNaC( y )
v f(y)
0,03
0,01
3
1
=
∴
=
(0,1 + x ) (0,1 − x ) (0,1 + x ) (0,1 − x )
0,2
∴ x = 0,05L
0,3 − 3 x = 0,1 + x ∴ 0,2 = 4 x ∴ x =
4
x = 50mL
Logo : v f ( y ) = 100 − 50 ∴ v f ( y ) = 50mL
ALTERNATIVA: B
17. São feitas as seguintes comparações cobre as capacidades
caloríficas de diferentes substâncias puras, todas à temperatura
ambiente:
I. A capacidade calorífica da água é menor que a do peróxido de
hidrogênio.
GGE RESPONDE ITA 2015 – QUÍMICA
5
ACOMPANHE A RESOLUÇÃO DAS QUESTÕES NO SITE: WWW.GGE.COM.BR
a) ebulição da água.
b) ebulição do benzeno.
c) fusão da água.
d) fusão do benzeno.
e) fusão do dióxido de carbono.
Solução:
O gráfico mostra uma diminuição da massa específica da substância
quando a temperatura é aumentada antes da tempetatura Tx
indicando um aumento do volume. Após a temperatura Tx percebese:
1-Massa específica superior à massa específica à massa específica
antes de Tx
2-A curva de massa específica posterior a Tx indica uma inicial
elevação, devido à uma redução do volume, e uma posterior queda
devido ao aumento do volume.
Desta forma, sabe-se que a água líquida possui massa específica
superior ao gelo, há uma diminuição do seu volume quando a
temperatura aumenta entre 0ºC e 4ºC, e um posterior aumento do
volume quando a temperatura aumenta e esta temperatura é superior
a 4ºC. Assim Tx pode ser representada pela temperatura de fusão da
água à pressão de 1bar.
ALTERNATIVA C
20. Contribuíram de forma direta para o desenvolvimento do conceito
de pressão atmosférica
a) Friedrich August Kekulé e John Dalton.
b) Michael Faraday e Fritz Haber.
c) Galileu Galilei e Evangelista Torricelli.
d) Jõns Jacob Berzelius e Eduard Büchner.
5
e) Robert Bunsen e Henry Louis Le Chatelier.
A+B
Solução:
As contribuições foram de Evangelista Torricelli e Galileu Galilei
Evangelista Torricelli realizou experimento para determinar a pressão
atmosférica ao nível do mar. Fez uso de um tubo de 1m de
comprimento preenchido com mercúrio na seguinte configuração.
d
Ea,I
2c
A+B
Coordenada
De
Reação
Pressão
Atmosférica
Hg
Ea,d
Mesma pressão
em todos os pontos
b) Considerando-se que a reação é elementar no equilíbrio:
Hg
K
Kd
[C]
2
= d = Kc =
⇒ Kc =
3
[ A ][B] K i
3
Kd
2
c) No sentido direto há um aumento de energia potencial, logo neste
sentido, a reação é endotérmica.
Vd = Vi ⇒ K d [ A ][B] = K i [C]2 ⇒
Através dele, encontrou a altura d de 76cm, determinando a pressão
atmosférica como 760mmHg. Torricelli foi discípulo de Galileu, que
desenvolveu experimentos relacionados a altura máxima de sucção
de água de um respiratório, problemas de bombas hidráulicas, e
desenvolveu o termobaroscópio. Os experimentos de Galileu
auxiliaram o desenvolvimento dos estudos de Torricelli.
ALTERNATIVA: C
22. Considere uma solução saturada do sal MX que é pouco solúvel
em água destilada a 25 °C. Seja y a condutância da água destilada e
(y + 2,0 · 10-7) ohm-1 cm-1 a condutância da solução. Sabendo que as
condutividades iônicas molares dos íons M+ e X- são,
respectivamente, 60 ohm-1 cm2 mol-1 e 40ohm-1 cm2 mol-1, determine
a solubilidade do MX em água em mol dm-3.
Solução:
Considere C a concentração do sal MX em sua solução saturada.
MX(aq) → M(+aq) + X(−aq)
100cm 2mol −1
= c ⇒ c = 2 ⋅ 10 − 9 mol ⋅ cm − 3 ⇒
a)
A equação iônica balanceada que descreve a reação de
titulação é:
+
+7 −
+
3+
2+
5Fe(2aq
) + 1Mn O 4( aq ) + 8H( aq ) → 5Fe ( aq ) + 1Mn( aq ) + 4H2O
Re dução : 5 é x1 = 5 e −
Oxidação :1é x5 = 5 e −
b)
A adição de indicador não é necessária, pois o ponto final
da titulação é facilmente identificável devido à coloração violeta muito
intensa que a solução de permanganato possui.
2+
A solução do analito (Fe ) é incolor e após a titulação
passará uma coloração levemente violeta. Essa variação ocorre
c)
c = 2 ⋅ 10 − 6 mol ⋅ L−1
23. Considere uma ração genérica reversível
cinéticos para a reação direta(D) e inversa (I):
a) Qual é a equação iônica balanceada que descreve a reação de
titulação?
b) É necessária a adição de indicador para visualização do ponto
final da titulação? Por quê?
c) Qual será a variação de cor e as espécies responsáveis por essa
variação no ponto de viragem?
d) Qual é o valor numérico da massa (em g) de ferro na
amostra dissolvida, considerando que não há interferentes na
solução?
Solução:
Admitindo que todo sal dissolvido se dissocie temos
Κ = condutivid ade
K = C ⋅ Λ m + + C ⋅ Λ x − , onde
Λ = condutivid ade molar
O valor 2,0 · 10-7 ohm-1 cm-1 está associado à condutividade dos íons
em solução.
Assim,
2 · 10-7 ohm-1 cm-1 = c · 60 ohm-1 cm2 mol-1 + c · 40 ohm-1 cm2 mol-1
2 ⋅ 10 -7 cm −1
24. Uma amostra de ferro foi totalmente dissolvida a Fe(II) em
25,0mL de solução ,aquosa ácida. A seguir, a solução de Fe(II) foi
titulada com 20mL de uma solução aquosa 0,01moIL-1 em
permanganato de potássio. Baseando-se nessas informações,
responda os seguintes itens:
e os dados
devido à presença do íon permanganato, MnO −4 .
d)
De acordo com a equação química no item a), temos:
n(Fe2 + ) = 5.n(MnO 4− ) ⇒ n(Fe 2 + ) = 5.001.20.10 −3 ⇒ n(Fe 2 + ) = 1.10 −3 mol.
Portanto, m(Fe) = 1.10 −3.55,85 = 5,58.10 −2 g .
a) Desenhe o gráfico de energia potencial versus coordenada da
reação direta.
b) Determine o valor numérico da constante de equilíbrio da reação.
c) Qual sentido da reação é endotérmico?
Solução:
a)
25. Descreve-se o seguinte experimento:
i. São dissolvidas quantidades iguais de ácido benzóico e
ciclohexanol em diclorometano.
ii. É adicionada uma solução aquosa 10% massa/massa em
hidróxido de sódio à· solução descrita no item
iii. sob agitação. A seguir, a mistura é deixada em repouso
até que o equilíbrio químico seja atingido, Baseando-se
nessas informações, pedem-se:
a) Apresente a(s) fase(s) líquida(s) formada(s).
b) Apresente o(s) componente(s) da(s) fase(s) formada(s).
c) Justifique a sua resposta para o item b, utilizando a(s)
equação(ões) química(s) que representa(m) a(s) reação(ões).
GGE RESPONDE ITA 2015 – QUÍMICA
6
ACOMPANHE A RESOLUÇÃO DAS QUESTÕES NO SITE: WWW.GGE.COM.BR
6
4e − + PtO 2 + 4H+
Solução:
a) Serão formadas duas fases líquidas. Uma fase aquosa e a outra
orgânica com o diclorometano como solvente.
b) Fase aquosa: água e benzoato de sódio. Fase orgânica:
diclorometano e ciclohexanol
c) A única reação que ocorre quando a solução de hidróxido de
sódio é adicionada consiste na formação do sal orgânico, visto
que o ciclohexanol só reage com bases muito fortes.
+
+ 12H + 10e
−
Br2 + 6H2O
E°=1,00V
E°=1,48V
Como a reação da platina tem um menor potencial, ocorre oxidação
com a mesma:
Pt + 2H2O
4H+ + 4e − + PtO 2
E°=1,00V
Assim, o potencial do elemento será: E°= 1,48V -1,00V = 0,48V
O
O
C
+ NaOH aq)
C
2BrO3−
Pt + 2H2O
(
ONa(a)
OH
+ H2O l
()
b)
26. Considere um elemento galvânico formado por dois
semielementos contendo soluções aquosas ácidas e cujos potenciais
na escala do eletrodo de hidrogênio (E°) nas condições-padrão são
E°(Pt / PtO2) = 1,00V e E°( Br
/ BrO 3−
Anodo : 5Pt + 10H2O
20H+ + 20e − + 5PtO 2
Catodo : 4BrO3− + 24H+ + 20e −
2Br2 + 12H2O
c)
5Pt + 4BrO3− + 4H+
2Br2 + 5PtO2 + 2H2O
) = 1,48V
Baseando-se nessas informações, pedem-se:
27. Com base no modelo atômico de Bohr.
a) Calcule o valor numérico da força eletromotriz do elemento
galvânico.
b) Apresente as equações químicas que representam as
semirreações do anodo e catodo.
c) Apresente a equação química que representa a reação global.
a) Deduza a expressão para o módulo do momento angular orbital
de um elétron na n-ésima órbita de bohr, em termos da constante de
Planck, h.
b) O modelo de Bohr prevê corretamente o valor do modulo angular
orbital do elétron no átomo de hidrogênio em seu estadi
fundamental? Justifique.
Solução:
a)Considere o modelo de Bohr:
Solução:
vn
a) Considerando os potenciais padrão de redução:
4e − + PtO 2 + 4H+
2BrO3− + 12H+ + 10e −
Pt + 2H2O
Br2 + 6H2O
E°=1,00V
E°=1,48V
+ Rn
Como a reação da platina tem um menor potencial, ocorre oxidação
com a mesma:
Pt + 2H2O
4H+ + 4e − + PtO 2
E°=1,00V
Assim, o potencial do elemento será: E°= 1,48V -1,00V = 0,48V
b)
Anodo : 5Pt + 10H2O
20H+ + 20e − + 5PtO 2
Catodo : 4BrO3− + 24H+ + 20e −
2Br2 + 12H2O
c)
5Pt + 4BrO3− + 4H+
2Br2 + 5PtO2 + 2H2O
26. Considere um elemento galvânico formado por dois
semielementos contendo soluções aquosas ácidas e cujos potenciais
na escala do eletrodo de hidrogênio (E°) nas condições-padrão são
E°(Pt / PtO2) = 1,00V e E°( Br / BrO 3− ) = 1,48V
Baseando-se nessas informações, pedem-se:
a) Calcule o valor numérico da força eletromotriz do elemento
galvânico.
b) Apresente as equações químicas que representam as
semirreações do anodo e catodo.
c) Apresente a equação química que representa a reação global.
Usando o modelo ondulatório estacionário para o e − na órbita n:
2πRn = nλ(n = 1,2,...)
Segundo principio da dualidade de Broglie:
h
h
Aplicando na primeira equação:
λ= =
p mv
n h
h
Momento angular.
⇒ mvR n =
2π
mv
b) Desprezando-se efeitos relativísticos, a dedução de Bohr para o
hidrogênio é exata quando se trata da descrição dos níveis de
energia. No caso do momento angular orbital, apenas no estado
fundamental, ou seja, n = 1, a dedução de Bohr é adequada, pois só
existe um orbital nesse nível. Nos demais níveis (n>1), existe mais de
um valor de momento angular, correspondente aos orbitais, e o
modelo de Bohr apenas prevê um único valor para cada n.
2πRn = n
28. Escreva a fórmula estrutural do produto majoritário formado na
reação entre 0,1 mol de tolueno (metilbenzeno) e 0,1 mol de C2 nas
seguintes condições:
a) Ausência de luz e presença de pequena quantidade de Fe(s).
b) Presença de luz e ausência de Fe(s).
Solução:
a) Considerando os potenciais padrão de redução:
GGE RESPONDE ITA 2015 – QUÍMICA
7
ACOMPANHE A RESOLUÇÃO DAS QUESTÕES NO SITE: WWW.GGE.COM.BR
Solução:
a) Na ausência de luz e com catalisador, a reação ocorre por ataque
eletrofílico ao anel aromático. Como o –CH3 é orto-para-dirigente,
teremos como produto majoritário:
7
CH3
CH3
+ Cl2
Cl
Fe
+ HCl
orto-cloro-tolueno
b) Na presença de luz, a reação passa por um mecanismo radicalar,
ocorrendo o ataque no –CH3:
c)
CH2 - Cl
CH3
+ Cl2
Luz
+ HCl
d)
O
C
O
O
O
C
29. Considere os compostos orgânicos metilfenilcetona e propana.
a) Apresente a equação química que representa o equilíbrio
tautométrico para cada um dos compostos.
b) Qual da sduas cetonas acima tem maior conteúdo enólico?
Justifique.
Solução:
a)
H
H2C
H3C
OH
O
H2C
C
O
H
C
CH2
C
OH
H3C
C
CH2
b) A tautometria ocorre por um mecanismo de formação do
carbocátion, como mostra a reação a seguir.
O
H3C
C
CH3
H3C
O
H
C
CH2
OH
H3C
C
CH2
Caso o carbocátion seja estabilizado por grupos doadores de e-,
torna-se mais difícil o deslocamento do H+ na formação do enol.
O radical fenil estabiliza o carbocátion pela ressonância do e- π .
Assim, no caso da metilfenilcetona, o conteúdo enólico é menor no
equilíbrio.
30. Desenhe a formula estrutural (IUPAC) das seguintes espécies
químicas aromáticas.]
a) Naftaleno
b) Fenantreno
c) Antraceno
d) Peróxido de benzoíla
Solução:
a)
b)
GGE RESPONDE ITA 2015 – QUÍMICA
8
ACOMPANHE A RESOLUÇÃO DAS QUESTÕES NO SITE: WWW.GGE.COM.BR
8












