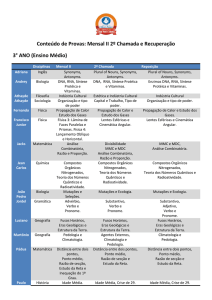
IX Congresso Brasileiro de Análise Térmica e Calorimetria
09 a 12 de novembro de 2014 – Serra Negra – SP - Brasil
ESTUDOS DE COMPATIBILIDADE E CARACTERIZAÇÃO FÍSICA DE DISPERSÕES SÓLIDAS DE
NIFEDIPINO OBTIDAS POR SPRAY-DRIER
Resumo
O nifedipino é um potente vasodilatador arterial utilizado no tratamento da angina de peito e como antihipertensivo. Segundo o Sistema de Classificação Biofarmacêutica é classificado como fármaco de Classe II, com
limitada solubilidade aquosa. As técnicas de dispersão sólida têm sido usadas para aumentar a solubilidade de
fármacos na área farmacêutica. Assim Assim o objetivo desse trabalho é avaliar a compatibilidade das dispersões
sólidas obtidas pelo processo convencional e spray drier do nifedipino em LSS, PVP, PEG 400 e PEG 600
utilizando as técnicas de TG, DTA, DRX e por estudos de Dissolução. Os padrões de difração das dispersões
sólidas indicaram natureza amorfa para as amostras enquanto o fármaco puro tem natureza cristalina. Nas curvas
de DTA das dispersões ocorreram mudanças no comportamento térmico característico de fusão do fármaco
indicando a sua amorfização. A alteração nas curvas de DTA e TG dinâmica indicaram possíveis
incompatibilidades entre o fármaco e os carreadores. Nos estudos de dissolução as dispersões obtidas em spraydrier NFD-LSS e por rotavapor NFD-PVP apresentaram maior percentual e taxa de dissolução.
Palavras-chaves: Nifedipina, DRX, TG, DTA, dissolução.
Introdução
O nifedipino é um agente bloqueador de canal de cálcio utilizado para tratar uma variedade de desordens
cardiovasculares, tais como angina de peito e a hipertensão arterial [1,2]. O nifedipino, segundo o Sistema de
Classificação Biofarmacêutica, é classificado como fármaco de Classe II, que são pouco solúveis em água, mas
uma vez dissolvido, eles rapidamente passam membranas biológicas. Como consequência, os fármacos da classe
II se dissolvem lentamente no ambiente aquoso do trato gastrointestinal após administração oral e resultam em
uma fraca biodisponibilidade [3-4]. O sistema de dispersão sólida do fármaco em um carreador ou matriz sólida
inerte solúvel é uma das estratégias utilizadas no desenvolvimento de preparações farmacêuticas para superar as
limitações de fármacos com baixa solubilidade aquosa [5]. Os carreadores utilizados incluem polímeros como a
polivinilpirrolidonas (PVP), Polietilenoglicóis (PEGs), derivados de celulose e do amido. Inúmeros estudos têm
utilizado dispersões sólidas para melhorar as propriedades de dissolução de drogas pouco solúveis [6-8].
Os métodos de obtenção das dispersões comumente utilizados são o método de fusão, solvente, fusãosolvente e malaxagem, porém a tecnologia de spray drier tem sido empregada com sucesso na preparação de
dispersões sólidas de substâncias ativas farmacêuticas [9-11]. Esse processo produz dispersões sólidas de
partículas com tamanho reduzidos e amorfas, com alta taxa de dissolução e mínimo resíduo de solvente nos
sistemas, além da possibilidade de transposição industrial [12].
Assim o objetivo desse trabalho é avaliar a compatibilidade das dispersões sólidas obtidas pelo processo
convencional (rotavapor) e spray drier do nifedipino em lauril sulfato de sódio (LSS), PVP, PEG 400 e PEG 600
utilizando as técnicas de Termogravimetria (TG), Análise térmica Diferencial (DTA), Difração de raios X (DRX)
e por estudos de Dissolução.
Materiais e Métodos
A nifedipina matéria-prima (NFD), foi adquirida do fornecedor Galena Importadora Química e
Farmacêutica (Lote 809033, Brasil). Os carreadores utilizados foram: Lauril sulfato de sódio (LSS) lote: G21626
(Estados Unidos), polivinilpirrolidona (PVP) lote: M-080606, o polietileno glicol 400 (PEG 400) lote: ALL 27219
pela All Chemistry do Brasil Ltda (Brasil), polietileno glicol 6000 (PEG 6000) lote: Q-1102 CB-01 pela
Henrifarma Produtos Químicos e Farmacêutico Ltda (México) e dióxido de silício coloidal (areosil)
lote:3157052414 pela Henrifarma Produtos Químicos e Farmacêutico Ltda (Alemanha).
IX Congresso Brasileiro de Análise Térmica e Calorimetria
09 a 12 de novembro de 2014 – Serra Negra – SP - Brasil
Preparação das dispersões sólidas
Todas as dispersões foram preparadas contendo as proporções NFD/Carreador/Aerosil (40%:45%:20%).
Nas dispersões preparadas pelo o método de spray-dryer o carreador foi dissolvido em 300 ml de Etanol/água
(1:1), depois, foi adicionado o nifedipino e em seguida o aerosil. O solvente foi evaporado no equipamento spraydrier (Lab Plant Technology, modelo: SD-05) utilizando as condições de fluxo de 245 mL/h, temperatura de
entrada 140 ± 2 º C, temperatura de saída 70 ± 2 º C, pressão 18 bar e atomizador de 1.1 mm de diâmetro. No
método de evaporação de solvente as dispersões foram dissolvidas em etanol absoluto (99º GL) na proporção 1:4
(p/v). O solvente foi evaporado em evaporador flash rotativo (Modelo Fisatom 801 ®), a 45ºC e 80 rpm sob
pressão reduzida (−600 mm Hg). Todas as amostras foram armazenadas em dessecador de vidro Prolab®.
Difração de Raios X
Os espectros de DRX das amostras foram obtidos utilizando o difratômetro de raios X D5000 modelo
(Siemens Bruker AXS-CuKα, geometria θ-20, 40KV – 30mA, tamanho do passo de 0,02º2θ - 2θ°2/min, fenda
principal = 2mmx12mm e recebimento = 0,2mmx12mm, com monogromador de grafite) utilizando a metodologia
do pó.
Análise térmica Diferencial
As curvas DTA foram obtidas em triplicatas utilizando um analisador térmico diferencial de marca
Shimadzu, modelo DTA-50, em atmosfera de nitrogênio de 50 mL.min-1, com massa de 8 (± 0,1) mg,
acondicionadas em um cadinho de alumina até 900°C. As curvas do nifedipino foram obtidas nas razões de
aquecimento de 10, 20,40 °C.min-1. Já, as curvas de DTA das dispersões sólidas foram obtidas na razão de
aquecimento 10 °C.min-1 e dos carreadores puros foram obtidos na razão de aquecimento 10°C.min-1 ate 250 °C e
40 °C.min-1 ate 900°C.
O equipamento foi calibrado através do ponto de fusão e entalpia do padrão Índio, 156,6 °C ± 0,3 e 28,58
J/g ± 0,3, respectivamente, e do ponto de fusão do padrão Zinco (419,6 °C ± 0,3), sob as mesmas condições das
amostras.
Análises termogravimétricas
As curvas de TG/DTG dinâmicas foram obtidas utilizando uma termobalança Shimadzu, modelo TGA 50H,
na atmosfera de ar sintético e nitrogênio, com fluxo de 20 e 50 mL.min-1, respectivamente, até 900°C . A massa
utilizada foi de 5,0 mg (± 0,003) que foi colocada em cadinho de alumina. As curvas do nifedipino foram
realizadas com razões de aquecimento de 10, 20 e 40 °C.min-1 e das dispersões sólida só na razão de aquecimento
de 10°C.min-1. O equipamento TG foi calibrado usando oxalato de cálcio monoidratado. As curvas foram
analisadas pelo programa TASYS da Shimadzu para analisar os estágios de perda de massa.
Estudo de dissolução
O Estudo de dissolução in vitro foi realizado com o nifedipino e todas as dipersões sólidas e utilizou o
aparelho USP tipo II [13]. Operando nas condições de a 37 ± 0,5 ⁰C e rotação de 100 rpm, utilizando Dissolutor
Hanson Research, equipado com 3 cubas e um volume de 900 mL dos meios de dissolução: USP tampão fosfato
pH 7.5 e USP fluido gástrico sem enzima pH 1.2 com 0,5% (m/v) de LSS.
Inicialmente, pesou-se 20 ± 0,02 mg de NFD e 50 ± 0,02 mg de cada dispersão sólida, que é o equivalente a
20 mg de nifedipino, que foram transferidas para as cubas. Em intervalos de 5, 10, 15, 20, 30, 45 e 60 minutos
eram retiradas alíquotas de 3 mL e filtradas através de filtro de membrana de 0,45 µm. As amostras foram
analisadas utilizando um Espectrofotômetro UV-Visível (Shimadzu, UVmini 1240), com leituras de 235 nm por
método de correção em branco.
IX Congresso Brasileiro de Análise Térmica e Calorimetria
09 a 12 de novembro de 2014 – Serra Negra – SP - Brasil
Resultados e Discussão
Estudos de Difração de Raios X (DRX)
Os padrões de difração de raios-X foram obtidos para o nifedipino e as dispersões sólidas, a fim de analisar
o estado cristalino do fármaco e formulações (fig. 1). Os difratogramas correspondentes à nifedipina matéria
prima (NFD) está representados na Fig. 1. Artigos mostram que os picos característicos da nifedipina pura
aparecem em 8.2°, 10.6° e 11.9° [14,15]. O espectro de raios-X da NFD apresentou picos intensos e definidos
indicando alta cristalinidade. Os perfis de difração das dispersões sólidas obtidas pelas técnicas de rotavapor e
spray drier revelaram uma redução significativa dos picos característicos do fármaco, indicando o estado amorfo
das preparações. Apenas a dispersão da nifedipina em LSS pelo método rotavapor apresentou picos intensos e
bem definidos, porém com um padrão de difração diferente do fármaco.
(B)
(A)
1
2
1
2
3
3
4
4
5
5
3
Fig. 1. Curva de difração de raios X do nifedipino material prima (A), dispersões sólidas pelo método de spray
drier (A) e dispersões sólidas pelo método de rotavapor (B): 1-NFD-PVP; 2-NFD-PEG6000; 3-NFD-PEG400; 5NFD-LSS; 6-NFD
Estudos termoanalíticos
A fig. 2 mostra as curvas de DTA e TG dos carreadores isolados. Foi observado pelas duas técnicas que os
carreadores mostraram comportamento térmico diferente do fármaco isolado.
(B)
(A)
1
6
2
3
4
5
6
4
5
3
2
1
Fig 2 Curvas de DTA (A) e TG (B) do NFD e dos carreadores na razão de aquecimento de 10°C.min-1 até 250 °C:
1-NFD; 2-LSS; 3-PEG6000; 4-PEG400;5-PVP; 6-AER
IX Congresso Brasileiro de Análise Térmica e Calorimetria
09 a 12 de novembro de 2014 – Serra Negra – SP - Brasil
As curvas de DTA foram obtidas para a NFD e os carreadores (LSS, PVP, PEG 400 e PEG 6000) puros na
razão de aquecimento de 10 ºC/min. A amostra NFD exibiu um pico endotérmico característico de fusão na
temperatura de 175.5 °C, correspondente ao ponto de fusão da nifedipina [16]. O LSS apresentou 3 picos
endotérmicos (99,2ºC; 194,5ºC e 220,6ºC), o PEG 6000 apresentou 1 pico endotérmico (64ºC), já o PVP, o PEG
400 e o aerosil não apresentou nenhum pico nessa faixa de temperatura.
As curvas de DTA das dispersões sólidas obtidas pelos métodos de spray drier e rotavapor mostraram uma
variação nos pontos de fusão correspondente a fusão do NFD (Fig. 3). Os formatos das curvas de todas as
amostras das dispersões mostraram o desaparecimento do processo de fusão indicando uma possível
incompatibilidade entre o fármaco e os excipientes estudados.
(B)
(A)
1
1
2
2
3
3
4
5
4
5
Fig. 3 Curvas de DTA das dispersões sólidas com os carreadores LSS, PVP, PEG 6000e PEG 400 pelo método de
spray drier (A) E pelo método de rotavapor (B): ): 1- NFD; 2- NFD-LSS; 3- NFD-PEG6000; 4- NFD-PEG400; 5NFD-PVP
(A)
(B)
5
4
2
3
1
5
4
2
3
1
Fig. 4 Curvas de TG das dispersões sólidas com os carreadores LSS, PVP, PEG 6000e PEG 400 pelo método de
spray drier (A) e pelo método de rotavapor (B): 1- NFD; 2- NFD-LSS; 3- NFD-PEG6000; 4- NFD-PEG400; 5NFD-PVP
As curvas TG evidenciaram que todas as amostras das dispersões apresentaram o estagio principal de
decomposição em temperaturas superiores a do fármaco isolado, exceto as dispersões sólidas do LSS pelas duas
técnicas que mostraram esse estágio ocorrendo em temperaturas inferiores (Fig. 4). O número de estágios de perda
de massa de NFD-PEG 400 e NFD-6000 foram iguais à NFD. As curvas TG das dispersões de LSS e PVP
apresentaram 2 estágios de decomposição, com exceção do PVP pelo método de spray drier que apresentaram 3
estágios de decomposição (Fig.4A). Os resultados termogravimétricos mostraram diferentes comportamentos
térmicos da NFD em relação às dispersões, indicando uma possível incompatibilidade entre o fármaco e os
excipientes estudados.
IX Congresso Brasileiro de Análise Térmica e Calorimetria
09 a 12 de novembro de 2014 – Serra Negra – SP - Brasil
Dissolução das dispersões sólidas
Os perfis de dissolução das amostras estudadas são apresentados nas figs 5 e 6. Os perfis de dissolução
variaram conforme os meios de dissolução. A Tabela 1 mostra a quantidade de nifedipina dissolvida após 1 hora
de dissolução. Nos dois meios de dissolução estudados as dispersões obtidas em spray-drier NFD-LSS e NFDPVP apresentaram maior percentual e velocidade de dissolução que a NFD. As dispersões obtidas por rotavapor
no meio USP fluido gástrico apresentaram uma taxa e percentual de dissolução menores que o fármaco puro, já no
meio tampão fosfato o percentual de dissolução das dispersões foram superiores sendo a NFD-PVP a que
apresentou um maior percentual.
(A)
(B)
2
5
1
1
5
2
4
3
/
3
4
Fig. 9. Perfil de dissolução das dispersões sólidas no meio de dissolução USP fluido gástrico sem enzima pH 1.2
com 0,5% (m/v) de lauril sulfato de sódio, (A) método de spray drier e (B) método rotavapor: 1- NFD; 2- NFDLSS; 3- NFD-PEG6000; 4- NFD-PEG400; 5-NFD-PVP
2
5
5
4
2
3
4
3
1
1
(A)
(B)
Fig.8. Perfil de dissolução das dispersões sólidas no meio de dissolução USP tampão fosfato pH 7.5, (A) método
de spray drier e (B) método rotavapor: 1- NFD; 2- NFD-LSS; 3- NFD-PEG6000; 4- NFD-PEG400; 5-NFD-PVP
Tabela 1 Percentual de nifedipina dissolvida em 1 hora de dissolução nos meios: USP fluido gástrico simulado
sem enzimas (pH 1.2) com 0,5% (m/v) de LSS e USP tampão fosfato (pH 6.0). (75 rpm, 900 ml, n = 3).
NFD
Spray-drier
Rotavapor
Spray drier
Rotavapor
NFD-LSS
NFD-PVP
NFD-PEG400
USP fluido gástrico sem enzima pH 1.2
64,03 ± 0,86
47,74 ± 0,23
19,13 ± 1,30
41,88 ± 10,18
29,93 ± 12,25
40,72 ± 0,33
4,82 ± 1,64
USP Tampão fosfato
56,49 ± 1,15
31,92 ± 0,28
9,64 ± 0,24
2,73 ± 0,59
15,45 ± 0,91
39,56 ± 1,83
5,05 ± 1,05
NFD-PEG6000
31,00 ± 1,26
2,28 ± 1,25
3,04 ± 0,42
18,72 ± 0,20
IX Congresso Brasileiro de Análise Térmica e Calorimetria
09 a 12 de novembro de 2014 – Serra Negra – SP - Brasil
Conclusão
A difração de raios X em pó evidenciou modificações no padrão de difração das dispersões sólidas em
relação ao fármaco nifedipino. As amostras de NFD-LSS, NFD-PEG400 e NFD-PVP obtida por spray drier e de
NFD-LSS, NFD-PEG400 obtidas por rotavapor apresentaram padrão de substância amorfa, que foram
confirmadas pelas curvas de DTA onde ocorreu mudanças no comportamento térmico característico de fusão do
fármaco indicando a sua amorfização. A alteração nas curvas de DTA e TG dinâmica indicaram possíveis
interações físicas entre o fármaco e os carreadores. As curvas de TG dinâmica das dispersões sólidas mostraram
ainda um aumento da estabilidade térmica fármaco-excipientes, com exceção da dispersão sólida NFD-LSS
rotavapor. Nos estudos de dissolução as dispersões obtidas em spray-drier NFD-LSS e por rotavapor NFD-PVP
se destacaram por apresentar maior percentual e taxa de dissolução.
Referências
1. Croom KF, Wellington K. Modified-Release Nifedipine: A Review of the use of modified-release formulations
in the treatment of hypertension and angina pectoris. Drugs. 2006;66(4):497–528.
2. Rosendorff C., Black H.R., Cannon C.P., et al.. Treatment of hypertension in the prevention and management
of ischemic heart disease: a scientific statement from the American Heart Association Council for High Blood
Pressure Research and the Councils on Clinical Cardiology and Epidemiology and Prevention. Circulation.
2007;115:2761–88.
3. Amidon, G. L.; Lennernäs, H.; Shah, V. P.; Crison, J. R. A theoretical basis for a biopharmaceutical drug
classification: the correlation of in vitro drug product dissolution and in vivo bioavailability. Pharmaceutical
Research, 1995;12(3):413-420.
4. Visser, M.R., Baert, L., Klooster, G. van ’t, et al. Inulin solid dispersion technology to improve the absorption
of the BCS Class IV drug TMC240. Euro Jl of Pharm and Biopharm, 2010;74:233–238.
5. Vasconcelos, T., Sarmento, B., Costa, P. Solid dispersions as strategy to improve oral bioavailability of poor
water soluble drugs. Drug Discovery Today. 2007; 12:1068-1073.
6. El-Badry, M., Fathy, M. Enhancement of the dissolution and permeation rates of meloxicam by formation of its
freeze-dried solid dispersions in polvvinylpyrrilidone k-30 Drug Dev. Ind. Pharm., 2006;32: 141–150
7. Thybo, P., Kristensen, J., Hovgaard, L. Characterization and physical stability of tolfenamic acid–PVP K30
solid dispersions Pharm. Dev. Technol. 2007;12:43–53
8. Yoshida, T., Kurimoto, I, Yoshihara, K., Umejima, H., Ito, N., Watanabe, S., Sako, K., Kikuchi, A. Aminoalkyl
methacrylate copolymers for improving the solubility of tacrolimus. I: Evaluation of solid dispersion
formulations. Inter. J. of Pharm. 2012;428: 18-24.
9. Takeuchi, H., Nagira, S., Yamamoto, H., Kawashima, Y. Solid dispersion particles of amorphous indomethacin
with fine porous silica particles by using spray-drying method .Inter Jl of Pharm. 2005;293:155-164.
10. Nakanishi, S., Fujii M., Sugamura, Y., Suzuki, A., Shibata, Y., Koizumi, N., Watanabe, Yoshiteru, Evaluation
of the physicochemical characteristics of crospovidone that influence solid dispersion preparation, Inter J of
Pharm. 2011;413:119-125
11.Duret, C., Wauthoz, N., Sebti, T., Vanderbist, F. Amighi, K. Solid dispersions of itraconazole for inhalation
with enhanced dissolution, solubility and dispersion properties Inter. J of Pharm. 2012; 428:103-113.
12.Chauhan B., Shimpi S., Paradkar, A. Preparation and evaluation of glibenclamide-polyglycolized glycerides
solid dispersions with silicon dioxide by spray drying technique. Europ J of Pharma Sci. 2005; 26: 219-230.
13. USP34-NF29. United States Pharmacopoeial Convention, Inc.: Washington, MD 2011.
14. Vippagunta, S.R.; Maul, K.A.; Tallavajhala, S.; Grant, D.J.W. Solid-state characterization of nifedipine solid
dispersions. Inter. J. of Pharm. 2002;236:111–123.
15. Leite, RS. Macedo, R.O., Torres, SM, Batista, C.C.N, Baltazar,L.O., Lima Neto, AS., Souza, FS. Evaluation
of thermal stability and parameters of dissolution of nifedipine crystals. Therm. Anal. Calor. 2013; 111:2117–
2123
16. Farmacopéia Brasileira. Vol. 2. 5ª ed. ANVISA, Brasília. 2010. p 1155-1157.