TUTORIAL – 6R
Data:
Aluno (a):
Série: 3ª
Ensino Médio
Turma:
Equipe de Química
QUÍMICA
FUNÇÕES DA QUÍMICA INORGÂNICA
INTRODUÇÃO:
As principais funções da Química Inorgânica são:
1.
2.
3.
4.
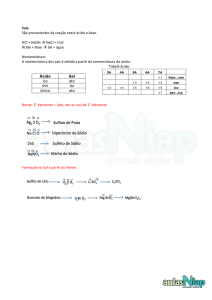
Óxidos
Ácidos
Bases
Sais
1 – ÓXIDOS:
Compostos formados por dois elementos, dos quais o oxigênio é o mais eletronegativo.
Fórmula geral: ExOy.
Classificação:
A. Óxidos ácidos ou Anidridos
B. Óxidos básicos
C. Óxidos anfóteros
D. Peróxidos
E. Superóxidos ou Polióxidos
F. Óxidos neutros, indiferentes ou inertes
A. ÓXIDOS ÁCIDOS OU ANIDRIDOS.
Reagem com a água formando ácidos (oxiácidos).
Reagem com bases formando sal + água.
São, em sua maioria, óxidosde ametais (ametal + oxigênio) e logo são óxidos moleculares,isto é, são
formados por ligações covalentes.
Nomenclatura:
ÓXIDO + NOME DO ELEMENTO + SUFIXO CORRESPONDENTE AO NOX
a) O elemento apresenta apenas 1 anidrido: sufixo - ico
b) O elemento apresenta 2 anidridos:
Menor nox do elemento: sufixo - oso
Maior nox do elemento: sufixo - ico
c) O elemento apresenta 4 anidridos:
Menor nox: prefixo hipo- + nome do elemento + sufixo - oso
Segundo menor nox: sufixo - oso
Segundo maior nox: sufixo – ico
Maior nox: prefixo per- + nome do elemento + sufixo - ico
Colégio A. LIESSIN – Scholem Aleichem
-1-
NANDA/JUNHO/2014 – 628
OBS: O nome dos ácidos originados a partir da reação do anidrido com água será baseado no nome do
anidrido.
B. ÓXIDOS BÁSICOS.
Reagem com a água formando bases.
Reagem com ácidos formando sal + água.
São, em sua maioria, óxidosde metais (metal + oxigênio) com nox baixo (1+ ou 2+)
Nomenclatura:
ÓXIDO + DE + NOME DO ELEMENTO
C. ÓXIDOS ANFÓTEROS.
Possuem duplo comportamento (ácido ou básico).
Se reagirem com uma base terá comportamento de óxido ácido.
Se reagirem com um ácido terá comportamento de um óxido básico.
Reagem com ácidos e bases formando sal + água.
São, em sua maioria, óxidosde metais (metal+ oxigênio) com nox 2+ ou 3+, como o Alumínio e o
Zinco.
Nomenclatura:
ÓXIDO + DE + NOME DO ELEMENTO
D. PERÓXIDOS.
Possuem uma ligação do tipo R-O-O-H, sendo R outro elemento.
O oxigênio adquire estado de oxidação (nox) igual a -1.
O mais comum é o peróxido de hidrogênio (H2O2) mais conhecido como água oxigenada.
Nomenclatura:
PERÓXIDO + DE + NOME DO ELEMENTO
E. SUPERÓXIDO.
O oxigênio adquire estado de oxidação (nox) igual a -1/2.
São compostos basicamente de metais alcalinos e alcalinos terrosos mais o ânion O2- (metal + O2-).
Nomenclatura:
SUPERÓXIDO + DE + NOME DO ELEMENTO
G. ÓXIDO NEUTROS.
Não reagem com água, ácido ou base.
São estruturas covalentes.
São formados por oxigênio e ametais.
Os óxidos neutros são: NO, N2O, CO e H2O
Nomenclatura:
ÓXIDO + DE + NOME DO ELEMENTO
Colégio A. LIESSIN – Scholem Aleichem
-2-
NANDA/JUNHO/2014 – 628
1 – ÁCIDO:
Compostos que em água libera íon H+.
Fórmula geral:HxAyOz ou HxA
Classificação:
A. Hidrácidos.
B. Oxiácidos.
A. HIDRÁCIDOS.
São formados por Hidrogênio e um Ametal, sem Oxigênio.
São compostos de fórmula HxA, em geral.
Podem ser classificados entre fortes (HBr, HCl e HI), moderados (HF) e fracos (demais).
Nomenclatura: ÁCIDO+ NOME DO ELEMENTO+ SUFIXO ÍDRICO.
B. OXIÁCIDOS.
São formados por Hidrogênio, Ametal e Oxigênio.
Possuem fórmula molecular HxAyOz
ÁCIDO+ NOME DO ELEMENTO+ SUFIXO CORRESPONDENTE AO NOX.
a) O elemento apresenta 2 oxiácido:
Menor nox do elemento: sufixo - oso
Maior nox do elemento: sufixo - ico
b) O elemento apresenta 4 oxiácido:
Menor nox: prefixo hipo- + nome do elemento + sufixo - oso
Segundo menor nox: sufixo - oso
Segundo maior nox: sufixo – ico
Maior nox: prefixo per- + nome do elemento + sufixo - ico
3 – BASES:
Compostos que em água dissociam em um cátion metálico e um ânion OH-.
Fórmula geral: Mx(OH)y.
Nomenclatura: HIDRÓXIDO+ DE + NOME DO ELEMENTO.
1 – SAIS:
Fórmula geral: MxAy
São formados pela reação entre ácido e uma base.
Nomenclatura
NOME DO ELEMENTO DO ÂNION+SUFIXO DETERMINADO PELO NOX + DE + NOME DO
ELEMENTO DO CÁTION.
Colégio A. LIESSIN – Scholem Aleichem
-3-
NANDA/JUNHO/2014 – 628
A. Ânions não oxigenados.
O sufixo do ânion será ETO.
Provem da reação entre uma base e um hidrácido.
Exemplo:
KCl = > cloreto de potássio
NaI => iodeto de sódio
B. Ânions oxigenados.
O sufixo dependerá do nox do oxiácido proveniente.
Caso o oxiácido tenha o sufixo “ICO”, este será mudado para “ATO”.
Caso o oxiácido tenha o sufixo “OSO”, este será mudado para “ITO”.
Os prefixos “HIPO” e “PER” deverão ser mantidos.
Exemplos:
Na2SO4 = sulfato de sódio
LiNO2 = nitrito de lítio
Mg(ClO)2 = hipoclorito de magnésio
NaClO4 =perclorato de sódio
Exercícios:
1. Um aluno propôs quatro equações diferentes para a reação da amônia aquosa com uma solução
aquosa de ácido clorídrico. Qual delas está CORRETA?
2. Associe a coluna da esquerda com a da direita e assinale a alternativa que representa a sequência
CORRETA de (I) a (V).
a) I-A, II-B, III-C, IV-D, V-E.
b) I-E, II-A, III-D, IV-C, V-B.
c) I-B, II-A, III-D, IV-E, V-C.
d) I-C, II-B, III-A, IV-D, V-E.
e) I-C, II-A, III-E, IV-B, V-D.
3. O “gelo seco” é dióxido de carbono sólido, e nas condições ambientes sofre sublimação. Colocandose gelo seco em contato com um solução aquosa de NaOH contendo o indicador fenolftaleína, observaColégio A. LIESSIN – Scholem Aleichem
-4-
NANDA/JUNHO/2014 – 628
se que a coloração da solução, que inicialmente é rosa, torna-se incolor. Com base nessas
informações, é correto afirmar que:
a) O CO2 reagiu com o NaOH, aumentando o pH
b) o pH da solução aumentou.
c) as interações intermoleculares do gelo seco são mais intensas do que as interações intermoleculares
do NaOH.
d) O CO2 reagiu com o NaOH, diminuindo o pH
e) o gelo seco possui interações intermoleculares do tipo ligação de hidrogênio.
4. Acreditava-se que a dissolução do dióxido de carbono atmosférico na água do mar deveria ser um
fenômeno desejável por contribuir para a redução do aquecimento global. Porém, tal dissolução abaixa
o pH da água do mar, provocando outros problemas ambientais. Por exemplo, são danificados
seriamente os recifes de coral, constituídos, principalmente, de carbonato de cálcio.
A equação química que representa simultaneamente a dissolução do dióxido de carbono na água do
mar e a dissolução dos recifes de coral é:
s = sólido
g = gasoso
l = líquido
aq = aquoso
5. A chuva ácida é um dos fenômenos mais preocupantes causados pela sociedade moderna. O
enxofre, presente nos combustíveis, é um dos elementos que contribui para sua formação. Esta chuva
provoca a corrosão como, por exemplo, em monumentos artísticos de mármore, devido a uma reação
química. A corrosão neste material é consequência do mármore ser formado, principalmente, de:
a) Óxido de silício.
b) Sulfato de cálcio.
c) Silicato de cálcio.
d) Fosfato de sódio.
e) Carbonato de cálcio.
6. No passado, alguns refrigerantes à base de soda continham citrato de lítio e os seus fabricantes
anunciavam que o lítio proporcionava efeitos benéficos, como energia, entusiasmo e aparência
saudável. A partir da década de 1950, o lítio foi retirado da composição daqueles refrigerantes, devido à
descoberta de sua ação antipsicótica. Atualmente, o lítio é administrado oralmente, na forma de
carbonato de lítio, na terapia de pacientes depressivos. A fórmula química do carbonato de lítio e as
características ácido-base de suas soluções aquosas são, respectivamente,
a) Li2CO3 e ácidas.
b) Li2CO3 e básicas.
c) Li2CO4 e neutras.
d) LiCO4 e ácidas.
e) LiCO3 e básicas.
Colégio A. LIESSIN – Scholem Aleichem
-5-
NANDA/JUNHO/2014 – 628
7. Um estudante realizou um experimento com um ovo cru e um copo contendo uma solução diluída de
ácido clorídrico, como demonstrado a seguir.
Sabe-se que a casca do ovo é constituída por carbonato de cálcio. Considerando-se essas informações,
é CORRETO afirmar que:
a) o ovo afunda, ao final do experimento, porque, sem casca, ele se torna menos denso que a solução.
b) a quantidade de ácido clorídrico diminui durante o experimento.
c) as bolhas são formadas pela liberação de gás hidrogênio.
d) o pH da solução utilizada diminui ao longo do experimento.
8. (Pucrs 2007) No mar existem vários sais dissolvidos, tais como CLORETO DE SÓDIO, CLORETO
DE MAGNÉSIO, SULFATO DE MAGNÉSIO e outros. Também se encontram sais pouco solúveis na
água, como o CARBONATO DE CÁLCIO, que forma os corais e as conchas. As fórmulas químicas das
substâncias destacadas estão reunidas, respectivamente, em:
a) NaCl, MgCl2, MgS e CaCO3
b) NaCl2, MgCl2, MgSO4 e Ca2C
c) NaCl2, MgCl, Mg2SO4 e Ca(CO3)2
d) NaCl, MgCl2, MgSO4 e CaCO3
e) NaCl, Mg2Cl, MgS e Ca2CO3
9. Alguns compostos, quando solubilizados em água, geram uma solução aquosa que conduz
eletricidade. Dos compostos abaixo:
I- Na2SO4
II- O2
III- C12H22O11
IV- KNO3
V- CH3COOH
VI- NaCl
formam solução aquosa que conduz eletricidade:
a) apenas I, IV e VI
b) apenas I, IV, V e VI
c) todos
d) apenas I e VI
e) apenas VI
10. (Pucsp) Algumas propriedades das substâncias W, X, Y e Z estão apresentadas a seguir:
Colégio A. LIESSIN – Scholem Aleichem
-6-
NANDA/JUNHO/2014 – 628
Assinale a alternativa em que as substâncias apresentadas correspondem às propriedades indicadas na
tabela anterior.
a) W=ácido acético; X=ferro; Y=álcool; Z=cloreto de sódio
b) W=álcool; X=cloreto de sódio; Y=mercúrio; Z=grafite
c) W=mercúrio; X=grafite; Y=ácido acético; Z=ferro
d) W=álcool; X=ferro; Y=dióxido de carbono; Z=cloreto de sódio
e) W=ácido acético; X=prata; Y=oxigênio; Z=grafite
Gabarito:
1. B
2. E
3. D
4. D
5. E
6. B
7. B
8. D
9. B
10. A
Colégio A. LIESSIN – Scholem Aleichem
-7-
NANDA/JUNHO/2014 – 628