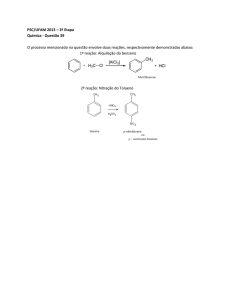
QUÍMICA
Material nº 9
Prof. GIACOMETTO
GEOMETRIA DAS MOLÉCULAS E INTERAÇÕES INTERMOLECULARES
01) (PUC SP) Qual das substâncias a seguir tem
molécula linear e apresenta ligações duplas?
a)
b)
c)
d)
e)
05) (UFPE-Adaptado) A respeito dos compostos
binários que se pode formar entre oxigênio (Z=8) e
os demais elementos que ocorrem na natureza, é
correto afirmar que:
HCl
H2O
N2
CO2
NH3
01) Os óxidos de metais alcalinos tendem a ser
covalentes com fórmula M2O, com o metal no
estado de oxidação +1 e o oxigênio no estado
–2.
02) O carbono (Z=6) pode formar as molecular CO
e CO2, que são lineares, e por isso são
apolares e, em ambas as moléculas, o
oxigênio apresenta a camada de valência
completa.
04) A geometria da molécula SO2, dióxido de
enxofre, é angular e nela o enxofre (Z=16)
apresenta um par de elétrons não ligantes.
08) Por ser um elemento muito eletronegativo, o
oxigênio, nesses compostos, geralmente
apresenta estado de oxidação negativo.
16) O oxigênio não forma compostos covalentes
com elementos que estão localizados à sua
direita na Tabela Periódica.
02) (ITA SP) Assinale a opção que contém,
respectivamente, a geometria das moléculas NH3 e
SiCl4 no estado gasoso:
a)
b)
c)
d)
e)
Plana; plana.
Piramidal; plana.
Plana; tetragonal.
Piramidal; piramidal.
Piramidal; tetragonal.
03) (ACAFE SC) A água é uma substância que permitiu
a criação e a manutenção da vida no planeta Terra.
Analise as seguintes afirmações sobre a água.
I. É capaz de formar pontes de hidrogênio.
II. Sua molécula tem forma geométrica não-linear.
III. Sua molécula tem forma geométrica linear.
IV. Solubiliza substâncias de baixa polaridade,
como hidrocarbonetos.
A alternativa, que contém todas as afirmações que
estão corretas, é:
a)
b)
c)
d)
e)
06) (UNIFESP SP)Na figura, são apresentados os
desenhos de algumas geometrias moleculares.
II - III
I - ll - IV
I - II
I - II - III - IV
llI - IV
SO3, H2S e BeCl2 apresentam, respectivamente, as
geometrias moleculares
04) (UEM PR) Assinale a alternativa incorreta.
2
2
a) Um átomo com configuração eletrônica 1s 2s
6
2
6
2p 3s 3p apresenta número atômico 18.
b) A seqüência sódio<cloro<hélio representa a
ordem crescente do primeiro potencial de
ionização desses elementos.
c) O trifluoreto de boro e o metano apresentam
geometria molecular tetraédrica.
d) A massa de um elétron é cerca de 1836 vezes
menor que a massa de um próton ou de um
nêutron.
e) O volume molar de um gás é o volume ocupado
por 1 mol desse gás em determinada pressão e
temperatura.
a)
b)
c)
d)
e)
III, I e II.
III, I e IV.
III, II e I.
IV, I e II.
IV, II e I.
07) (UNOPAR PR) Segundo a Organização Mundial de
Saúde, não são adequadas quantidades superiores
a 10 ppm (partes por milhão) de íons nitrato (NO 3 )
na água potável, pois isso pode acarretar câncer de
estômago e também, no caso de gestantes, uma
forma grave de anemia no feto que está sendo
gerado.
Sobre o íon em questão, pode-se afirmar que sua
geometria é: (números atômicos: H = 1; N = 7;
O = 8)
a)
b)
c)
d)
e)
1
linear
trigonal plana
angular
piramidal
tetraédrica
Valério – Sociologia – 2010
QUÍMICA
Material nº 9
Prof. GIACOMETTO
08) (UEL PR) Leia o texto a seguir.
Os raios que ocorrem na atmosfera e a queima de
combustíveis derivados do petróleo contendo
hidrocarbonetos
e
compostos
de
enxofre
(mercaptanas) contribuem para a produção de
várias substâncias, dentre as quais pode-se
destacar: CO2, CO, H2O, NO, SO2 e até mesmo,
em pequenas quantidades, NO2 e SO3. Algumas
destas emissões são, em parte, responsáveis pelo
aumento do efeito estufa e pela formação da chuva
ácida.
Sobre a geometria das moléculas, considere as
afirmativas a seguir.
I.
A molécula do CO2(g) é linear, porque o átomo
central não possui pares de elétrons
disponíveis.
II. A molécula H2O(l) é angular, porque o átomo
central possui pares de elétrons disponíveis.
III. A molécula do SO2(g) é angular, porque o
átomo central possui pares de elétrons
disponíveis.
IV. A molécula do SO3(g) é piramidal, porque o
átomo central possui pares de elétrons
disponíveis.
Estão corretas apenas as afirmativas:
a)
b)
c)
d)
e)
- O reator 1 é um sistema fechado.
- O NO que sai pelo topo é produzido dentro da
coluna de absorção.
- A produção da solução aquosa de ácido nítrico é
de 10000 kg/h.
- Massas molares (g/mol) : N = 14; O = 16; H = 1.
Os gases residuais identificados no diagrama são
O2, NO, N2 e NH3.
Com relação às moléculas, são feitas as seguintes
afirmativas.
I. As polaridades das ligações na molécula deNH3
se anulam, resultando uma molécula apolar.
II. As moléculas de O2, NO, N2 e NH3 contém 16,
11, 10 e 8 prótons, respectivamente.
III. As moléculas de O2, NO e N2 são todas
lineares.
IV. As moléculas de NH3, nas fases sólida e líquida,
se comportam como dipolos que exercem
atrações uns com os outros denominadas
ligações de hidrogênio. Assinale a alternativa
que contém todas as afirmativas corretas.
a)
b)
c)
d)
e)
I e III.
I e IV.
II e IV.
I, II e III.
II, III e IV.
10) (UFSCAR SP)A sacarose (açúcar comum), cuja
estrutura é mostrada na figura, é um dissacarídeo
constituído por uma unidade de glicose ligada à
frutose.
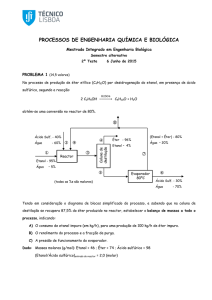
09) (UEL PR) O ácido nítrico, HNO3, é usado como
matéria-prima na produção de fertilizantes e
explosivos. O processo patenteado pela primeira
vez em 1902 pelo químico Wilhelm Ostwald é o
mais importante processo industrial para a
fabricação do ácido nítrico.
A tabela e o diagrama simplificado mostram a
produção de ácido nítrico por oxidação catalítica.
HO
O
HO
OH
HO
O
HO
HO
O
OH
OH
Etapa 1:
4 NH 3 (g) 5O 2 (g)
850 º C, 5atm, Pt / Rh
A solubilidade da sacarose em água deve-se:
a) ao rompimento da ligação entre as unidades de
glicose e frutose.
b) às ligações de hidrogênio resultantes da
interação da água com a sacarose.
c) às forças de van der Waals, resultantes da
interação da água com a unidade de glicose
desmembrada.
d) às forças de dipolo-dipolo, resultantes da
interação da água com a unidade de frutose
desmembrada.
e) às forças de natureza íon-dipolo, resultantes da
interação do dipolo da água com a sacarose.
4 NO(g) 6H 2O(g)
Etapa 2:
2 NO(g) O 2 (g)
2 NO 2 (g)
Etapa 3:
3NO 2 (g) H 2O(l)
2HNO 3 (aq ) NO(g)
gases residuais:
O2, NO, N2 e NH3
água de processo
ar e
amônia
I e IV.
II e III.
III e IV
I, II e III.
I, II e IV.
reator I
trocador
de calor
câmara II
etapa 2
etapa 1
água de
resfriamento
coluna de
absorção
etapa 3
ar em excesso
solução aquosa de ácido
nítrico (60% em massa)
Dados:
- Na oxidação da amônia, etapa 1, o calor envolvido
na reação mantém o catalisador aquecido.
2
Valério – Sociologia – 2010
QUÍMICA
Material nº 9
Prof. GIACOMETTO
11) (UERJ)Os motores dos carros a gasolina
fabricados em nosso país funcionam bem com uma
mistura combustível contendo 22% em volume de
etanol. A adulteração por adição de maior
quantidade de álcool na mistura ocasiona corrosão
das peças e falhas no motor.
O teste de controle da quantidade de álcool na
gasolina vendida pelos postos autorizados é feito
misturando-se num frasco graduado e com tampa,
50mL da gasolina do posto com 50mL de solução
aquosa de cloreto de sódio. Após agitação,
esperam-se alguns minutos e observa-se a
separação das fases da mistura.
Num determinado posto, feito o teste, resultou que a
fase orgânica ocupou o volume de 39mL , e a fase
aquosa 61mL, o que isentou o posto de multa.
Entre as alternativas abaixo, aquela que NÃO está
de acordo com o teste realizado é:
14) (UFG GO) Quando uma pessoa inala benzeno, seu
organismo dispara um mecanismo de defesa que o
transforma
no
catecol,
uma
substância
hidrossolúvel, como representado, a seguir:
OH
O2 +
OH
Benzeno
Catecol
a) Por que o catecol é mais solúvel em água que o
benzeno?
b) Explique por que a temperatura ambiente e a
1 atm, o oxigênio é gás, o benzeno é líquido e o
catecol é sólido.
15) (ITA SP)Assinale a alternativa que contém a
afirmação FALSA em relação a comparação das
propriedades do 1-propanol com o 1-butanol.
a) após agitação , o etanol ocupou totalmente a
fase orgânica.
b) a mistura água e gasolina pode ser separada
por decantação.
c) o etanol dissolve-se em gasolina devido às
forças intermoleculares de Van der Waals
d) o etanol dissolve-se em água devido a
interações por formação de pontes de
hidrogênio
e) as pontes de hidrogênio são interações mais
fortes do que as forças intermoleculares de Van
der Waals.
a) A temperatura de ebulição do 1-butanol é maior.
b) Na mesma temperatura, a pressão de vapor do
1-propanol é maior.
c) Nas mesmas condições de operação, a
volatilidade do 1-butanol é maior.
d) O 1-propanol é mais solúvel em água.
e) O 1-butanol é mais solúvel em n-hexano.
16) (UFTM MG) Analise a tabela:
12) (ITA SP) Assinale a alternativa ERRADA relativa à
comparação do ponto de ebulição de algumas
substâncias orgânicas.
Substância
Massa Molar (g.mol-1)
propano (CH 3-CH 2-CH 3
éter metílico (CH -O-CH )
3
3
etanol (CH -CH -CH
)
a) a etilamina tem ponto de ebulição maior que a
do éter metílico.
b) o n-butanol tem ponto de ebulição maior que o
do etanol.
c) o éter metílico tem ponto de ebulição maior que
o do etanol
d) o etanol tem ponto de ebulição maior que o do
etanal.
e) o butanol tem ponto de ebulição maior que o do
éter etílico
3
2
3
44
46
46
São feitas as seguintes proposições:
I. o ponto de ebulição do éter metílico é igual ao
do etanol, pois possuem mesma massa molar;
II. a força intermolecular do etanol é ligação de
hidrogênio, possuindo o maior ponto de
ebulição;
III. a força intermolecular do propano é denominada
van der Waals.
Está correto o contido em:
13) (PUC RJ) A grande solubilidade do etanol em água
deve-se a:
a)
b)
c)
d)
e)
Enzima
a)
b)
c)
d)
e)
Ionização do etanol.
dissociação do etanol.
formação de pontes de hidrogênio.
forças de Van de Walls.
Inexistência de polaridade nas moléculas.
3
I, apenas.
II, apenas.
I e III, apenas.
II e III, apenas.
I, II e III.
Valério – Sociologia – 2010
QUÍMICA
Material nº 9
Prof. GIACOMETTO
17) (UNESP SP) Comparando-se os pontos de
ebulição do éter dimetílico (H3C–O–CH3) com o
ponto de ebulição do álcool etílico (H3C–CH2–OH),
o éter dimetílico terá ponto de ebulição:
20) (ITA SP) Em cinco frascos de 250 mL de rolha e
numerados de I a V, são colocados 100 mL de
tetracloreto de carbono, 100 mL de água e 2 g da
substância indicada a seguir:
a) maior, porque apresenta forças de Van der
Waals entre suas moléculas.
b) maior, porque apresenta ligações de hidrogênio
entre suas moléculas.
c) menor, porque apresenta forças de Van der
Waals entre suas moléculas.
d) menor, porque apresenta ligações de hidrogênio
entre suas moléculas.
e) igual ao do álcool etílico, porque as duas
substâncias têm a mesma massa molar.
I. Iodo.
II. Cloreto de sódio
III. Benzeno.
IV. Açúcar
V. Cloreto de prata.
Estas misturas, agora em três componentes, são
agitadas. Uma vez estabelecido o equilíbrio, é
FALSO afirmar que:
a) Em I a maior parte do iodo estará dissolvida na
fase orgânica.
b) Em II praticamente todo o cloreto de sódio
estará dissolvido na fase aquosa.
c) Em III praticamente todo o benzeno estará
dissolvido no tetracloreto de carbono.
d) Em IV praticamente todo o açúcar estará
dissolvido na fase orgânica.
e) Em V praticamente todo o cloreto de prata
estará na forma de uma terceira fase sólida.
18) (ITA SP) Assinale a opção CORRETA em relação à
comparação das temperaturas de ebulição dos
seguintes pares de substâncias:
a) Éter dimetílico > etanol; propanona
etanóico; naftaleno < benzeno;
b) Éter dimetílico < etanol; propanona
etanóico; naftaleno > benzeno;
c) Éter dimetílico > etanol; propanona
etanóico; naftaleno > benzeno;
d) Éter dimetílico > etanol; propanona
etanóico; naftaleno > benzeno;
e) Éter dimetílico < etanol; propanona
etanóico; naftaleno < benzeno;
> ácido
< ácido
< ácido
> ácido
< ácido
19) (FUVEST SP)
Examinando-se as estruturas
moleculares do álcool benzílico e do tolueno,
CH2OH
Álcool
Benzílico
CH3
Tolueno
pode-se afirmar corretamente que
a) o álcool benzílico deve ter ponto de ebulição
maior do que o tolueno, ambos sob mesma
pressão.
b) o álcool benzílico deve ser menos solúvel em
água do que o tolueno, ambos à mesma
temperatura.
c) o álcool benzílico e o tolueno, ambos à mesma
temperatura, têm a mesma pressão de vapor.
d) o álcool benzílico e o tolueno possuem
moléculas associadas por ligações de
hidrogênio.
e) o álcool benzílico apresenta atividade óptica,
enquanto o tolueno não.
e) I e II.
GABARITO
01) D
06) E
11) A
16) D
02) E
07) B
12) C
17) C
03) C
08) D
13) C
18) B
04) C
09) C
14) *
19) A
05) 12
10) B
15) C
20) B
*14) a) devido à presença do grupo hidroxila responsável pela
formação de pontes de hidrgênio (ligações de hidrogênio) com a
água.
b) o oxigênio é gás devido ás fracas forças intermoleculares do
tipo dipolo-induzido e devido à baixa massa molecular;
o
benzeno é líquido devido à sua massa molecular ser maior,
porém ainda apresenta interações do tipo dipolo-induzido; o
catecol é sólido devido a sua alta massa molecular e à presença
de interações do tipo pontes
de hidrogênio (ligações de
hidrogênio).
4
Valério – Sociologia – 2010