Trabalho Submetido para Avaliação - 13/09/2012 16:32:25
FUNÇÃO DO ELEMENTO SÓDIO NO ORGANISMO HUMANO
ISRAEL SILVA DO PRADO ([email protected]) / Química - UNIFRA, Santa Maria Rio Grande
do Sul
PALOMA LENCINA DE MELLO ([email protected]) / Filosofia - UNIFRA, Santa Maria Rio
Grande do Sul
ORIENTADOR: ALINE MARQUES DA SILVA ([email protected]) / Química - UNIFRA, Santa Maria
Rio Grande do Sul
Palavras-Chave:
Sódio, reativo, Hiponatremia hipernatremia, rins, sangue
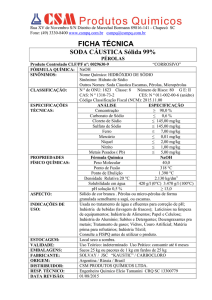
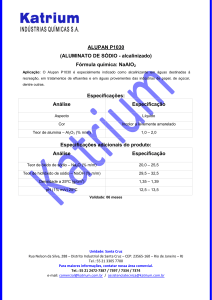
O sódio é um elemento químico de símbolo Na (Natrium em latim), de número atômico 11 sua massa
atômica 23 u. É um metal alcalino, sólido na temperatura ambiente, macio, de coloração branca, ligeiramente
prateada. Foi em 1807 isolado por Sir Humphry Davy por meio da eletrólise da soda cáustica fundida (se a
eletrólise for feita com solução de soda cáustica, irá obter-se hidrogênio e oxigênio apenas). O sódio metálico
emprega-se em síntese orgânica como agente redutor. Segundo (Atkins/Jones, Princípios da Química, Porto
Alegre, Bookman 2001).É também componente do cloreto de sódio (NaCl) necessário para a vida. É muito
abundante na natureza, encontrado no mineral halita. Na sua forma metálica é muito reativo, se oxida com o
ar, reage violentamente com a água é muito corrosivo quando entra em contato com a pele. Não é
encontrado, livre na natureza decompõe a água produzindo um hidróxido com desprendimento de
hidrogênio. Normalmente não arde em contato com o ar abaixo de 388 K(115 °C). Em ligas anti-atrito com o
chumbo para a produção de balas (projéteis). Com o chumbo também é usado para a produção de aditivos
antidetonantes para as gasolinas. Na fabricação de detergente combinando-o com ácidos graxos. É
empregado na fabricação de células fotoelétricas. Na iluminação pública, através das lâmpadas de vapor de
sódio. O sódio é relativamente abundante nas estrelas, detectando-se sua presença através da linha D do
espectro solar, situada aproximadamente no amarelo. A crosta terrestre contém aproximadamente 2,6% de
sódio, sendo o quarto elemento mais abundante e o mais comum entre os metais alcalinos. Na forma
metálica o sódio é explosivo, em água é venenoso quando combinado com muitos outros elementos. O metal
deve ser sempre manipulado com muito cuidado e, armazenado em atmosfera ou fluidos inertes
(normalmente se usam os hidrocarbonetos desidratados, como o querosene) evitando o contato com a água
e outras substâncias com os quais o sódio reage. O uso de óculos de proteção é sempre necessário, pois
seus estilhaços, se houverem, podem reagir violentamente com o fluido lacrimal. Em caso de contato com a
pele, jamais deve lavar-se com água, mas sim com álcool absoluto, até a completa remoção do metal e
posteriormente, tratar como uma queimadura por álcali cáustico, como o hidróxido de sódio. Sua eliminação
é sempre feita em álcool etílico, com o qual reage lentamente, formando alcoolato que posteriormente pode
ser eliminado com água numa reação muito menos enérgica. O sódio é prontamente absorvido por
transporte ativo e passivo na parte superior do intestino delgado e transportado para os rins, onde é filtrado,
retornando para o sangue em níveis apropriados. É excretado principalmente na urina (90-95%), além de
fezes e suor (2002). Sua concentração é controlada através da secreção de hormônios do sistema reninaangiotensina-aldosterona e antidiuréticos. Quando os níveis de sódio no sangue aumentam ocorre o estimulo
de sua excreção urinária e da sensação de sede para que haja aumento da ingestão hídrica, por outro lado,
quando os níveis estão baixos, a excreção urinária de sódio diminui para que se amenizem as perdas
(CARDOSO E VANNUCCHI, 2006; MAHAN E STUMP, 2002). O consumo excessivo de sódio está
associado a aumento da pressão arterial, doenças cardiovasculares, doenças renais, entre outras doenças
crônicas (DRI, 2004; WHO, 2007). Além disso, ainda interfere na absorção e metabolismo do cálcio, podendo
ter impacto negativo na saúde óssea (PEREIRA, 2009). Segundo alguns estudos, o consumo de sódio da
população brasileira chega a ser de três a cinco vezes superiores ao recomendado (COZZOLINO, 2007;
SARNO, 2009), que é de 1,5g/dia (DRI, 2004), com limite máximo de 2g/dia, que correspondem a 5g de sal
(WHO, 2003). Em geral, o consumo é na forma de sal de cozinha, mas pode ser também a partir de diversos
produtos industrializados, além de frutas e hortaliças em quantidades variadas (MAHAN E STUMP, 2002).
Quando há uma queda rápida dos níveis de sódio, ou quando o sódio sérico é menor que 135mEq/L ocorre a
hiponatremia, que desencadeia sintomas como: confusão mental, letargia, anorexia, convulsões, coma,
náuseas, vômitos, câimbras, fraqueza. Nesse caso, é importante a restrição hídrica e a reposição de sódio.
Por outro lado, pode ocorrer a hipernatremia, caracterizada por níveis de sódio elevados no sangue (maior
que 142mEq/L), que tem como sintomas: sede intensa, confusão mental, fraqueza, náuseas, oligúria,
irritabilidade e câimbras, sendo fundamental a restrição no consumo de sódio e hidratação (VANNUCCHI E
MARCHINI, 2007). Além disso, o consumo excessivo de sódio pode agravar diversas doenças crônicas como
já mencionado anteriormente. O sódio é essencial para o organismo, porém, deve-se atentar que a
quantidade consumida para evitar exageros e consequentemente seus efeitos maléficos. Além disso, é
fundamental que se tenha uma boa hidratação para que seja mantido o equilíbrio entre sódio e água no
corpo
REFERÊNCIAS:
ATKINS, P.; JONES, L. ; Princípios da química; Porto Alegre; Bookman; 2001.
http://cienciaesaude.uol.com.br/ultnot/2009/05/13/ult4477u1614.jhtm; ciência e Saúde;
http://cienciaesaude.uol.com.br/ultnot/2009/05/13/ult4477u1614.jhtm; Agosto 2012.
Wikipédia; Sódio ; http://pt.wikipedia.org/wiki/S%C3%B3dio; Agosto 2012.