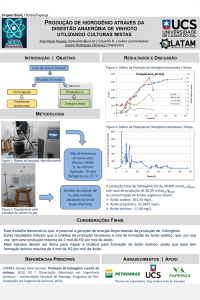
Universidade Federal Rural do Semi­Árido – UFERSA 1. Reações de Alcanos Os alcanos são caracterizados por apresentar pouca reatividade a muitos reagentes químicos. As ligações carbono‐carbono e hidrogênio‐hidrogênio são bastante fortes; elas não quebram, a não ser que os alcanos sejam aquecidos a temperaturas muito elevadas. Como os átomos de carbono e de hidrogênio têm quase a mesma eletronegatividade, as ligações carbono‐hidrogênio dos alcanos são pouco polarizadas. Como conseqüência, não são, de modo geral, afetados pela maioria das bases. As moléculas dos alcanos não possuem elétrons não‐
compartilhados para oferecer campos para ataques de ácidos. Essa baixa reatividade dos alcanos em relação a vários reagentes explica o fato de os alcanos terem sido originalmente chamados de parafinas (do latim: parum affinis, pouca afinidade). Contudo, alcanos sofrem algumas poucas reações que discutiremos a seguir. 1.1 Reações de Substituição Por Radicais Como visto anteriormente, a formação de radicais é dada pela quebra homolítica de ligações. Para que esta quebra ocorra é necessário que haja o fornecimento de energia na forma de calor (aquecimento) ou irradiação de luz. Exemplo 1: Peróxidos R
O O
R
Calor
2R
O
Exemplo 2: Halogênios X X
Calor o u Luz
2
X
1 Prof. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido – UFERSA Os radicais são altamente reativos. Quando colidem com outras moléculas (de alcano, por exemplo), tendem a reagir para alcançar a estabilidade. 1.1.1 Mecanismo de Reações de Substituição Por Radicais Numa Reação de Substituição por Radicais, os halogênios na forma de radicais são primeiramente formados e, devido serem altamente reativos, ao entrar em contato com moléculas de alcano reagem substituindo um dos hidrogênios do alcano pelo halogênio em questão. Em outras palavras, um radical de halogênio extrai um hidrogênio de um alcano. Exemplo 1: Cl2 + C2H6 C2H5Cl + HCl Mecanismo: Na primeira etapa ocorre a formação dos radicais halogênios ao se fornecer luz ou calor. Cl Cl
Calor ou Luz
2 Cl
Na segunda etapa o radical halogênio interage com o alcano. Nesta interação, ocorre simultaneamente a quebra homolítica da ligação carbono‐
hidrogênio e formação de uma ligação covalente entre o hidrogênio e o cloro. Cl
+
H
H
HC
C
H
H
H
H
H
C
C
H
H
H
+ HCl
Após perder um hidrogênio o alcano se torna um radical e, como tal é bastante reativo, devendo assim, reagir com outra espécie (um outro radical de cloro, por exemplo) para alcançar a estabilidade. Esta é a terceira e última etapa deste mecanismo. 2 Prof. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido – UFERSA Cl
+
H
H
C
C
H
H
H
H
H
Cl C
C
H
H
H ou Cl
H
H
C
C
H
H
H + HCl
Exemplo 2: Cl2 + C3H8 C3H7Cl + HCl Na primeira etapa ocorre a formação dos radicais halogênios Calor ou Luz
Cl Cl
2 Cl
Na segunda etapa o radical halogênio interage com o alcano. Nesta interação, ocorre simultaneamente a quebra homolítica da ligação carbono‐
hidrogênio e formação de uma ligação covalente entre o hidrogênio e o cloro. Entretanto, agora existem duas possibilidades de ataques: No caminho (a) ocorre a remoção de um hidrogênio primário e no caminho (b) ocorre a remoção de um hidrogênio secundário. (a)
(b)
Cl
H
H
H
C
C
C
H
H
H
H
H
H
C
C
C
H
H
H
+ H
H
H
H
H
H
H
H
C
C
C
H
H
H
H
H
H
C
C
C
H
H
+ HCl
H
+ HCl
H
Cl
Qual será o caminho reacional mais favorável? 3 Prof. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido – UFERSA O parâmetro decisivo será a formação do radical mais estável e, como vis visto nas aulas anteriores, o radical secundário é mais estável do que o primário. Por tanto, a reação de halogenação (cloração) do butano forma preferencialmente o 2‐Cloro‐butano em comparação com o 1‐Cloro‐butano, pois no 2‐Cloro‐butano houve a formação de um radical secundário que é mais estável do que o radical primário no caso do 1‐Cloro‐butano. Quando se diz que o produto é preferencialmente formado, não indica que é o único produto formado, mas sim que ele é o produto majoritário, ou seja, forma numa proporção maior. (a)
+
Cl
H
H
H
C
C
C
H
H
H
H
Cl
H
H
H
C
C
C
H
H
H
H
+ HCl
Produto minoritário
(b)
H
H
H
H
C
C
C
H
H
H
H
H
H
H
C
C
C
H
Cl
H
H
+ HCl
Produto majoritário
Cl
O mesmo raciocínio deve ser adotado se ocorrer a formação de um radical terciário. 1.1.2 Energias de Dissociação Homolíticas de Ligações Covalentes Simples Quando átomos se combinam para formar moléculas, novas ligações químicas são formadas e, como resultado a energia é liberada. Isso é devido as moléculas dos produtos possuírem entalpia mais baixa (menor energia) do que a dos átomos separados. Quando os átomos de hidrogênio se combinam para formar moléculas de hidrogênio, por exemplo, a reação é exotérmica; ela envolve a liberação de 435 KJ de calor para cada mol de hidrogênio que é produzido. Em outras palavras, a reação libera 435 KJ/mol. 4 Prof. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido – UFERSA + H
H
H
H
ΔH = ‐435 KJ/mol Para romper as ligações covalentes, deve haver o fornecimento suficiente de energia. As reações, nas quais ocorre apenas o rompimento da ligação, serão sempre endotérmicas. A energia necessária para romper ligações covalentes de moléculas homoliticamente de moléculas de hidrogênio, por exemplo, é exatamente igual àquela envolvida quando átomos separados se combinam para formar as moléculas. Contudo, na reação de clivagem de ligação o ∆
H
As H
energias H
necessárias + H
para é positivo. ΔH = +435 KJ/mol romper as ligações covalentes, homoliticamente, foram determinadas experimentalmente para vários tipos de reação. Essas energias são chamadas energias de dissociação homolíticas das reações (∆
). Valores de ∆
estão tabelados abaixo: 5 Prof. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido – UFERSA Podemos usar os valores das energias de dissociação homolítica para determinar a variação de entalpia (∆
) para uma reação. Para fazer tal cálculo devemos ter em mente que para o rompimento a ligação o ΔHo é positivo, e para a formação de ligação o ΔHo é negativo. Vamos considerar o exemplo da reação do gás cloro com o etano: Exemplo 2: Cl2 + C2H6 C2H5Cl + HCl Cl
H
Cl +
ΔH= +243 K J/mol
H
H
C
C
H
H
Cl
H
ΔH = +410 KJ/mol
H
H
C
C
H
H
H
ΔH= ‐341 KJ/mol
H
+
Cl
ΔH= ‐431 KJ/mol
ΔH= ‐772 KJ/mol
ΔH= +653 K J/mol
ΔH= ‐119 KJ/mol
Assim, concluí‐se que a reação é exotérmica. Exemplo 2: Cl2 + C3H8 C3H7Cl + HCl Se examinarmos a tabela de energia de dissociação homolítica podemos obter o valor da quebra da ligação carbono‐hidrogênio primário e da ligação carbono‐hidrogênio secundário, os valores são os seguintes: H
H
H
H
H
C
C
C
H
H
H
H
H
H
C
C
C
H
H
H
H
H
H
H
H
C
C
C
+ H
ΔH= +410 KJ/mol
H H
H
Radical propila
(um radical primário)
H
H
H
H
H
C
C
C
H + H
H
H
Radical propila
(um radical primário)
ΔH= +395 KJ/mol
Exercício: Calcule o ΔHo da reação para a formação do cloropropano e a do 2­
cloropropano. 6 Prof. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido – UFERSA Estas reações se parecem uma com a outra em dois aspectos: ambas começam com o mesmo alcano (propano), e produzem um radical alquila e um hidrogênio. Elas diferem, entretanto, na quantidade de energia necessária e no tipo de radical de carbono produzido. Para produzir o radical alquila primário é necessário uma quantidade de energia (+410 KJ/mol) maior do que para formar um radical alquila secundário (+395 KJ/mol). Como a estabilidade relativa de uma espécie química é inversamente proporcional a sua energia, o radical secundário é o mais estável, pois necessita de absorver uma quantidade menor de energia. 2. Outros Tipos de Reações dos Alcanos Os alcanos devido serem relativamente inertes sofrem poucas reações sempre precisando de algumas condições especiais. 2.1 Reações de Combustão Quando provocamos a ignição de alcanos ou cicloalcanos na presença de oxigênio produzem o dióxido de carbono, água e calor, se a reação for completa. Por exemplo, a combustão do metano, que é o principal constituinte do gás natural. CH4 (g) + 2 O 2 (g)
CO 2 (g) +
2 H2O(l) ΔH = ‐890 KJ/mol A combustão de é muito exotérmica, fornecendo sempre CO2 e H2O, desde que a reação seja completa. Caso a reação ocorra parcialmente pode levar a formação de monóxido de carbono (CO) que é um gás bastante tóxico ou, ainda, pode haver a formação de carbono sólido, vulgarmente chamado de fuligem. O mecanismo é bastante complexo devido ocorrer a formação de intermediários. Contudo, o mecanismo é radicalar. 2.2 Reações de Sulfonação Quando reagimos um alcano com um ácido sulfúrico (H2SO4) sob aquecimento ocorre uma reação de sulfonação. Exemplo: 7 Prof. Zilvam Melo – Química Orgânica Universidade Federal Rural do Semi­Árido – UFERSA H
H
H
C
C
H
H
H
+
HO
SO 3H
H
H
H
C
C
H
H
SO3H
+
H2O
2.3 Reações de Nitração Quando reagimos um alcano com ácido nítrico (HNO3) sob aquecimento ocorre uma reação de nitração. Exemplo: H
H
H
C
C
H
H
H
+
HO
NO2
H
H
H
C
C
H
H
NO2
+
2.4 Reações de Pirólise Pirólise (do Grego pyr, pyrós = fogo + lýsis = dissolução) é um processo onde ocorre uma ruptura da estrutura molecular original de um determinado composto pela ação do calor em um ambiente com pouco ou nenhum oxigênio. A pirólise pode ser chamada craqueamento térmico e o produto que se obtém são cadeias não‐ramificadas, menores que a original. Quando a pirólise ocorre na presença de catalisadores o processo é chamado craqueamento catalítico e o produto que se obtém são cadeias ramificadas, menores que a original. O craqueamento catalítico é bastante usado na indústria petroquímica na fabricação de gasolina, pois uma gasolina de boa qualidade tem alto teor de hidrocarbonetos de cadeia ramificada. Outra aplicação da pirólise é no tratamento do lixo ocasionando sua decomposição. 8 Prof. Zilvam Melo – Química Orgânica H2O
Universidade Federal Rural do Semi­Árido – UFERSA Exemplo: sem O 2/cat.
2
sem O 2/cat.
3. Referências 1. SOLOMONS, T. W.; GRAHAM; CRAIG FRYHLE. Química Orgânica. 8. ed. Rio de Janeiro: LTC, 2005. 1 e 2 v. 2. BRUICE, P. Y. Química Orgânica. 4. ed. São Paulo: Pearson, 2006 3. ALLINGER, N. L. Química Orgânica. 2. ed. Rio de Janeiro: Guanabara, 1978. 9 Prof. Zilvam Melo – Química Orgânica